牛新孢子虫二温式PCR检测方法的建立与应用*
季新成,王 文,牛国辉,郑 培,张 玲
(1.新疆出入境检验检疫局,新疆乌鲁木齐 830063;2.新疆动物防疫监督总站,新疆乌鲁木齐 830060;3.新疆计量测试研究院,新疆乌鲁木齐 830011)
牛新孢子虫二温式PCR检测方法的建立与应用*
季新成1,王 文2,牛国辉3,郑 培1,张 玲1
(1.新疆出入境检验检疫局,新疆乌鲁木齐 830063;2.新疆动物防疫监督总站,新疆乌鲁木齐 830060;3.新疆计量测试研究院,新疆乌鲁木齐 830011)
根据已发表的犬新孢子虫种属特异性基因片段Nc-5基因序列设计合成一对特异性引物,采用均匀设计方法对引物浓度、Mg2+浓度、dNTP、Taq酶和退火温度进行了优化,建立了检测牛新孢子虫的二温式PCR方法。该方法对牛新孢子虫DNA的检测灵敏度为23.5 fg/反应。应用该方法对50份全血和8份流产胎儿样本进行了检测,有3份全血和1份流产胎儿样本为阳性。与三步法PCR相比较,该二温式PCR方法检测时间缩短了30 min,且方法具有快速、灵敏、准确、特异等优点,可用来对牛新孢子虫病的检测。
新孢子虫;二温式 PCR;均匀设计;牛
新孢子虫病(Neosporosis)是由犬新孢子虫(Neospora caninum)寄生在宿主体内引起的一种原虫病。该病可垂直传播,带虫母畜可将病原直接传给新生犊畜,是全球性奶牛流产的主要病因之一,给奶牛业造成巨大的经济损失[1-2]。该病呈世界范围内广泛分布。迄今为止,还没有防治此病的有效药物和疫苗,及时检出病牛并隔离、淘汰是消灭或控制本病的一种有效方法。目前实验室较为常用的检测方法有间接荧光抗体试验、免疫组织化学检测法、亲和素-生物素-过氧化物酶染色法、酶联免疫吸附试验、乳胶凝集试验和免疫印迹法等[3]。早在1996年Payne S等[4]就开始用DNA体外扩增方法检测新孢子虫,PCR方法对犬新孢子虫的检测具有快速、特异、灵敏等优点,该方法可以用来检测脑、肺、肝和体液等多种样本中的感染虫体,且具有特异性强,检测范围广等优点[5-7]。
本研究根据PCR技术原理,采用均匀设计方法,建立了检测牛新孢子虫病的二温式PCR检测方法,该二温式PCR方法与三步法PCR相比较,检测时间缩短了30 min,有效地提高了检测速度。并应用该方法对临床样品进行了检测。
1 材料与方法
1.1 材料
1.1.1 阳性核酸和临床样品 牛新孢子虫Nc-5基因阳性核酸和刚地弓形虫阳性核酸由中国农业大学刘群教授惠赠;牛传染性牛鼻气管炎、牛环形泰勒虫、牛瑟氏泰勒虫和牛伊氏锥虫等病原阳性核酸样品由新疆出入境检验检疫局技术中心实验室保存;牛抗凝全血和流产胎儿组织病料等样品采自新疆不同牛场。
1.1.2 主要试剂及仪器 全血基因组DNA提取试剂盒(DP1102)和DNAzol基因组DNA快速提取试剂(DP3002)购自百泰克公司;TaqDNA聚合酶、DNA Marker DL 2 000等购自宝生物工程(大连)有限公司产品,引物由大连宝生物工程有限公司合成。常规PCR仪为Biometra公司产品,Lambda35紫外分光光度计为PE公司产品。
1.2 方法
1.2.1 模板DNA的制备 抗凝全血按照全血基因组DNA提取试剂盒说明书进行操作;流产胎儿组织先经液氮研磨,然后按照百泰克公司的DNAzol基因组DNA快速提取试剂说明进行操作。
1.2.2 引物的设计与合成 根据已知的犬新孢子虫种属特异性基因片段Nc-5基因序列,应用Primer premier 5.0引物设计软件设计特异性引物Np和Nr,序列分别为 Np:5′-GTGGT T TGTGGTTAGTCATTCG-3′和 Nr:5′-GCATAATCTCCACCGTCATCAG-3′,扩增的目的基因长 138 bp。用 Blast软件进行核苷酸同源性分析,验证序列的特异性。
1.2.3 PCR反应体系及循环条件的优化 用均匀设计方法,通过 Uniform Design 2.1软件对影响PCR反应的主要参数 Tm值、Mg2+浓度、dNT Ps浓度、引物浓度和TaqDNA聚合酶进行优化(表1)。
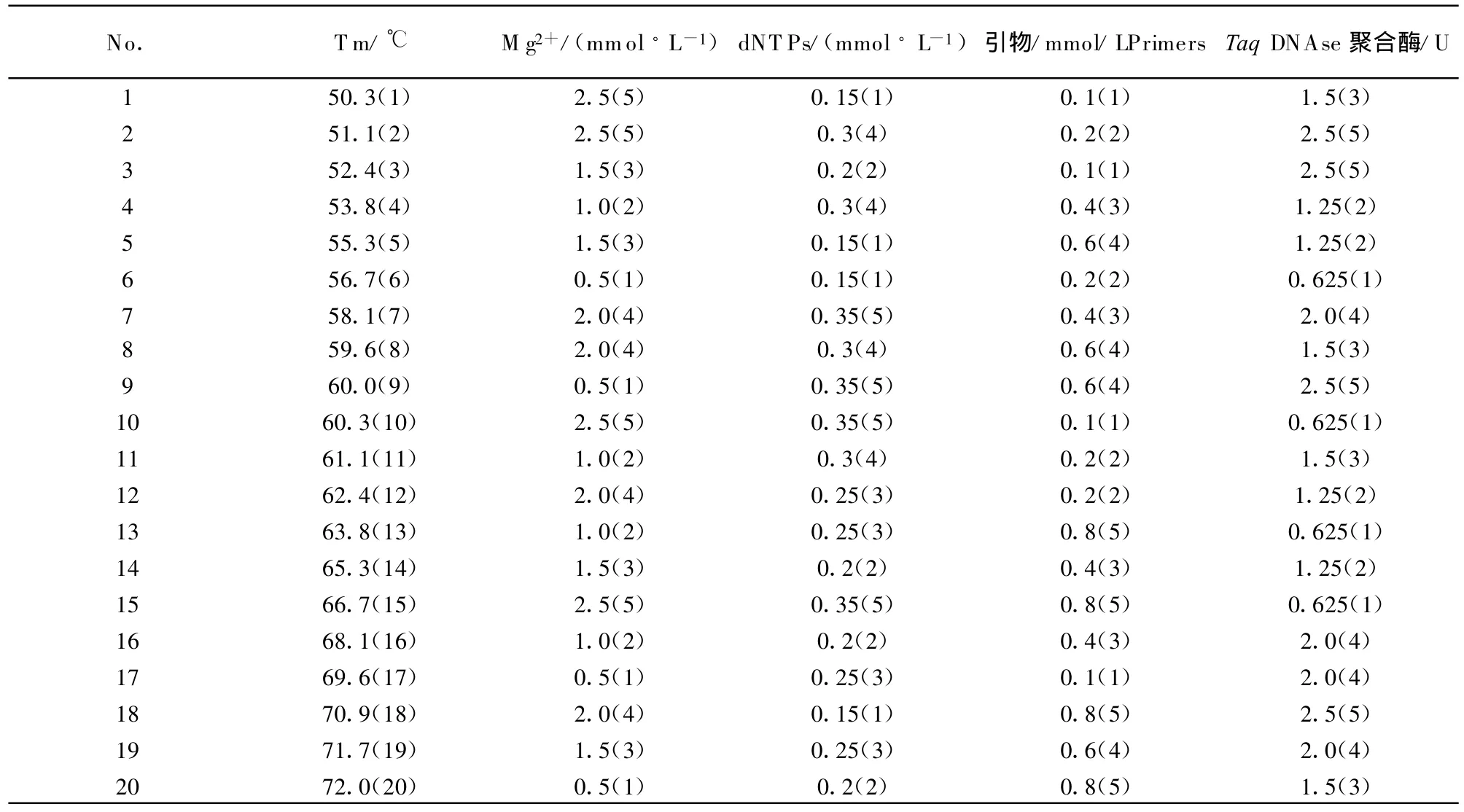
表1 利用均匀设计方法优化二温式PCR扩增方案U20(20×54)Table 1 Optimization of two-temperature PCR by uniform design U20(20×54)
1.2.4 PCR产物的检测 取 PCR产物各5 μL,在10 g/L琼脂糖凝胶(0.5 μg/mL EB)上进行电泳并拍照。
1.2.5 特异性试验 采用优化后的检测方法分别对牛传染性牛鼻气管炎病毒、刚地弓形虫、牛环形泰勒虫、牛瑟氏泰勒虫和牛伊氏锥虫等核酸样品扩增。每次扩增反应同时设双蒸水作阴性对照和牛新孢子虫作阳性对照,扩增反应结束后用凝胶电泳检测。
1.2.6 敏感性试验 将新孢子虫DNA经分光光度计测定浓度后,进行10倍稀释稀释,用1.2.3优化后的反应条件扩增。
1.2.7 重复性和稳定性试验 选取3个梯度用所建立的二温式PCR方法分别进行3次重复检测,测定所建立的二温式PCR方法的重复性和稳定性。
1.2.8 方法的应用 用所建立的方法对采自新疆不同地区的50份抗凝全血和8份流产胎儿进行检测。
2 结果
2.1 PCR反应体系及循环条件的优化
应用均匀设计方法优化PCR反应体系为:25 μL反应体积中,Mg2+浓度 1.5 mmol/L,dNTPs浓度0.2 mmol/L,上下游引物浓度各0.4 mmol/L,TaqDNA聚合酶浓度1.25 U。最适反应条件为:94℃5 min;94℃30 s,65.3℃30 s,30个循环;最后65.3℃延伸7 min。PCR产物进行10 g/L琼脂糖凝胶电泳,在约138 bp处得到特异性条带,与预期设计片段大小相符(图1)。
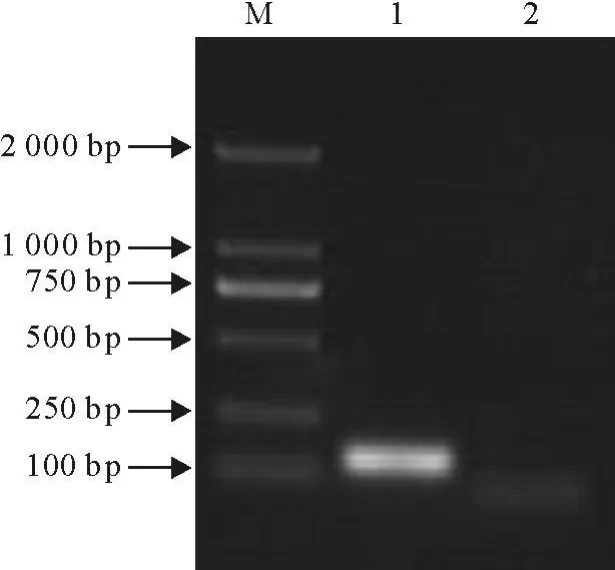
图1 PCR反应体系及循环条件的优化Fig.1 Optimization of the reaction system and circulation condition
2.2 特异性试验
通过对牛传染性牛鼻气管炎病毒、刚地弓形虫、牛环形泰勒虫、牛瑟氏泰勒虫和牛伊氏锥虫特异性试验,采用优化后的检测方法分别对牛鼻气管炎病毒、刚地弓形虫、牛环形泰勒虫、牛瑟氏泰勒虫和牛伊氏锥虫等核酸样品扩增。除新孢子虫DNA外,其余核酸均无特异性扩增条带,说明该方法对牛新孢子虫DNA具有较好的特异性(图2)。

图2 特异性试验结果Fig.2 T he results of specific tese
2.3 敏感性试验
根据DNA分光光度法测定模板DNA浓度为2.35 ng/μL。对10倍系列梯度稀释后进行PCR扩增,反应结束后进行凝胶电泳检测,结果表明,对于浓度为23.5 fg浓度的DNA仍能扩增处可见的目的条带,该方法的检测灵敏度为 23.5 fg/反应(图3)。
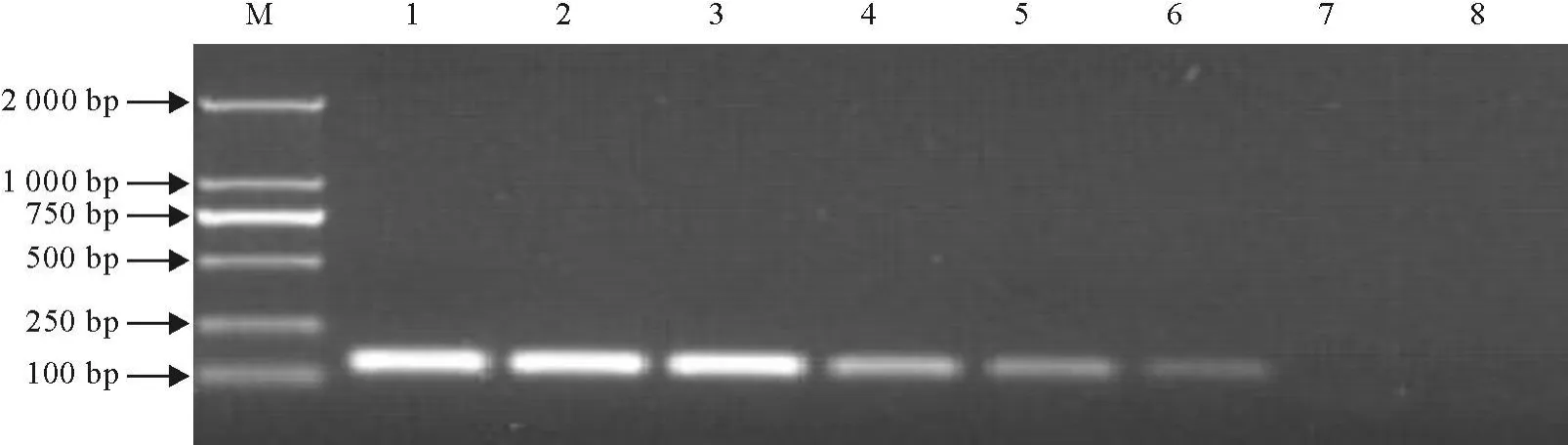
图3 敏感性试验结果Fig.3 T he results of sensitivity experiment
2.4 重复性和稳定性试验
选取3个梯度采用所建立的二温式PCR方法分别进行3次重复检测,均可扩增出约为138 bp的特异片段,表明该方法具有较好的重复性和稳定性。
2.4 应用检测
对采自新疆不同地区的50份流产牛全血和8份流产胎儿样品用该二温式PCR检测,结果有3份流产牛全血和1份流产胎儿样品呈阳性。
3 讨论
二温式聚合酶链反应,即二(或双)温式PCR(two-temperature PCR),也称两(或二)温度点法PCR、双温PCR或两温度梯度PCR[8-9],二温式PCR是根据经典PCR技术原理,对标准的PCR(三步法热循环步骤)进行改进,将退火和延伸合并为一个温度,只有两种温度变化,即变性和退火-延伸温度。一般PCR仪的升温速度为4℃/s,60℃到80℃的升温时间约为5 s;TaqDNA聚合酶活性最佳温度为72℃,此温度下的延伸速度为150 bp/s~300 bp/s酶分子,60℃~70℃时约为60 bp/s~120 bp/s酶分子,因而升温过程即可合成长度约为480 bp~800 bp的长链;所以如果扩增的片段较短(100 bp~500 bp),可以取消72℃延伸这一温度梯度,将退火和延伸合并为一个温度,扩增反应仍能照常发生。为了获得高特异性而采用高退火-延伸温度,范围可以高于理论温度5℃~10℃,达到60℃~70℃。因此在设计引物时就要有意识的提高Tm值,使引物与模板能准确结合而且稳定性好,以减少非特异扩增[10]。
本试验扩增的特异片段长度为138 bp,使用的二温式退火温度为 65.3℃;用常规 PCR需要约95 min,而应用二温式 PCR只要 65 min,提前30 min完成。所建立的二温式PCR与常规PCR相比,操作更快捷,更适合于对临床样品的快速检测。
为了获得理想的扩增效果,需对反应条件进行优化,目前普遍的做法是根据经验确定一个起始条件,然后根据试验结果调整某一个或某几个因素,使结果逐步接近最佳[11]。由于许多影响因素的可变范围较大,彼此间又存在着交互影响,试验结果常常存在极大的偶然性。均匀和正交设计可以解决多因素、多水平试验中的优化问题,与正交设计(需进行水平数的平方次试验)对比,均匀设计的最大优点是试验次数大大减少,并且具有试验次数少(与水平数相等)、布点均匀、结果可靠、易学易用等特点,更适合于像PCR这样多因素多水平试验的优选方案设计[12]。本研究采用均匀设计方法,进行二温式PCR反应体系和循环条件的优化,若运用正交设计,则试验次数至少是试验因素水平数的平方,即202=400,是均匀设计处理组合数20的水平数20倍,对于水平数高的多因素试验,运用均匀设计显然可以事倍功半。
本研究通过对GenBank中新孢子虫基因序列进行比较后,选择较为保守的Nc-5基因为研究对象,进行引物设计和反应条件优化后,建立了二温式PCR检测方法,经检测验证,该方法具有较好的特异性、敏感性和重复性,为新孢子虫病的快速灵敏检测提供了良好方法。
[1]De Oliveira V S,Alvarez-Garcia G,Ortega-Mora,et al.Abortions in bovines and Neospora caninum transmission in an embry o transfer center[J].Vet A rasitol,2010,173(3-4):206-210.
[2]Xia H Y,Zhou D H,Jia K,Zeng X B,et al.Seroprevalence of neospora caninum Infection in Dairy Cattle of Southern China[J].J Parasitol,2010,9(1)172-173.
[3]赵金萍,王春仁.奶牛新孢子虫病诊断方法研究进展[J].中国兽医寄生虫病,2005,13(3)42-46.
[4]Payne S,Ellis J.Detection ofNeospora caninumDNA by the poly merase chain reaction[J].International Journal For Parasitology,1996,26(4):347-351.
[5]Barratt J,Al Qassab S,Reichel M P,et al.The development and evaluation of a nested PCR assay for detection ofNeospora caninumandHammondia heydorniin feral mouse tissues[J].M ol Cell Probes,2008,22(4):228-233.
[6]Sanchez G F,Banda R V,Sahagun R A,et al.Comparison between immunohistochemistry and two PCR methods for detection ofNeospora caninumin formalin-fixed and paraffin-embedded brain tissue of bovine fetuses[J].Vet Parasitol,2009,162(2-4):328-332.
[7]岳 韬,秦建华,赵月兰,等.奶牛新孢子虫病PCR检测方法的建立[J].中国兽医学报,2008,28(4):386-389.
[8]范 晴,谢芝勋,刘加波,等.牛病毒性腹泻二温式 PCR检测方法的建立[J].中国奶牛,2010(10):1-3.
[9]邓显文,谢芝勋,谢丽基,等.二温式聚合酶链反应鉴别诊断迟缓爱德华氏菌病[J].水生态学杂志,2009,2(2):158-160.
[10]Dodson L A,Kant J A.Two-temperature PCR and heteroduplex detection:application to rapid cystic fibrosis screening[J].M ol Cell Probes,1991,5(1):21-25.
[11]Rychlik W,Spencer W J,Rhoads R E,et al.Optimization of the annealing temperature for DNA amplificationin vitro[J].Nucleic Acids Res,1990,18(21):6409-6412.
Establishment and Application of Two-temperature Polymerase Chain Reaction for Detection ofNeospora caninumin Cow
JI Xin-cheng1,WANG Wen2,NIU Guo-hui2,ZHENG Pei1,ZHANG Ling1
(1.Xinjiang Exit-import Inspection and Qurantin Bureau,Urumqi,Xinjiang,830063,China;
2.General Station of Xinjiang Animal Diseases Prevention,Control and Supervision,Urumqi,Xinjiang,830000,China;Xinjiang Research Institute of Measurement&Testing,Urumqi,Xinjiang,830060,China)
A pair of specific primers were designed according to the published Nc-5 gene sequence of Neosporacaninumin GenBank.After the optimization of Mg2+concentration,primers concentration,dNTP concentration,Taqenzyme and anneal temperate by uniform design method,a two-temperature PCR method was established to detect the infection ofN.caninum.T he sensitivity of the method toN.caninumwas 23.5 fg reach reaction.50 blood samples and 8 of fetal samples from abortion cow s were detected by the method.Three blood samples and one fetal sample were conformed as positive.The detection time reduced 30 minutes compared with three step PCR,and the method was rapid,sensitive,accurate and specific for the detection ofn.caninum.
Neospora coaninum;two-temperature PCR;uniform design;cow
S852.723;Q789
A
1007-5038(2011)08-0017-04
2011-01-11
国家质量监督检验检疫总局科研项目(2009IK011)
季新成(1977-),男,内蒙古赤峰人,博士,主要从事进出境动物及其产品的检验检疫技术研究。

