旋毛虫成虫丝氨酸蛋白酶对S774A.1巨噬细胞的毒性作用
于建立,白 雪,刘国兴,吴秀萍,王学林,刘明远
(吉林大学人兽共患病研究所 吉林大学畜牧兽医学院,吉林长春130062)
旋毛虫成虫丝氨酸蛋白酶对S774A.1巨噬细胞的毒性作用
于建立,白 雪,刘国兴,吴秀萍,王学林,刘明远*
(吉林大学人兽共患病研究所 吉林大学畜牧兽医学院,吉林长春130062)
为探究旋毛虫成虫排泄分泌抗原(ES)中丝氨酸蛋白酶对宿主免疫调节作用,用PCR扩增出旋毛虫成虫期特异性丝氨酸蛋白酶基因Zh68,克隆至表达载体pET28a,转化到大肠埃希菌BL21(DE3),经诱导表达后的重组蛋白免疫接种动物获取抗血清。将抗体封闭前后的ES分别作用于S774A.1巨噬细胞,CCK-8检测巨噬细胞的增殖情况,流式细胞仪检测细胞凋亡率。结果发现ES可以抑制S774A.1细胞增殖,并促使其出现凋亡趋势。但用Zh68多抗封闭ES后,这种作用减弱。证实了旋毛虫成虫ES中的丝氨酸蛋白酶可以抑制巨噬细胞增殖,促巨噬细胞出现凋亡趋势,从而为旋毛虫的侵袭与生存提供了有利的环境。
旋毛虫成虫;排泄分泌抗原;丝氨酸蛋白酶;巨噬细胞;毒性作用
*通讯作者
旋毛虫病是一种重要的人兽共患寄生虫病,由误食含有旋毛虫感染性肌幼虫的生的或半生的肉类引起。旋毛虫感染可以有效干扰宿主免疫,下调宿主炎性应答,致使宿主出现免疫抑制[1-2]。但由于旋毛虫抗原的复杂性,参与这种抑制作用的抗原分子及其机制仍不明确。吉林大学人兽共患病研究所食源性寄生虫病实验室构建旋毛虫3日龄成虫cDNA文库并免疫筛选获得一高丰度和强抗原性的丝氨酸蛋白酶基因[3]。对该阳性克隆Zh68序列进行分析发现其具有信号肽[4],是旋毛虫排泄分泌抗原(excretory-secretory antigens,ES)的重要成员。我们在此基础上,对该丝氨酸蛋白酶的生物学功能进一步研究,以探讨其在排泄分泌抗原中调控宿主免疫应答的重要作用。
1 材料与方法
1.1 材料
EcoRⅠ、XhoⅠ、T4DNA连接酶、TaqDNA聚合酶、IPTG为宝生物工程(大连)有限公司产品;质粒DNA快速制备试剂盒、DNA凝胶回收试剂盒为杭州维特洁生化试剂公司产品;原核表达载体pET-28a,BL21(DE3)为 Novagen公司产品;pBluescript-Zh68质粒和旋毛虫感染保种大鼠由吉林大学人兽共患病研究所食源性寄生虫病实验室提供;S774A.1巨噬细胞细胞由吉林大学刘波教授惠赠;细胞凋亡检测试剂盒为南京凯基生物科技发展有限公司产品。
1.2 方法
1.2.1 pET-28a-Zh68重组质粒构建及诱导表达 以pBluescript-Zh68质粒为模板设计特异性上下游引物,Zh68-F:5′-CC GAA TTC ATT TCA GGA GGC TCT-3′(含有EcoRⅠ酶切位点),Zh68-R:5′-TAA TAC GAC TCA CTA TAG G-3′(T7通用引物)。PCR扩增的Zh68基因和pET-28a载体分别用EcoRⅠ、XhoⅠ双酶切后用T4连接酶连接,转化入感受态菌BL21(DE3)。将阳性重组子单菌落接种于5 mL LB液体培养基中(卡那霉素100μg/mL),37℃震荡培养至OD600值达0.6时,加入IPTG使其终浓度为1mmol/L,37℃振荡诱导培养,分别诱导1、2、3、4、5h后收集菌体,超声破碎,进行SDS-PAGE检测。切下目的蛋白带放入透析袋中。120V电泳洗脱2h,置于装有500mL PBS烧杯中,4℃过夜透析。采用紫外分光光度法计算蛋白含量,保存于-20℃待用。
1.2.2 Zh68多克隆抗体的制备 纯化后的重组蛋白500μg与完全弗氏佐剂(FCA)等体积混合乳化皮下注射日本大耳白兔,每隔2周用纯化的蛋白与不完全弗氏佐剂(FIA)等体积乳化后加强免疫2次后,心脏采血分离血清,并用饱和硫酸铵沉淀法纯化抗体,用双向琼脂扩散法检测其效价。
1.2.3 旋毛虫成虫期ES收集 保种Wistar大鼠处死后胴体用人工消化液(含10g/L胃蛋白酶和10 mL/L浓盐酸)37℃消化2h,过筛并反复沉降清洗获取感染性肌幼虫,计数后每只wistar大鼠灌胃感染8 000条肌幼虫。于感染后3d剖杀大鼠,取肠收集成虫,并用IMDM培养液(含有青霉素100单位/mL,链霉素100单位/mL)于CO2培养箱中培养24h,收集上清作为ES备用。
1.2.4 细胞毒性分析及流式细胞分析 96孔板接种S774A.1细胞(3×104个/孔)加入成虫ES,浓度分别达到25、12.5、6.25、3.125、1.56μg/mL,于CO2培养箱中处理4、8、12、24h,加CCK-8溶液孵育3h后,在酶标仪450nm处检测吸光度。将ES与不同量的Zh68多抗于37℃水浴中处理1h后加入S774A.1细胞中,孵育24h后,再次用CCK-8检测。计算细胞存活率=(试验组-空白孔)吸光度值/(PBS组-空白孔)吸光度值。将上述处理的细胞用Annexin-V和PI染色后,上细胞流式仪检测。
1.2.5 统计学分析 采用SPSS 13.0软件进行分析,计量资料以均数+标准差表示,多组间比较采用单因素方差分析,组间两两比较用最小显著差(LSD)法。
2 结果
2.1 重组质粒的构建及鉴定
重组质粒经PCR扩增和EcoRⅠ和XhoⅠ双酶切后得到目的片段,且长度与设计长度相符,测序结果与原序列相同(图1)。重组表达质粒pET-28a-Zh68构建成功,可以用于表达。
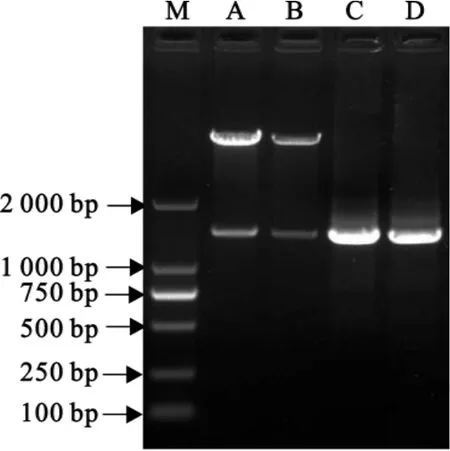
图1 重组质粒pET-28a-Zh68鉴定Fig.1 Identification of pET-28a-Zh68
2.2 重组质粒诱导表达及Zh68多抗制备
SDS-PAGE 检 测 显 示 重 组 菌 pET-28a-Zh68 BL21(DE3)与非重组菌pET-28a相比在47ku处出现了一条新的表达条带,该条带的分子质量大小与理论推导值相符。而0h诱导及诱导前后非重组的pET-28a对照菌均无特异性蛋白带(图2)。诱导表达的重组蛋白经切胶电洗脱纯化后成份较纯,不含有大肠埃希菌成分(图3)。将纯化蛋白免疫接种动物后获得的抗血清用饱和硫酸铵沉淀法纯化,通过琼脂扩散试验检测其效价为1∶8。
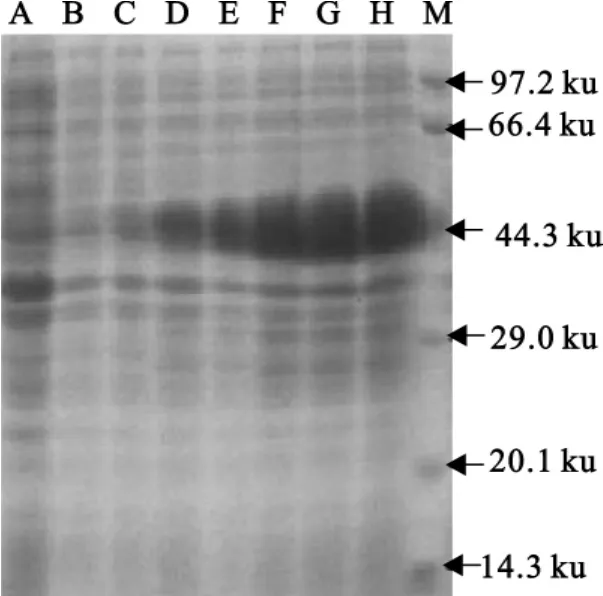
图2 重组质粒pET-28a-Zh68表达产物SDS-PAGE结果Fig.2 SDS-PAGE of expression products of pET-28a-Zh68
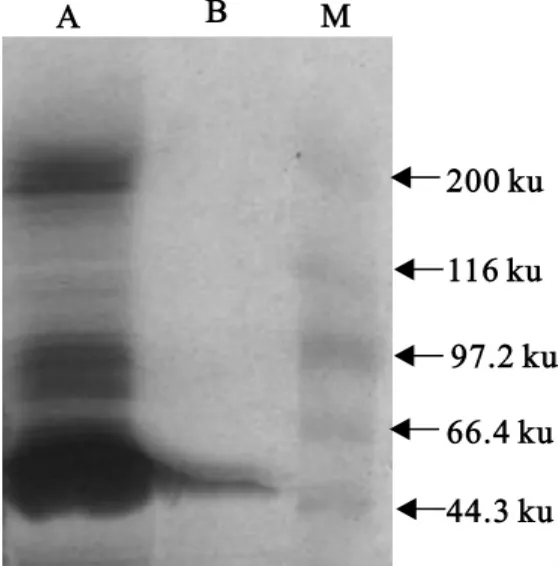
图3 重组蛋白纯化后SDS-PAGE结果Fig.3 The results of SDS-PAGE of purified recombination protein
2.3 细胞毒性分析
收集的ES经透析浓缩后测定蛋白浓度为350 μg/mL,25、12.5 、6.25、3.125、1.56μg/mL浓度的ES作用24h后,相对于PBS组,S774A.1细胞增殖均不同程度受到抑制(图4),表明ES以剂量依赖性方式抑制S774A.1细胞的增殖。ES作用细胞时间的长短也在一定程度上影响其对S774A.1细胞生长抑制水平(图5)。ES经Zh68多抗封闭后毒性作用减弱(图6),当两者比例达到1∶5后细胞存活率达到最高,之后不再上升,与PBS组对比仍然有统计学上的差异。
2.4 流式细胞分析
我们通过Annexin V和PI双标记,用流式细胞仪检测了ES在明显抑制S774A.1细胞增殖的浓度(12.5μg/mL)作用下巨噬细胞的凋亡情况。结果显示,作用24h后,细胞出现了凋亡,但是加入丝氨酸蛋白酶Zh68多抗预处理后,这种凋亡趋势降低(图7)。
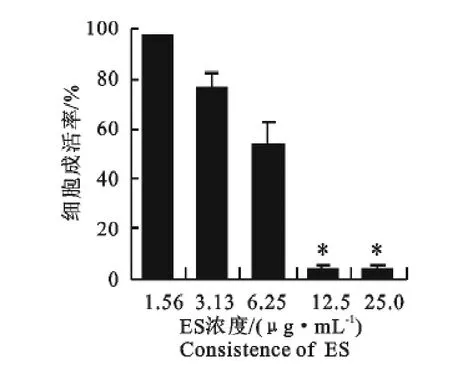
图4 不同ES浓度对S774A.1细胞的影响Fig.4 The effect of ES at different concentrations on S774A.1cells
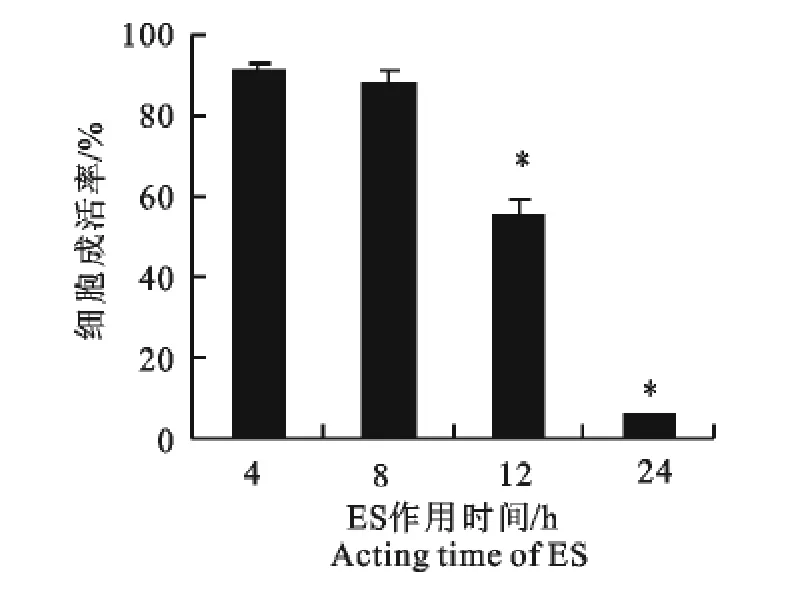
图5 不同ES作用时间对S774A.1细胞的影响Fig.5 The effect of ES at different acting time on S774A.1cells
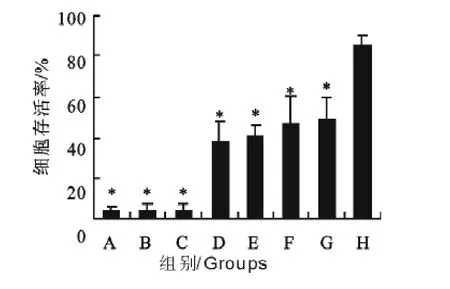
图6 与不同比例多克隆抗体共孵育后ES对S774A.1细胞的影响Fig.6 The effect of ES which incubated with Zh68antibody at different proportion on S774A.1cells

图7 流式细胞仪检测S774A.1细胞凋亡结果Fig.7 Determination of apoptosis of S774A.1macrophages by FCM
3 讨论
巨噬细胞是机体先天性免疫系统的重要成员,它可以非特异性吞噬杀伤多种病原微生物,与粒细胞、单核细胞、肥大细胞等共同构成了机体的快速免疫反应机制。同时巨噬细胞在机体后天获得性免疫应答的启动和发展方向上起到了重要作用,它可以通过自身的经典激活通路[5]或选择性激活通路[6-7]来调控宿主的Th1和Th2型免疫应答。Marta K S等[8]发现巨噬细胞及其产物NO、O2-等与旋毛虫感染小鼠免疫反应密切相关。鉴于巨噬细胞在宿主免疫系统中重要作用,本研究选取小鼠S774A.1巨噬细胞作为研究对象,通过丝氨酸蛋白酶多抗封闭前后ES对S774A.1细胞影响作用的对比,来探讨旋毛虫成虫ES中丝氨酸蛋白酶对宿主免疫系统的影响。传统上对寄生虫抗原的分子研究常常采用原核或真核表达目的蛋白的方式来进行,但前者表达蛋白无活性,后者蛋白表达量低下,所以本研究采用体外培养旋毛虫成虫收集排泄分泌抗原来获取较大量的有天然活性的丝氨酸蛋白酶。但是该ES除了丝氨酸蛋白酶外还有其他复杂的成分,所以本研究用原核表达丝氨酸蛋白酶免疫动物获取丝氨酸蛋白酶多克隆抗体,通过抗体封闭作用来调控相同复杂背景下丝氨酸蛋白酶的存在与缺失。
通过试验结果发现,ES可以明显抑制S774A.1细胞增殖,并促使其出现凋亡趋势。但用成虫期丝氨酸蛋白酶多克隆抗体封闭后的ES毒性作用降低,这说明成虫期丝氨酸蛋白酶在ES对抑制巨噬细胞增殖、促进其凋亡过程中起到了重要作用。丝氨酸蛋白酶广泛存在于寄生性蠕虫分泌物中,在蠕虫的生活史及致病机制中起到了重要作用。例如,布鲁丝虫可分泌丝氨酸蛋白酶灭活补体C5a,从而抑制宿主外周末梢血液中粒细胞的趋化性[9];曼氏血吸虫童虫通过自身分泌的丝氨酸蛋白酶降解免疫球蛋白IgE,从而抑制宿主免疫应答[10]。Todotova V K等[11-12]在对旋毛虫成虫ES中蛋白酶成分及活性检测中发现了具有显著作用的丝氨酸蛋白酶,并随后对其进行亲和层析纯化,鉴定其具有强抗原性,可被旋毛虫感染小鼠血清所抑制活性。但丝氨酸蛋白酶究竟在旋毛虫致病机制中起到什么作用却未阐明。Barriga O O 等[13]及Faubert G M 等[14]通过大量研究结果和试验现象,认为旋毛虫对感染宿主机体的免疫抑制仅发生在成虫和新生幼虫阶段的侵袭期。作为旋毛虫成虫ES中最重要成员,丝氨酸蛋白酶在宿主免疫抑制中的作用就不容忽视。本试验证实了旋毛虫成虫ES中丝氨酸蛋白酶对巨噬细胞具有抑制增殖和促进凋亡作用,为旋毛虫侵袭宿主提供了有利的环境。另有研究表明,包括旋毛虫在内的线虫ES可以抑制树突状细胞成熟[15-16],从而发挥免疫抑制作用,而巨噬细胞同样作为一种重要的抗原递呈细胞,其增殖受到抑制和出现凋亡现象也可间接说明感染旋毛虫宿主的免疫抑制现象。本研究为旋毛虫病防治的关键和准确分子靶标的确定奠定了一定的基础。
[1] Boitelle A,Di L C,Scales H E,et al.Contrasting effects of acute and chronic gastro-intestinal helminth infections on a heterologous immune response in a transgenic adoptive transfer model[J].Int J Parasitol,2005,35(7):765-775.
[2] Gruden M A,Ilic N,Mostarica S M,et al.Trichinellaspiralis:modulation of experimental autoimmune encephalomyelitis in DA rats[J].Exp Parasitol,2008,118(4):641-647.
[3] 张亚兰,付宝权,刘明远,等.旋毛虫3日龄成虫cDNA文库的免疫筛选[J].中国兽医学报,2004,24(4):355-357.
[4] 李莲瑞,付宝权,卢 强,等.旋毛虫丝氨酸蛋白酶基因的克隆与分析[J].中国兽医科学,2008,38(3):200-205.
[5] Underhill D M,Ozinsky A.Phagocytosis of microbes:complexity in action[J].Annu Rev Immunol,2002,20(1):825-852.
[6] Loke P,MacDonald A S,Robb A,et al.Alternatively activated macrophages induced by nematode infection inhibit proliferation via cell-to-cell contact[J].Eur J Immunol,2000,30(9):2669-2678.
[7] Donnelly S,O'Neill SM,Sekiya M,et al.Thioredoxin peroxidase secreted by Fasciola hepatica induces the alternative activation of macrophages[J].Infect Immun,2005,73(1):166-173.
[8] Marta K S,Dvoroznakova E,Dziemian E.Trichinella spiralis:macrophage activity and antibody response in chronic murine infection[J].Exp Parasitol,2006,112(1):52-62.
[9] Rees R D,Mullen L M,Gounaris K,et al.Inactivation of the complement anaphylatoxin C5aby secreted products of parasitic nematodes[J].Int J Parasitol,2010,40(5):527-532.
[10] Pleass R J,Kusel J R,Woof J M.Cleavage of human IgE mediated bySchistosomamansoni[J].Int Arch Allergy Immunol,2000,121(3):194-204.
[11] Todorova V K,Knox D P,Kennedy M W.Proteinases in the excretory/secretory products (ES)of adultTrichinellaspiralis[J].Parasitology,1995,111(2):201-208.
[12] Todorova V K,Stoyanov D I.Partial characterization of serine proteases secreted by adultTrichinellaspiralis[J].Parasitol Res,2000,86(8):684-687.
[13] Barriga O O.Responses of B-cells to mitogens and antigen in mice receiving isogenic splenocytes from animals treated withTrichinellaextract[J].J Parasitol,1980,66(5):730-734.
[14] Faubert G M.The reversal of the immunodepression phenomenon in trichinellosis and its effect on the life cycle of the parasite[J].Parasite Immunol,1982,4(1):13-20.
[15] Langelaar M,Aranzamendi C,Franssen F,et al.Suppression of dendritic cell maturation byTrichinellaspiralisexcretory/secretory products[J].Parasite Immunol,2009,31(10):641-645.
[16] Segura S,Su Z,Piccirillo C,et al.Impairment of dendritic cell function by excretory-secretory products:A potential mechanism for nematode-induced immunosuppression[J].Eur J Immunol,2007,37(7):1887-1904.
Toxicity of Serine Ptotease of Adult
Trichinellaspiralison S774A.1 Macrophages
YU Jian-li,BAI Xue,LIU Guo-xing,WU Xiu-ping,WANG Xue-lin,LIU Ming-yuan
(InstituteofZoonoses,CollegeofAnimalScienceandVeterinaryMedicine,JilinUniversity,Changchun,Jilin,130062,China)
To investigate the effect of serine protease in excretory-secretory antigens(ES)antigens of adultTrichinellaspiralison the host's immune system,full length sequence of serine protease gene Zh68was amplified by PCR.The PCR products was cloned into pET28avector,and the positive recombinant plasmid was transformed intoEscherichiacoliBL21(DE3).The Zh68antibody was acquired form the rabbit by immunization with recombinant Zh68protein.ES or ES treated by Zh68antibody were incubated with S774A.1macrophages.The number of S774A.1macrophages was calculated by CCK-8,and the apoptotic rate was determined by flow cytometry (FCM).The results showed that ES antigens ofTrichinella spiraliscan inhibit the proliferation of macrophages and promote the apoptosis of S774A.1macrophages.However,this effect was significantly decreased when ES antigens were treated by Zh68antibody.We demonsrtated that serine protease in ES antigens ofTrichinellaspiraliscan inhibit the proliferation of macrophages and promote apoptosis of macrophages.
adultTrichinallespiralis;excretory-secretory antigen;serine protease;macrophage;toxicit y
S852.33
A
1007-5038(2011)10-0005-05
2011-04-01
国家自然科学基金项目(31030064);国家杰出青年科学基金项目(30825033)
于建立(1985-),男,山东烟台人,硕士,主要从事兽医公共卫生工作。

