三黄鸡α干扰素的克隆、表达及抗病毒活性初步研究
李秋霞,刘永录,2,龚 剑,马仲彬 ,陈乃壮,杨明锋,张国祖,2*
(1.河南省康星药业有限公司,河南中牟451464;2.郑州牧业工程高等专科学校,河南郑州450011;3.辽宁省辽阳市种畜场,辽宁辽阳111000)
三黄鸡α干扰素的克隆、表达及抗病毒活性初步研究
李秋霞1,刘永录1,2,龚 剑1,马仲彬1,陈乃壮3,杨明锋1,张国祖1,2*
(1.河南省康星药业有限公司,河南中牟451464;2.郑州牧业工程高等专科学校,河南郑州450011;3.辽宁省辽阳市种畜场,辽宁辽阳111000)
采用PCR方法从三黄鸡血液基因组中扩增鸡α干扰素全基因,并克隆和测序。序列分析表明,基因全长为582bp,亚克隆其成熟蛋白编码基因489bp。将该片段与表达载体pET-28a连接克隆至大肠埃希菌DH5α菌株,经测序和酶切鉴定,选取正向插入、读码框正确的阳性克隆。构建重组质粒并转化BL21(DE3),经IPTG诱导,融合蛋白以包涵体形式在BL21(DE3)高效表达,经His亲和层析柱得以纯化。鸡胚试验表明,重组干扰素抵抗新城疫病毒效果显著,能保护鸡胚并能够延迟和减少新城疫病毒的复制。
鸡α干扰素;原核表达;抗病毒活性
*通讯作者
自Issaca等在1957年发现干扰素(interferon,IFN)以来,已经证明不论高等动物还是低等动物都有干扰素类似物质产生。干扰素是一种具有广谱抗病毒、抗肿瘤和增强免疫功能的细胞因子[1]。干扰素分为Ⅰ型和Ⅱ型两类。Ⅰ型干扰素包括IFN-α和IFN-β等,Ⅱ型干扰素又称免疫干扰素即IFN-γ[2]。α干扰素主要来源于B淋巴细胞和巨噬细胞,β干扰素主要来源于成纤维细胞和上皮细胞,两者主要活性是抗病毒。而γ干扰素是机体在发挥免疫作用后通过作用于巨噬细胞而发挥其抗病毒活性的,主要由 T 淋巴细胞产生[3-4]。
鸡α干扰素(chicken interferon-alpha,ChIFN-α)全基因为582个碱基,编码193个氨基酸,其中前31个氨基酸为信号肽,后162个氨基酸为成熟蛋白,蛋白分子质量约为19ku。Sekellick M J等[5]于1994年首次成功克隆和表达了ChIFN-α基因,并进行了结构分析。文献报道已成功克隆了惠阳胡须鸡[6]和丝羽乌骨鸡IFN-α基因[7]。陈红英等[8]用原核表达系统表达了鸡α干扰素,并证明表达产物在细胞上有抗病毒活性。
近年来,干扰素一直是病毒学、细胞学、分子生物学、临床医学、免疫学、肿瘤学等相关领域的研究热点。随着抗菌药物的大量使用,药物残留和抗药性问题急需解决。干扰素有着抗生素无法替代的作用,干扰素因其作用机理的独特性而具有广谱的抗病毒活性和免疫增强作用[9-10]。研究表明,重组干扰素与天然干扰素具有同样的抗病毒和免疫调节活性,因此重组干扰素的研究和应用将成为家禽养殖中增强鸡的免疫,减少发病,降低鸡的死亡率的重要方向[11-12]。本研究应用PCR方法从三黄鸡血液中克隆了IFN-α基因,并在大肠埃希菌中获得了高效表达,为重组干扰素作为新型广谱抗病毒生物制剂奠定了基础。
1 材料与方法
1.1 材 料
1.1.1 质粒和菌株 原核表达载体pET28a、大肠埃希菌(Escherichiacoli)DH5α和BL21由河南省康星药业有限公司研发部实验室保存。
1.1.2 鸡胚和病毒 9日龄鸡胚为郑州瑞祥孵化厂孵化;新城疫病毒由河南农业大学禽病研究所惠赠。
1.1.3 酶和试剂 限制性内切酶NcoⅠ、NheⅠ、SalⅠ为Fermentas公司产品;普通DNA产物回收试剂盒、质粒小提试剂盒、DNA凝胶回收试剂盒、普通DNA聚合酶、蛋白质Marker和Bradford蛋白定量测定试剂盒为上海生工生物工程技术服务有限公司产品;IPTG、尿素、丙烯酰胺、甲叉双丙烯酰胺为Genview公司(北京)产品;Tris碱为Sigma公司产品;His-Bind Resin为BBI公司产品;其他试剂均为国产分析纯。
1.2 方 法
1.2.1 引物设计 参照NCBI中已发表的鸡α干扰素基因序列(AB021154),利用Primer Premier 5.0软件设计2对引物。CKF1:5-CCATGGCTGTGCCTGCAAGCCCACAGC-3(NcoⅠ),CKR1:5-CTTGTCGACCTAAGTGCGCGTGTTGCCTGT-3(SalⅠ);CKF2:5-CTTGCTAGCTGCAACCACCTTCGCCCCCAG-3 (NheⅠ ),CKR2:5-CTTGTCGACCTAAGTGCGCGTGTTGCCTGT-3(SalⅠ)。用于扩增鸡IFN-α全基因(CKF1和CKR1)和去信号肽的成熟蛋白编码基因(CKF2和CKR2)。引物由上海生工生物工程技术服务有限公司合成。
1.2.2 鸡α干扰素全基因的PCR扩增、克隆与序列测定 参照《分子克隆试验指南》,从三黄鸡血液中提取基因组DNA。以提取的DNA为模板,采用引物CKF1和CKR1进行PCR扩增。反应程序为94℃预变性3min;94℃30s,55℃45s,72℃1min进行30个循环;最后72℃延伸10min。PCR产物经10g/L琼脂糖凝胶电泳,参照DNA凝胶回收试剂盒说明书回收582bp处DNA带,回收的PCR产物与pET-28a载体连接,转化E.coliDH5α感受态细胞。挑取数个菌落分别接种于3mL含Kan的LB液体培养基中,37℃过夜振荡培养。提取重组质粒进行酶切和测序鉴定。
1.2.3 原核表达载体pET28a-ChIFN-α的构建与鉴定 利用特异性引物CKF2和CKR2,以经过测序确定含正确ChIFN-α全长基因的质粒为模板,扩增鸡α干扰素成熟蛋白基因。反应程序如1.2.2,扩增后用10g/L琼脂糖电泳检测,回收特异的DNA条带。用NheⅠ和SalⅠ双酶切回收的PCR产物,电泳、分离和回收IFN-α片段。将IFN-α片段定向插入到同样处理的原核表达载体pET28a中,转化E.coliDH5α感受态细胞,选单个菌落进行PCR和双酶切鉴定,阳性质粒命名为pET28a-ChIFN-α,并送上海生工生物工程技术服务有限公司测序。
1.2.4 重组质粒的诱导表达及其表达产物的可溶性分析 将测序正确的pET28a-ChIFN-α转化E.coliBL21感受态细胞,挑取单菌落接种于10mL含Kan(50mg/mL)的LB培养基中,37℃振荡培养过夜,取培养过夜的菌液1mL转接到100mL新鲜的含Kan的LB培养基中,37℃振荡培养2h~3h,当OD600达0.4~0.6时,加入IPTG至终浓度为0.2 mmol/L,37℃,250r/min振荡培养4h,同时用未诱导的菌液作为阴性对照。取1mL诱导后菌液,离心,收集菌体,菌体用100μL PBS悬浮待用,剩余的菌液离心,离心后的菌体冰上放置30min后用20 mL PBS悬浮,然后利用超声破碎仪(360W,30%,5 min)超声5次,4℃、12 000r/min离心15min,分为上清液和沉淀,沉淀用200μL PBS溶解,制备电泳样品。
1.2.5 重组鸡IFN-α的纯化 将大量诱导离心后的菌体重悬于50mL PBS中,冰上放置30min,超声裂解破碎细胞(360W,30%,5min重复5次),4℃、12 000r/min离心15min,弃上清液,得包涵体沉淀。将沉淀分别用含2mol/L Urea、4mol/L U-rea的PBS洗涤,离心,去上清液。然后将包涵体溶解于40mL 结合缓冲液中(0.6mol/L NaCl,0.05 mol/L NaH2PO4,10mmol/L咪唑,8mol/L Urea,pH8.0)。包涵体溶解后,4 ℃、12 000r/min离心15min,取上清,与His-Bind(结合缓冲液预先平衡)树脂结合1.5h,用4体积含40mmol/L咪唑的漂洗、250mmol/L咪唑洗脱缓冲液(0.6mol/L NaCl,0.05mol/L NaH2PO4,8mol/L Urea,pH 8.0)漂洗、洗脱蛋白,收集漂洗液和洗脱液,120g/L SDSPAGE电泳检测。
1.2.6 重组蛋白的体外复性 将纯化后含目的条带的洗脱液装入透析袋中,按下列方法透析:基础复性液为PBS,尿素梯度为6、4、2、0mol/L,每个梯度透析12h,最后在水中透析24h,吸出透析袋中的液体,4℃、12 000r/min离心10min,取上清并用Bradford法测定目的蛋白浓度,然后将目的蛋白滤过除菌,置-20℃保存。
1.2.7 重组鸡IFN-α抗病毒活性测定 将新城疫病毒液在无菌条件下进行10倍倍比稀释,经尿囊腔接种9日龄鸡胚,200μL/枚,每个稀释度接种6枚,37℃孵育6d,测定EID50。根据测定的EID50,选择9日龄鸡胚36枚。随机分为6组,每组6只,将两种病毒稀释至100EID,每枚注入100μL病毒稀释液。接病毒同时,每组分别注入不同剂量的干扰素(空白对照组、0.5、1.5、4.5、13.5、40.5μg)。每天照蛋1次~2次,弃去24h内死亡的鸡胚。4d后将鸡胚取出,测定病毒效价。
2 结果
2.1 原核表达载体pET28a-ChIFN-α的构建与鉴定
以三黄鸡血液基因组DNA为模板,扩增出ChIFN-α全基因后,利用特异性引物CKF2和CKR2,以经过测序确定含正确ChIFN-α全长基因的质粒为模板,扩增鸡α干扰素成熟蛋白基因。扩增后用10g/L琼脂糖电泳检测,去信号肽的ChIFN-α基因PCR扩增产物为489bp(图1),片段大小与预期片段大小相等。PCR回收产物与pET28a载体连接后,转化DH5α,挑单菌落提取质粒后进行双酶切鉴定(图2)。将酶切鉴定均为阳性的重组质粒进行测序。测序结表明,目的基因已成功地克隆到pET28a载体上。
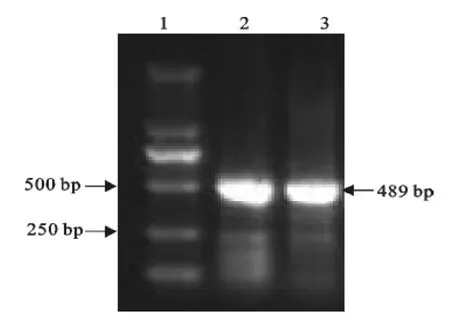
图1 ChIFN-α基因PCR扩增结果Fig.1 PCR amplification of ChIFN-αgene
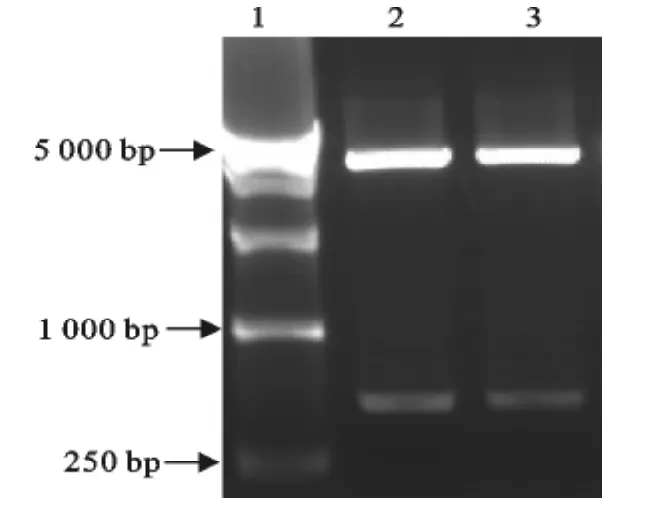
图2 重组质粒pET28a-ChIFN-α基因双酶切验证Fig.2 Identification of recombinant plasmid pET28a-ChIFN-α digested by NheⅠand SalⅠ
2.2 重组蛋白的诱导表达及表达产物的可溶性分析
SDS-PAGE 结 果 显 示,诱 导 后 的 pET28a-ChIFN-α在约22ku处有一条很浓的特异性条带,与预期大小一致,未经诱导的pET28a-ChIFN-α转化菌则无此条带。将诱导后重组菌株进行超声裂解后,分别取上清液和沉淀进行SDS-PAGE,重组蛋白以包涵体形式表达(图3)。
2.3 重组鸡IFN-α的纯化
重组菌超声后包涵体经His亲和层析柱纯化后获得到了纯化的重组鸡IFN-α(图4),纯化后的蛋白用透析法复性后,Bradford蛋白质定量试剂盒测定蛋白浓度为326μg/mL。
2.4 重组鸡IFN-α抗病毒活性
将9日龄鸡胚随机分为6组,每组注入100μL新城疫病毒稀释液。接病毒同时,每组分别注入不同剂量的干扰素(0、0.5、1.5、4.5、13.5、40.5μg)。每天照蛋1次~2次,弃去24h内死亡的鸡胚。4d后将鸡胚取出,测定病毒效价,每组取平均值(表1)。
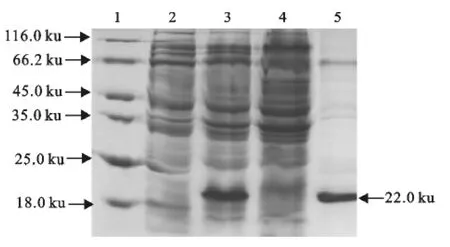
图3 pET28a-ChIFN-α蛋白的SDS-PAGE分析Fig.3 SDS-PAGE analysis of pET28a-ChIFN-αprotein
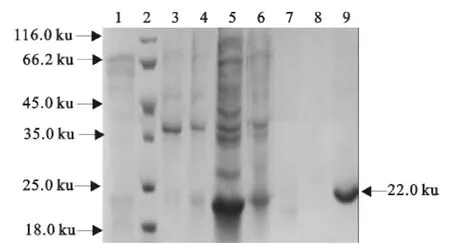
图4 表达纯化产物SDS-PAGE分析Fig.4 SDS-PAGE analysis of purified fusion protein

表1 重组干扰素亲和层析蛋白在鸡胚上对新城疫病毒的抑制效果Table 1 The protein purified by nickel affinity chromatography resistant to NDV on chick embrvo
3 讨论
目前,随着我国养鸡规模的不断扩大和集约化程度的不断提高,新城疫、禽流感、鸡传染性支气管炎等病毒性疾病所带来的危害越来越严重,给养鸡业造成重大的经济损失。干扰素作为一类重要的细胞因子,由生物体细胞受到病毒或其他诱生剂的作用而产生的分泌性蛋白,具有抗病毒、抗细胞增殖、免疫调节等多种生物学活性。自1986年以来,各型重组干扰素相继投放市场,在医学临床治疗过程中发挥了巨大作用,而且副作用较轻。与人医相比,禽类干扰素分子生物学研究相对滞后。本研究根据NCBI上的基因序列(序列号为AB021154),利用SignalP 3.0Server软件预测此基因可能含有一段信号肽序列,为其氨基酸序列的前31个氨基酸,利用TargetP 1.1Server软件检测此序列功能,发现其为帮助蛋白分泌的信号肽而非蛋白结构所必需,由于鸡α干扰素为真核生物干扰素,但后续研究需要在原核生物中进行表达,真核生物的信号肽在原核生物细胞环境中由于缺少相应的受体而不能发挥作用,所以我们去掉信号肽序列,剩下编码成熟鸡α干扰素的基因序列。本试验应用PCR技术从三黄鸡血液中克隆了鸡IFN-α基因,构建原核表达载体pET28a-ChIFN-α,鸡IFN-α获得了成功表达,为该基因的免疫学和生物学研究奠定了基础。
为了验证干扰素对新城疫病毒的抑制效果,本研究选用9日龄鸡胚作为试验对象。结果表明,干扰素用量在0μg~13.5μg之间时,随着干扰素用量的增加,病毒的凝集价降低,说明干扰素对新城疫病毒有一定的抑制效果。但是干扰素量增加至40.5 μg时,病毒的凝集价比13.5μg时稍高,可能是因为干扰素用量较大时有一定的副作用。
[1] Levy D E.Whence interferon variety in the production of interferon in response to viral infection[J].J Exper Med,2002,195:15-18.
[2] Constanze H,Axel K,Patricia K,et al.High-level expression of biologically active bovine alpha interferon by bovine herpesvirus 1interferes only marginally with recombinant virus replicationinvitro[J].J Gene Virol,2005,86:2685-2695.
[3] Mege D,Lefevre F,Labonnardiere C.The porcine family of interfeton-omega:cloning,structural,analysis,and functional studies of five related genes[J].J Interferon Res,1991,11(6):341.
[4] Overend C,Mitchell R,He D,et al.Recombinant swine beta interferon protects swine alveolar macrophages and MARC-145 cells from infection with porcine reproductive and respiratory syndrome virus[J].Gene Virol,2007,88,925-931.
[5] Sekellick M J,Ferrandino A F,Hopkins D A,et al.Chicken interferon gene:cloning,expression and analysis[J].J Interferon and Cytokine Res,1994,14(2):71-79.
[6] 汪 明,吴志光,夏 春.肉鸡IFN-alpha基因的克隆、序列分析以及在大肠杆菌中的表达[J].农业生物技术学报,2000,8(4):337-381.
[7] 夏 春,汪 明,杨 琪,等.丝羽乌骨鸡IFN基因克隆和序列分析[J].中国免疫学杂志,2000,16(9):508-513.
[8] 陈红英,宋凌云,崔保安,等.鸡α干扰素基因的克隆、原核表达及抗病毒活性的测定[J].华北农学报,2009,241(1):40-43.
[9] Richard E R,Stephen G.Interferons and virus:an interplay between induction,signalling,antiviral responses and virus countermeasures[J].J Gene Virol,2008,89:1-47.
[10] Jennifer Z,Takeshi K,Geoffrey H H,et al.Reovirusμ2protein inhibits interferon signaling through a novel mechanism involving nuclear accumulation of interferon regulatory factor 9[J].J Virol,2009,83(5):2178-2187.
[11] 周海龙,韦双双,谢 俊,等.家禽干扰素的研究进展[J].兽医研究,2007(7):16-18.
[12] 王黎霞,王彩霞,徐 赓,等.鸡干扰素γ的原核表达与生物活性[J].中国兽医杂志,2010,46(3):28-30.
Molecular Cloning,Expression and Antiviral Activity of Three-Yellow Chicken IFN-α
LI Qiu-xia1,LIU Yong-lu1,2,GONG Jian1,MA Zhong-bin1,CHEN Nai-zhuang3,YANG Ming-feng1,ZHANG Guo-zu1,2
(1.HenanProvinceHealthStarPharmaceuticalCO.,LTD,Zhongmou,Henan,451464,China;2.ZhengzhouCollegeofAnimalHusbandry Engineering,Zhengzhou,Henan,450011,China;3.LiaoyangCity,LiaoningProvinceBreedingStockMarket,Liaoyang,Liaoning,111000,China)
The full length of chicken interferon alpha gene was amplified by polymerase chain reaction from the genome DNA of Three-Yellow chicken blood,and then sequenced.The amplified gene was 582bp.The coding region(489bp)for mature protein was subcloned into the prokaryotic expression vector pET-28a.The recombinant vector was cloned intoEscherichiacoliDH5αstrain.The positive clone gene with correct reading frame was confirmed by sequencing and enzyme digestion.The results of SDS-PAGE revealed that the recombinant plasmid that was transformed into BL21(DE3)was highly expressed after induction by IPTG and the 22ku fusion protein was expressed in the form of inclusion bodies.The recombinant protein was purified with His-Bind affinity chromatography.Chick embryo tests showed that recombinant chicken interferon alpha can protect chick embryo from NDV infection.Recombinant chicken interferon alpha can also delay and reduce the NDV replication significantly.
chicken interferon alpha;prokaryotic expression;antiviral activity
Q789
A
1007-5038(2011)10-0063-04
2011-04-20
企业基金项目资助
李秋霞(1981-),女,山东聊城人,实验员,硕士研究生,主要从事生物制药研究。

