氯沙坦和氟伐他汀对残肾大鼠氧化型低密度脂蛋白受体1表达的影响
余 毅,邱 鸿,王 琰,周丽娜
(南京军区福州总医院血液净化科,福建福州 350025)
血凝素样氧化低密度脂蛋白受体1(LOX-1)是近年来发现的一种脂蛋白受体,常在内皮细胞上表达[1-2],LOX-1 与动脉粥样硬化有着密切的关系,而肾小球硬化与动脉粥样硬化在病理和生化特征上十分相似[3]。残肾大鼠和盐负荷高血压大鼠的肾脏可检测到LOX-1表达增强,且LOX-1表达的量与尿蛋白显著相关[2-3]。我们的研究表明[4],盐负荷高血压大鼠主动脉氧化应激-LOX-1通路活性增强,坎地沙坦具有明显抑制作用。沙坦类和他汀类药物除降脂和降压外,均有抗炎和保护肾脏的作用,它们能降低慢性肾脏病(CKD)尿蛋白,减轻肾小球硬化,延缓 CKD 的进展[5-6],两类药物联用比单独应用作用更强[7]。他汀类药物可明显减少粥样硬化的主动脉和肾动脉内膜LOX-1的表达[8],然而,他汀类、沙坦类药物单用及联用对残肾大鼠LOX-1表达的影响鲜有报道。本实验旨在观察氯沙坦(losartan)和氟伐他汀(fluvastatin)对大鼠残肾模型肾脏和血管LOX-1表达的影响,探讨LOX-1在CKD中的作用及他汀类和沙坦类药物延缓CKD进展的可能机制。
1 材料与方法
1.1动物分组及建立大鼠残肾模型8周龄♂SD大鼠,购自上海斯莱克实验动物有限责任公司,分笼饲养于我院动物实验科清洁级动物房。35只大鼠随机选取28只制作大鼠残肾模型,7只为假手术组,作为正常对照。残肾大鼠随机分为4组:残肾模型组、氟伐他汀组、氯沙坦组及联合用药组。采用1%戊巴比妥腹腔注射麻醉(50 mg·kg-1)大鼠,切开左侧腹,暴露左侧肾脏,分离肾动脉及其分支,结扎其中的左上支和中支并剪断,使左肾梗死约2/3,7 d后再将大鼠右肾摘除。假手术组则只分离肾动脉及其分支,不予结扎。
1.2药物干预大鼠残肾模型建立后,氯沙坦组以氯沙坦30 mg·kg-1·d-1灌胃,氟伐他汀组以氟伐他汀 15 mg·kg-1·d-1灌胃,联合用药组以上述剂量的氟伐他汀和氯沙坦联合灌胃。假手术组和残肾模型组均以等量溶剂灌胃。
1.3器材及试剂PE 2400 PCR仪(美国ABI公司);氯沙坦(杭州默沙东制药有限公司);氟伐他汀(北京诺华制药有限公司);RNA保存液(德国QIGEN公司);山羊抗大鼠LOX-1抗体(美国Santa Cruz公司);SP免疫组织化学试剂盒(北京中山公司);TRIzol试剂(Gibco公司);Promega逆转录试剂盒(美国Promega公司);PCR试剂盒(日本TaKaRa公司);大鼠LOX-1、MCP-1和β-actin引物(美国Invitrogen公司)。
1.4样品采集灌胃8周后,大鼠置于代谢笼,收集24 h尿量检测尿蛋白定量。次日大鼠主动脉取血检测血清尿素氮、肌酐、胆固醇和甘油三酯。取残余肾脏置于RNA保存液中,行RT-PCR检测。留取部分肾脏和胸主动脉置于福尔马林液固定,石蜡包埋后切片,行PAS染色和LOX-1免疫组化。
1.5免疫组化石蜡包埋后切片,行LOX-1免疫组化检查。切片脱蜡至水,高压(主动脉)或0.125%胰酶修复(肾组织),3%双氧水阻断内源性过氧化物酶,分别滴加一抗LOX-1(1∶200),阴性对照以PBS代替一抗,37℃孵育。滴加生物素标记兔抗山羊IgG二抗工作液室温孵育,滴加辣根酶标记链霉卵白素工作液室温孵育,滴加新鲜配制的DAB显色液,中止反应。
1.6 RT-PCR检测肾脏LOX-1和MCP-1的表达LOX-1、MCP-1 引物序列参考相关文献[2,9],内参 βactin引物自行设计,各引物序列见Tab 1。扩增产物琼脂糖凝胶电泳,检测各扩增带的灰度值,以β-actin校正作相对定量分析,结果以两者的灰度比值表示。
1.7 统计学处理所有数据都以±s表示,用SPSS13.0统计软件分析,多个样本均数的比较采用单因素方差分析,组间两两比较采用SNK检验。
2 结果
2.1生化指标与假手术组比较,残肾模型组大鼠的尿素氮、肌酐、胆固醇、LDL和24 h尿蛋白均明显升高(P<0.01)。与残肾模型组相比,氯沙坦组、氟伐他汀组及联合用药组的肌酐、胆固醇、LDL及24 h尿蛋白明显下降(P<0.05)。但氯沙坦组、氟伐他汀组和联合用药组间各项指标比较差异无统计学意义(P>0.05),见 Tab 2。

Tab 1 Primers of LOX-1,MCP-1 and β-actin
2.2病理及免疫组化肾脏病理显示残肾模型组肾间质炎症细胞浸润明显,肾小球系膜增生,局灶节段硬化,肾小管片状萎缩。氟伐他汀组及氯沙坦组肾脏病变较残肾模型组轻,而联合用药组比单独用药二组轻。大鼠肾脏LOX-1免疫组织化学显示:与假手术组相比,残肾模型组肾间质血管周围和肾小管周围LOX-1表达增多,而氯沙坦组、氟伐他汀组和联合用药组表达减少(Fig 1)。主动脉LOX-1免疫组织化学显示:与假手术组相比,残肾模型大鼠LOX-1在血管壁和血管内膜上表达明显增多,氯沙坦组、氟伐他汀组和联合用药组LOX-1表达明显减少(Fig 2)。
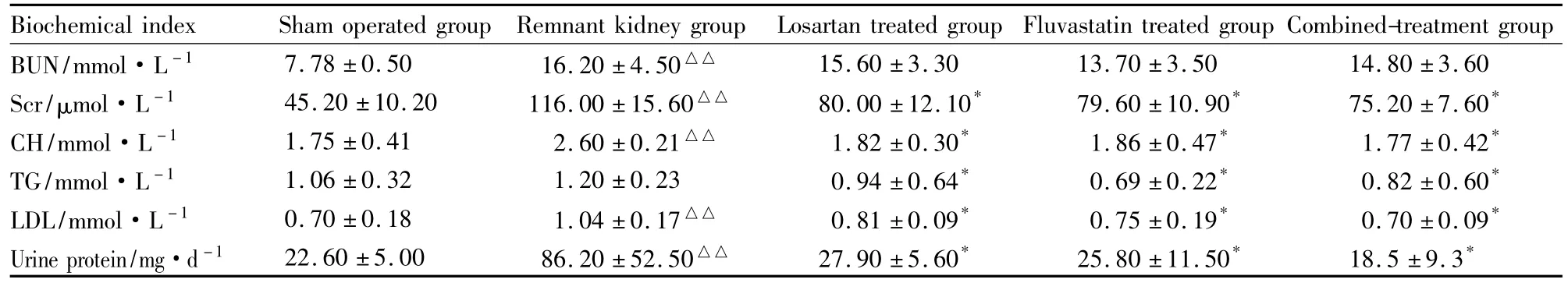
Tab 2 Biochemical results in each group

Fig 1 Kidney LOX-1 expression in each group(SP ×200)A:Negative control;B:Sham operated group;C,D:Remnant kidney group;E:Losartan treated group;F:Fluvastatin treated group;G:Combined-treatment group
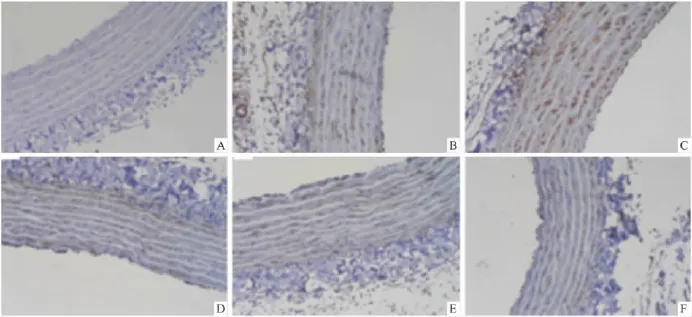
Fig 2 Aorta LOX-1 expression in each group(SP×200)

Tab 3 LOX-1,MCP-1/β-actin mRNA ratio in kidney
2.3RT-PCR与假手术组比较,残肾模型组LOX-1、MCP-1 mRNA 表达明显增强(P<0.01),氯沙坦组、氟伐他汀组和联合用药组表达较残肾模型组明显减少(P<0.05)。见 Tab 3,Fig 3,4。
3 讨论
LOX-1是1997年日本学者首先发现的血凝素样低密度脂蛋白受体[1],LOX-1常表达于血管内皮细胞、巨噬细胞、平滑肌细胞、血小板及肾小球系膜细胞等,病理情况下,如高血压、高血脂和动脉粥样硬化能使LOX-1表达上调,各种炎症因子、血管紧张素Ⅱ都能诱导LOX-1的表达,LOX-1调节Ox-LDL多种毒性作用,诱导各种炎症因子的表达,促进内皮功能的紊乱[2,10]。LOX-1与动脉粥样硬化具有十分密切的联系:①LOX-1作为Ox-LDL的主要受体,介导Ox-LDL病理作用[11]。② 在动脉粥样硬化发展过程中扮演重要角色的巨噬细胞、平滑肌细胞和内皮细胞中均检测到LOX-1的表达[1,12]。③ 实验动物和人类动脉粥样硬化病变过程中可检测到LOX-1表达增多[13]。④ LOX-1作为细胞黏附因子介导血小板和内皮细胞的结合,并诱导炎症,促进了动脉粥样硬化的形成和发展[11]。⑤ 抗动脉粥样硬化药物如他汀类能抑制Ox-LDL介导的LOX-1表达[14]。

Fig 3 LOX-1 mRNA expression in kidney

Fig 4 MCP-1 mRNA expression in kidney
LOX-1与动脉粥样硬化关系密切,而肾小球硬化与动脉粥样硬化在病理和生化特征上十分相似,脂代谢紊乱、单核巨噬细胞浸润及病理状态下各种黏附分子和细胞因子的过量表达,均可诱导肾小球硬化和动脉粥样硬化相应组织细胞中LOX-1的高表达[4]。大鼠残肾模型类似于人类CKD中局灶节段肾小球硬化、慢性肾功能不全,本实验中,残肾大鼠肾脏LOX-1、MCP-1表达较对照组明显增加,尿蛋白量增多并伴肾功能损害。免疫组化显示肾脏和主动脉LOX-1表达增加,分析原因可能如下:① 残肾大鼠循环和肾脏血管紧张素Ⅱ水平升高,直接刺激血管和肾脏表达 LOX-1[15]。② 血脂升高,Ox-LDL增多刺激LOX-1表达增加。③炎症因子如MCP-1分泌增多,MCP-1诱导单核细胞黏附,促进肾组织损伤和肾间质纤维化[9]。LOX-1主要在肾间质血管和小管周围表达,肾小球和肾小管无明显表达,而盐负荷伴肾脏损害的高血压大鼠不仅肾小管间质表达LOX-1,肾小球也表达 LOX-1[2],这可能与其系统血压要明显高于大鼠残肾模型有关[3]。
氟伐他汀组与残肾模型组相比,LOX-1和MCP-1表达下调,尿蛋白减少,肌酐、胆固醇和LDL明显下降,表明氟伐他汀有降尿蛋白、降脂、抑制炎症和延缓肾功能不全进展的作用[16],考虑到LOX-1的表达与血脂水平、炎症浸润等有密切联系[2],氟伐他汀的抗炎和降脂作用可能与LOX-1表达减少有关。血管紧张素Ⅱ通过AT1受体介导多种病理活性,如促进血压升高及动脉粥样硬化形成和发展,诱导系膜增殖,导致基质生成增多和肾脏纤维化[17]。本实验氯沙坦组血清肌酐、胆固醇、LDL和24h尿蛋白水平与残肾模型组相比明显下降并伴MCP-1和LOX-1表达下调,病理显示肾脏病变明显减轻。氯沙坦下调LOX-1的表达可能与其降压、降脂、抗炎和拮抗血管紧张素Ⅱ等作用相关。他汀类药物还能加强沙坦类药物对心血管的保护作用[6,18],本实验中,无论是单用一种药物,还是联用两种药物,肾脏和主动脉LOX-1表达均明显下调,推测两药联用对血管和肾脏保护作用可能具有协同作用。
综上所述,残肾大鼠模型肾脏和主动脉LOX-1表达增强,伴有炎症因子表达增多,LDL增高,尿蛋白增加和肾功能损害。氯沙坦和氟伐他汀能明显下调LOX-1和MCP-1的表达,延缓肾功能损害的进展。提示LOX-1可能在CKD肾损害中发挥重要作用,沙坦类和他汀类药物抑制LOX-1的表达,可能是其肾保护作用的部分机制,这为应用沙坦类和他汀类药物治疗CKD提供了新的靶点。
[1]Sawamura T,Kume N,Aoyama T,et al.An endothelial receptor for oxidized low-density lipoprotein[J].Nature,1997,386(6620):73-7.
[2]Nagase M,Kaname S,Nagase T,et al.Expression of LOX-1,an oxidized low-density lipoprotein receptor,in experimental hypertensive glomerulosclerosis[J].J Am Soc Nephrol,2000,11(10):1826-36.
[3]Ueno T,Kaname S,Takaichi K,et al.LOX-1,an oxidized low -density lipoprotein receptor,was upregulated in the kidneys of chronic renal failure rats[J].Hypertens Res,2003,26(1):117 -22.
[4]余 毅,吴可贵,万建新,等.坎地沙坦对盐负荷高血压大鼠主动脉氧化应激-低密度脂蛋白受体-1通路的抑制[J].中国药理学通报,2008,24(3):403 -7.
[4]Yu Y,Wu K G,Wan J X,et al.Effects of candesartan on aorta oxidative stress-LOX-1 pathway in salt-loaded stroke-prone spontaneously hypertensive rats[J].Chin Pharmacol Bull,2008,24(3):403-7.
[5]Rodriguez-Iturbe B,Sato T,Quiroz Y,Vaziri N D.AT1 receptor blockade prevents proteinuria,renal failure,hyperlipidemia,and glomerulosclerosis in the Imai rat[J].Kidney Int,2004,66(2):668-75.
[6]Agarwal R.Effects of statins on renal function[J].Am J Cardiol,2006,97(5):748 -55.
[7]Kato M,Sada T,Mizuno M,et al.Effect of combined treatment with an angiotensinⅡreceptor antagonist and an HMG-CoA reductase inhibitor on atherosclerosis in genetically hyperlipidemic rabbits[J].J Cardiovasc Pharmacol,2005,46(4):556 - 62.
[8]Yu Y H,Wang Y,Dong B,et al.Fluvastatin prevents renal injury and expression of lactin-like oxidized low-density lipoprotein receptor-1 in rabbits with hypercholesterolemia[J].Chin Med J(Engl),2005,118(8):621 -6.
[9]Taal M W,Zandi-Nejad K,Weening B,et al.Proinflammatory gene expression and macrophage recruitment in the rat remnant kidney[J].Kidney Int,2000,58(4):1664 -76.
[10]Chen X P,Du G H.Lectin-like oxidized low-density lipoprotein receptor-1:protein,ligands,expression and pathophysiological significance[J].Chin Med J(Engl),2007,120(5):421 -6.
[11]Kita T,Kume N,Minami M,et al.Role of oxidized LDL in atherosclerosis[J].Ann N Y Acad Sci,2001,947:199 -205.
[12]Shi X,Niimi S,Ohtani T,Machida S.Characterization of residues and sequences of the carbohydrate recognition domain required for cell surface localization and ligand binding of human lectin-like oxidized LDL receptor[J].J Cell Sci,2001,114(Pt 7):1273-82.
[13]Kataoka H,Kume N,Miyamoto S,et al.Expression of lectin like oxidized low-density lipoprotein receptor-1 in human atherosclerotic lesions[J].Circulation,1999,99(24):3110 -7.
[14]Mehta J L,Li D Y,Chen H J,et al.Inhibition of LOX-1 by statins may relate to upregulation of eNOS[J].Biochem Biophys Res Commun,2001,289(4):857 -61.
[15]Hu C,Kang B Y,Megyesi J,et al.Deletion of LOX-1 attenuates renal injury following angiotensin II infusion[J].Kidney Int,2009,76(5):521 -7.
[16]Campese V M,Nadim M K,Epstein M.Are 3-hydroxy-3-methylglutaryl-CoA reductase inhibitors renoprotective[J]?J Am Soc Nephrol,2005,16:S11 -7.
[17]Berl T.Angiotensin-converting enzyme inhibitors versus AT1 receptor antagonist in cardiovascular and renal protection:the case for AT1 receptor antagonist[J].J Am Soc Nephrol,2004,15:S71-6.
[18]Li Z,Iwai M,Wu L,et al.Fluvastatin enhances the inhibitory effects of a selective AT1 receptor blocker,valsartan,on atherosclerosis[J].Hypertension,2004,44(5):758 -63.

