盐酸千金藤碱逆转肝癌多药耐药性与P-gp ATP酶活性的关系研究
臧彩红,张 艳,江金花,王 宁,韩 立,马 方,王庆端
(1.河南省医药科学研究院,2.郑州大学基础医学院,3.河南省肝病药理重点实验室,河南 郑州 450052)
肝细胞癌(hepatocellular carcinoma,HCC)是一种高发性肿瘤,其发病率在全世界位列第五,而在肿瘤导致的死亡中位列第三[1]。在北美和西欧一些国家中,每100 000人中大约有10人会因为患有肝癌而导致死亡,而在亚洲和非洲一些国家中,每100 000人中会有50~150因此而死亡[2]。尽管在过去的50年中,对肝癌的治疗大有改进,但肝癌细胞容易对一些化疗药物产生多药耐药(multidrug resistance,MDR)而导致治疗效果一直不佳[3]。MDR是指肿瘤细胞对一种抗肿瘤药物产生耐药性的同时对其他结构和作用机制不同的抗肿瘤药物也产生交叉耐药性[4-5]。其中产生多药耐药的一个很重要原因是P糖蛋白(P-glycoprotein,P-gp)的过度表达。P-gp是膜转运系统超家族成员之一,定位于细胞膜。Kimura等[6]发现在真核生物中 ABC转运子(ATP-binding cassette transporter)具有运输调节通道功能,而P-gp是ABC转运子超家族中最主要的成员,P-gp主要通过ATP的水解而实现其运输功能。近年来,也有学者通过影响ATP来研究活性氧对 P-gp 的调节作用[7-8]。
为克服MDR需寻找有效的逆转剂,目前研究证实多数逆转剂如维拉帕米和环孢素A应用于体内会产生很大的毒性而限制其临床应用。盐酸千金藤碱(cepharanthine hydrochloride,CH)是从防已科千金藤属植物的块茎中提取分离出来的一种双苄基异喹啉类生物碱千金藤碱[9]与盐酸成盐而得。近年来,国外文献表明其具有逆转多柔比星等一些抗肿瘤药物产生的耐药性[10],也有文献报道在体外通过影响P-gp ATP酶活性逆转肿瘤多药耐药性[11],但对于逆转肝癌多药耐药的体内研究,尤其通过影响P-gp ATP酶活性的体内研究比较少见。在临床上,有观察发现,肝癌患者更易对多柔比星(adriamycin,ADR)、顺铂(cis-dichlorodiamineplatinum,CDDP)、5-氟尿嘧啶(5-flurouracil,5-FU)产生耐药,本课题在模拟临床FAP(ADR+CDDP+5-FU)方案,由本实验室成功建立BALB/c小鼠肝癌多药耐药的模型基础上,研究CH联合FAP对P-gp ATP酶活性的影响,从而进一步探讨CH联合FAP对肝癌多药耐药的逆转作用及其机制。
1 材料与方法
1.1 材料
1.1.1细胞株与动物H22肝癌细胞株由本实验室保存,H22/FAP肝癌多药耐药细胞株由本实验室模拟临床FAP方案,采用药物ADR、CDDP、5-FU浓度梯度递增诱导法诱导而成[12]。
清洁级BALB/c小鼠,♀,6~8周龄,体质量(20±2)g,购自河南省动物中心(许可证号:SCXK(豫)2005-0001),IVC独立供风系统内常规饲养和实验。
1.1.2药品与试剂盐酸千金藤碱注射液,批号20081104,规格5 g·L-1,由河南省医药科学研究院提供;盐酸多柔比星注射液,规格10 mg/支,批号091201,购自浙江海正药业股份有限公司;顺铂注射液,规格10 ml∶10 mg,批号091205,购自云南生物谷灯盏花药业有限公司;氟尿嘧啶注射液,规格10 ml∶0.25 g,批号091201,购自上海旭东海普药业有限公司;维拉帕米注射液,规格2 ml∶5 mg,批号090901,购自上海禾丰制药有限公司;依他酸,批号058K5426,规格10 g;毒毛花苷,批号029K1076,规格 250 mg;MgATP,批号 048K5154,规格 100 mg,均购自美国Sigma公司;二硫苏糖醇,批号233155,规格1 g,购自北京索莱宝科技有限公司;其他试剂均为市售分析纯级。
1.2 方法
1.2.1MTT法检测CH、VER对H22/FAP的最大无毒剂量抽取小鼠H22/FAP腹水瘤细胞,PBS洗2次,采用Ficoll-Hypaque不连续密度梯度法,2 000 r·min-1,20 min 水平离心后收集 Ficoll-Hypaque 液和细胞悬液间的肿瘤细胞。PBS洗1次,0.4%台盼蓝染色,计活细胞率(蓝染率<10%)及细胞数,以含10%FBS的RPMI 1640培养液稀释成1×108cells·L-1,加入 96 孔培养板,每孔 100 μl,待细胞贴壁后依实验要求加入不同浓度测试药物CH和VER,37℃,5%CO2培养箱中培养 48 h后,加入MTT和DMSO,490 nm和630 nm双波长下测定吸光度(A),并计算CH、VER对H22/FAP细胞的最大无毒剂量(抑制率<10%)。
1.2.2耐药倍数的测定和计算用MTT法测定肝癌H22/FAP细胞对ADR、CDDP、5-FU的耐药倍数。分别抽取H22肝癌敏感小鼠和H22/FAP肝癌多药耐药小鼠的腹水瘤细胞,按方法“1.2.1”处理制得H22和H22/FAP肿瘤细胞并培养细胞,然后依实验要求加入不同浓度测试药物 ADR、CDDP、5-FU,另设不加药的空白对照组,37℃,5%CO2培养箱中培养48 h后,加入MTT和DMSO,490 nm和630 nm双波长下测定吸光度(A),并计算耐药倍数(resistance index,RI)。

求出IC;RI=A/B,A为化疗药物对H22/FAP瘤细胞的IC50值;B为化疗药物对H22瘤细胞的IC50值。
1.2.3生命延长率的评价方法♀ BALB/c小鼠腹腔接种H22/FAP细胞(每只0.2 ml,1×108cells·L-1),随机分成8组,每组10只:①生理盐水(NS)组;②FAP+CH 20 mg·kg-1组;③FAP+CH 10 mg·kg-1组;④FAP+CH 5 mg·kg-1组;⑤FAP+VER 2.5 mg·kg-1组;⑥FAP+VER 1.25 mg·kg-1;⑦FAP+VER 0.75 mg·kg-1;⑧FAP 组;FAP给药剂量按参考文献给药:0.5 LD50即5-FU 42.50 mg·kg-1,d1;ADR 2.10 mg·kg-1,d1;CDDP 1.40 mg·kg-1,d1 ~5;NS、CH、VER d1 ~7;均尾静脉注射给药。观察小鼠生存时间,并计算生命延长率。
1.2.4质膜的制备♀ BALB/c小鼠腹腔接种H22/FAP 细胞(每只0.2 ml,1 ×108cells·L-1),随机分成9组,每组10只:①空白(NS)组;②FAP+CH 20 mg·kg-1组;③FAP+CH 10 mg·kg-1组;④FAP+CH 5 mg·kg-1组;⑤FAP+CH 2.5 mg·kg-1组;⑥FAP+VER 2.5 mg·kg-1;⑦FAP+VER 1.25 mg·kg-1;⑧FAP+VER 0.75 mg·kg-1;⑨FAP+VER 0.37 mg·kg-1;尾静脉注射给药,FAP给药方案同“1.2.3”,7 d后抽取腹水瘤,按照MTT法中的步骤制取肿瘤细胞,加入 6 ml裂解液(mmol·L-1):Tris-HCl 10,pH 7.8,KCl 10,MgCl22,二硫苏糖醇1,依他酸1),在4℃下孵育20 min后,4 000×g下离心10 min,收集上清,100 000×g下离心1 h,取沉淀,加入含0.25 mol·L-1蔗糖的裂解液,备用。1.2.5P-gp ATP酶活性的测定每只实验小鼠取20 μg 质膜,加入以下试剂(mmol·L-1):Tris-HCl 50(pH 6.8),二硫苏糖醇2,MgCl25,毒毛花苷2(清除Na+,K+-ATP酶活性),依他酸2(清除Ca2+-ATP酶活性),叠氮化钠5(清除线粒体ATP酶活性),然后加入 MgATP反应开始。加入1 ml定磷试剂,37℃下反应30 min,以725分光光度计测定720 nm下吸光度(A)值。
1.2.6统计学处理实验结果取3次实验的均值,标准差均小于5%,组间显著性检验用t检验。
2 结果
2.1CH、VER对H22/FAP细胞的最大无毒剂量MTT法检测结果表明,CH和VER剂量为1.0、0.15 g·L-1时,对H22/FAP肝癌多药耐药细胞的抑制率<10%;每只小鼠按0.02 ml·g-1剂量给药,则每只小鼠的最大给药量分别为20、3 mg·kg-1,此检测结果为“1.2.3”和“1.2.4”给药方案提供依据,确保CH与VER逆转耐药的作用,不是由细胞毒性所致。与参考文献[13]结果基本一致。
2.2H22/FAP细胞对受试药物的耐药倍数如Tab 1所示,H22/FAP细胞对 ADR、CDDP、5-FU 的耐药倍数分别为27.75、10.20、11.20;实验结果表明H22/FAP对诱导耐药的3种药物产生了较强耐药性。
Tab 1 Drug sensitivity of H22/FAP tumor cells as determined by MTT(±s,n=3)
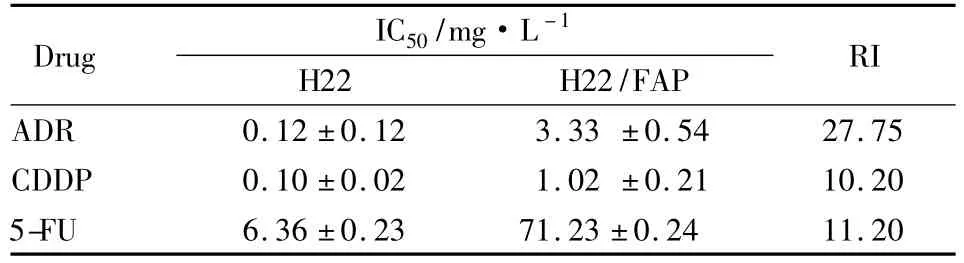
Tab 1 Drug sensitivity of H22/FAP tumor cells as determined by MTT(±s,n=3)
Drug IC50/mg·L-1 H22 H22/FAP RI ADR 0.12 ±0.12 3.33 ±0.54 27.75 CDDP 0.10 ±0.02 1.02 ±0.21 10.20 5-FU 6.36 ±0.23 71.23 ±0.24 11.20
2.3生命延长率的评价结果CH 10 mg·kg-1、CH 5 mg·kg-1、VER 1.25 mg·kg-1组均可明显延长H22/FAP MDR小鼠的生存时间,生存天数分别为(29.46 ± 2.33)、(31.08±2.42)、(29.21±1.47),与单纯用化疗药的FAP组(20.89±1.21)对比,对小鼠的生命延长率分别为41.0%、48.8%、39.8%,差异有统计学意义(P<0.05);CH 10 mg·kg-1组,CH 5 mg·kg-1组与阳性对照药 VER 1.25 mg·kg-1组对比差异无统计学意义(P>0.05);CH 20 mg·kg-1组(22.23 ± 1.56),VER 2.5 mg·kg-1组(19.30 ± 2.01),VER 0.75 mg·kg-1(22.20±1.20)组与FAP组对比差异无统计学意义(P>0.05)。FAP组与NS组对比差异无统计学意义,进一步证实FAP组已产生了耐药性。见Fig 1。
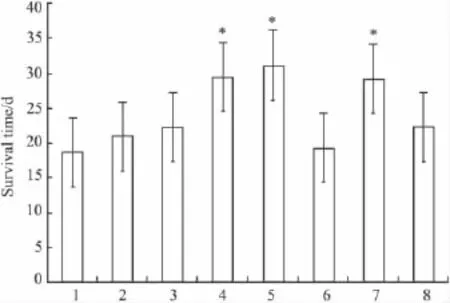
Fig 1 Effect of CH and VER in combination with FAP on the survival time of BALA/c mice
2.4CH,VER对P-gp ATPase活性的影响VER能浓度依赖性地提高ATP酶活性,与常见文献报道类同;CH能浓度依赖性地提高ATP酶活性。见Fig 2、3。

Fig 2 Effect of CH on upregulating ATPase activity
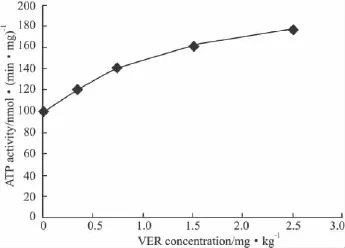
Fig 3 Effect of VER on upregulating ATPase activity
2.5 Cornish-Bowden图把CH和VER的浓度标在横坐标的负半轴,所测得的酶活性标在纵坐标上,绘制 Cornish-Bowden图。CH对 ATP酶的Km为1.11 mg·kg-1,Vmax为 184 nmol·(min·mg)-1;VER 对 ATP 酶的Km为 0.34 mg·kg-1,Vmax为 190 nmol·(min·mg)-1,两者的Vmax接近。见 Fig 4、5。

Fig 4 Cornish-Bowden plot:Effect of CH on ATPase activity
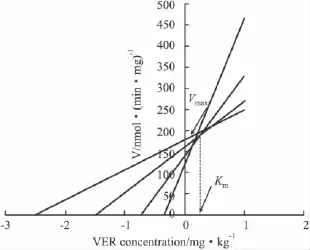
Fig 5 Cornish-Bowden plot:Effect of VER on ATPase activity
3 讨论
P-gp在肿瘤多药耐药中起着关键作用,研究P-gp逆转剂的作用机制可为克服P-gp介导的肿瘤多药耐药提供有价值的信息和思路。本研究在模拟临床FAP方案,由本实验室建立BALB/c小鼠多药耐药模型的基础上,进一步探讨CH联合FAP逆转肝癌多药耐药的作用及其机制研究。本课题观察了CH和VER联合FAP对小鼠生存时间的影响,结果证实CH联合FAP能延长小鼠的生存时间,能够部分逆转肝癌细胞的多药耐药性。
细胞质膜上的ATP酶包括 Na+,K+-ATP酶、Ca+-ATP酶、线粒体ATP酶和P-gp ATP酶,在二硫苏糖醇、依他酸、毒毛花苷存在下,含P-gp的质膜中所剩下的ATP主要为P-gp ATP酶。酶动力学分析显示,VER能够提高P-gp ATP酶活性,与文献报道一致;CH能浓度依赖性的提高ATP酶的活性,抑制P-gp的外排功能,从而逆转肝癌多药耐药性。通过Cornish-Bowden作图,可以看到,CH逆转效果与文献报道的阳性对照药维拉帕米差异无显著性。其逆转多药耐药的机制之一可能为能够提高P-gp ATP酶的活性,抑制P-gp的外排。另外,有文献报道[14]通过检测细胞内罗丹明123的蓄积和外排,证实汉防己碱逆转耐药的机制之一为抑制P-gp的外排,而CH与汉防己碱结构类似,同属双苄基异喹啉类药物,进一步推测CH逆转H22/FAP肝癌多药耐药的机制之一可能为影响P-gp的外排功能。
CH是一个具有开发前景和研究价值的多药耐药逆转剂,我们的研究表明,肿瘤化疗中联合使用CH对于纠正化疗中出现的多药耐药现象是一种新的战略方策,以此来增加肿瘤患者对产生耐药的化疗药物的敏感性,对临床肿瘤治疗具有重要的理论和实践意义,有可能成为克服肝癌化疗多药耐药的一个新的解决途径。
[1]But D Y,Lai C L,Yuen M F.Natural history of hepatitis-related hepatocellular carcinoma[J].World J Gastroenterol,2008,14(11):1652-6.
[2]El-Serag H B,Davila J A,Petersen N J,McGlynn K A.The continuing increase in the incidence of hepatocellular carcinoma in the United States:an update[J].Ann Intern Med,2003,139(10):817-23.
[3]Shields A,Reddy K R.Hepatocellular carcinoma:current treatment strategies[J].Curr Treat Options Gastroenterol,2005,8(6):457-66.
[4]Ambudkar S V,Dey S,Hrycyna C A,et al.Biochemical,cellular,and pharmacological aspects of the multidrug transporter[J].AnnuRev Pharmacol Toxicol,1999,39:361 -98.
[5]Gottesman M M,Fojo T,Batas S E.Multidrug resistance in cancer:role of ATP-dependent transporters[J].Nat Rev Cancer,2002,2(1):48-58.
[6]Kimura Y,Matsuo M,Takahashi K,et al.ATP hydrolysis-dependent multidrug efflux transporter:MDR1/P-glycoprotein[J].Curr Drug Metab,2004,5(1):1 -10.
[7]董宪喆,毕明刚.活性氧对P-糖蛋白调节作用的研究进展[J].中国药理学通报,2010,26(10):1386 -90.
[7]Dong X Z,Bi M G.Research progress on regulation of P-glycoprotein by reactive oxygen species[J].Chin Pharmacol Bull,2010,26(10):1386-90.
[8]李向上,林 阳,胡藴慧,等.PHⅡ-7逆转肿瘤细胞K562/A02耐药机制的研究[J].中国药理学通报,2010,26(6):750 -3.
[8]Li X S,Lin Y,Hu Y H,et al.Research of antitumor effect of PHⅡ-7 to K562/A02 cells[J].Chin Pharmacol Bull,2010,26(6):750-3.
[9]Tomita M,Fujitani K,Aoyagi Y.Synthesis of dl-cepharanthine[J].Tetrahedron Lett,1967,13:1201 -6.
[10]Kato T,Suzumura Y.Potentiation of antitumor acitivity of vincristine by biscoclaurine alkaloid cepharanthine[J].Natl Cancer Inst,1987,79(3):527 -32.
[11]姬汴生,何 玲.氨氯地平衍生物CJX1对人耐药肿瘤细胞P-gp ATP酶活性的影响[J].中国药理学通报,2008,24(12):1603-6.
[11]Ji B S,He L.Effects of CJX1,an amlodipine derivative,on ATPase activity of human P-glycoprotein in resistant tumor cells[J].Chin Pharmacol Bull,2008,24(12):1603 -6.
[12]王 欣,张 艳,王 宁,等.小鼠腹水型肝癌多药耐药模型的建立[J].郑州大学学报(医学版),2010,45(6):920 -3.
[12]Wang X,Zhang Y,Wang N,et al.Establishment of Hca multidrug resistance mouse model[J].J Zhengzhou Univ(Med Sci),2010,45(6):920-3.
[13]Asaumi J,Nishikawa K,Matsuoka H,et al.Direct antitumor effect of cepharanthin and combined effect with adriamycin against Ehrlich ascites tumor in mice[J].Anticancer Res,1995,15(1):67-70.
[14]王天晓,杨晓红.功劳木中异汉防己碱对P-糖蛋白介导的人乳腺癌细胞多药耐药性的逆转作用[J].药学学报,2008,43(5):461-6.
[14]Wang T X,Yang X H.Reversal effect of isotetrandrine,all isoquinoline alkaloid extracted from Caulis Mahoniae,on P-glycopmteinmediated Doxombicin-resistance in human breast cancer(MCF-7/DOX)cells[J].Acta Pharm Sin,2008,43(5):461 - 6.

