小檗碱对糖皮质激素性骨质疏松大鼠松质骨和皮质骨的影响
许碧莲,徐道华,陈文双,崔 燎
(广东医学院1.药理教研室、2.广东天然药物研究与开发重点实验室,广东湛江 524023)
糖皮质激素具有抗炎、免疫抑制与抗过敏、抗休克等作用,临床上用于严重感染或炎症、自身免疫性疾病、过敏性疾病、呼吸系统疾病等,但长期应用可导致骨质疏松,增加骨折发生率[1]。如何防治糖皮质激素诱发骨质疏松(glucocorticoid induced osteoporosis,GIOP),是目前各学者研究的重点课题之一。小檗碱(berberine,BBR)又称黄连素,是一种异喹啉类生物碱,可从中草药黄连、黄柏中提取的化合物,具有抗炎、抗肿瘤、抗消化性溃疡、降血糖和调血脂等作用[2-3]。本课题组前期的实验结果显示[4],小檗碱可防治糖皮质激素诱发的大鼠胫骨上段松质骨的骨丢失,但对腰椎松质骨和胫骨中段皮质骨是否也有防治作用,尚未进一步的研究。本文通过骨组织形态计量学方法探讨小檗碱对糖皮质激素性骨质疏松大鼠腰椎松质骨和胫骨中段皮质骨的作用,并探讨其作用机制,为把小檗碱开发成抗骨质疏松药物提供实验依据。
1 材料与方法
1.1药品及仪器小檗碱购自Sigma公司;醋酸泼尼松购自浙江仙琚制药股份有限公司;碳酸钙维D片(每片含碳酸钙750 mg,维生素D3100 U)购自美国安士制药公司;盐酸四环素、钙黄绿素、Goldner’s染料购自美国Sigma公司。低速锯(Buehler LTD,USA);硬组织切片机(德国Leica 2155);碳化钨刚刀(德国Leica);自动化图像数字化分析仪包括光镜和荧光显微镜(Nikon,日本);骨组织形态计量学测量软件(KSS Scientific Consultants,USA)。
1.2动物及其分组3月龄♂ SD大鼠共60只(SPF级,广东医学院实验动物中心提供),体质量(270±15)g。大鼠随机分成6组:正常对照(CON)组、泼尼松(Pred)组、泼尼松加碳酸钙维D(Pred+Ca+VitD)组、泼尼松加小檗碱低剂量〔Pred+BBR(L)〕组、小檗碱中剂量〔Pred+BBR(M)〕组、小檗碱高剂量〔Pred+BBR(H)〕组,每组10只。CON组给予溶剂对照溶液,其它5组先用泼尼松3.5 mg·kg-1·d-1造模,1 h 后再分别给予溶剂对照溶液、碳酸钙 375 mg·kg-1·d-1及维生素 D350 U·kg-1·d-1、BBR 15、30、60 mg·kg-1·d-1。大鼠每次按 5 ml·kg-1灌胃给药,连续给药12周。每周称体重1次,并按体重变化调整给药量。所有动物在处死前d 14、13和d 4、3分别皮下注射钙黄绿素7.5 mg·kg-1进行体内荧光标记。实验结束时,大鼠麻醉后心脏抽血处死,迅速取出左侧胫骨及第5腰椎,以备进行下列骨形态计量学的测定。
1.3骨组织形态计量学测定取第5腰椎,用低速锯暴露骨髓腔,进行固定、脱水、包埋,按文献[5]制成 5 μm 和 8 μm 切片,5 μm 骨薄片采用 Masson-Goldner-Trichrome染色,染色后测量骨形态计量学静态参数和吸收参数,8 μm骨厚片直接封片测量有关动态参数,然后按公式[6]计算出相应的参数。取胫骨中段进行固定、脱水、包埋,按文献[7]制成40 μm左右的骨片,然后测量皮质骨有关动静态参数,按公式[6]计算出相应的参数。
1.4统计学方法计量资料以±s表示,SPSS11.5软件行方差分析并行组间比较。
2 结果
2.1各组大鼠腰椎松质骨的变化
2.1.1各组大鼠腰椎松质骨静态和吸收参数的变化与 CON组比较,Pred组腰椎骨小梁厚度(Tb.Th)降低(P<0.05),吸收参数每毫米破骨细胞数(Oc.N)、破骨细胞贴壁周长(Oc.S.Pm)均增加(P<0.05),但骨小梁数量(Tb.N)、骨小梁分离度(Tb.Sp)无明显变化(P>0.05)。与Pred组比较,碳酸钙维D和小檗碱3个剂量使Tb.Th增加(P<0.05),使Oc.N和Oc.S.Pm降低(P<0.05)。小檗碱3个剂量组之间差异无显著性(P>0.05)。见Tab 1。
与CON组比较,Pred组大鼠腰椎松质骨的骨量减少,碳酸钙维D和小檗碱可预防泼尼松所致骨量的减少。见Fig 1。
2.1.2各组大鼠腰椎松质骨动态参数的变化与CON组比较,Pred组腰椎标记周长百分数(%L.Pm)、骨矿化沉积率(MAR)、3种骨形成率(BFR/TV、BFR/BV、BFR/BS)均降低(P< 0.05,P<0.01)。与Pred组比较,碳酸钙维D和小檗碱3个剂量使动态参数均增加(P<0.05,P<0.01)。小檗碱中剂量组%L.Pm、BFR/TV、BFR/BV、BFR/BS较CON组增加明显,但与低剂量组和高剂量组之间差异无显著性(P>0.05)。见Tab 2。
2.1.3各组大鼠腰椎生长板纵向生长荧光标记的变化与CON组比较,Pred组腰椎生长板荧光标记间距缩小。碳酸钙维D和小檗碱3个剂量可预防泼尼松所致腰椎生长板荧光标记间距缩小。见Fig 2。
2.2各组大鼠胫骨中段皮质骨的变化
2.2.1各组大鼠胫骨中段皮质骨静态参数的变化与CON组比较,Pred组胫骨中段骨组织总面积(T.Ar)、皮质骨面积(Ct.Ar)均减少(P<0.05),但骨髓腔面积(Ma.Ar)、皮质骨面积百分数(%Ct.Ar)和骨髓腔面积百分数(%Ma.Ar)无变化(P>0.05)。与Pred组比较,碳酸钙维D组和小檗碱3个剂量组均无变化(P>0.05)。见Tab 3。
2.2.2各组大鼠胫骨中段皮质骨的动态变化与CON组比较,Pred组皮质骨的骨外膜的荧光减少。碳酸钙维D和小檗碱3个剂量对皮质骨均无影响。见Fig 3。

Fig 1 Micrographs of the sagittal section of fifth lumbar vertebrae(LV5)in different groups of rats(Goldner’s Trichrome staining ×10)
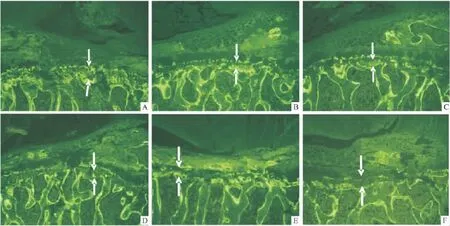
Fig 2 Micrographs of interlabeled width of growth plate of LV5 in different groups of rats(×100)
Tab 1 The changes of static and absorption parameters of LV5 in rats in each group(±s,n=10)

Tab 1 The changes of static and absorption parameters of LV5 in rats in each group(±s,n=10)
*P<0.05 vs control;△P<0.05 vs Pred
Group Tb.N/No.·mm -1 Tb.Th/μm Tb.Sp/μm Oc.N/No.·mm -1Oc.S.Pm/%Control 3.3 ±0.4 94.3 ±13.4 211.9 ±22.5 0.16 ±0.04 0.31 ±0.10 Pred 3.2 ±0.3 82.3 ±6.0* 230.1 ±29.8 0.38 ±0.06* 0.58 ±0.11*Pred+Ca+VitD 3.1 ±0.4 104.8 ±15.3△ 223.2 ±39.1 0.21 ±0.06△ 0.33 ±0.11△Pred+BBR(L)3.2 ±0.2 102.8 ±15.3△ 211.6 ±20.1 0.21 ±0.05△ 0.34 ±0.10△Pred+BBR(M)3.2 ±0.4 100.9 ±19.4△ 214.8 ±25.1 0.20 ±0.05△ 0.33 ±0.11△Pred+BBR(H)3.2 ±0.3 98.4 ±11.3△ 219.2 ±26.6 0.20 ±0.06△ 0.32 ±0.13△
Tab 2 The changes of dynamic parameters of LV5 in rats in each group(±s,n=10)

Tab 2 The changes of dynamic parameters of LV5 in rats in each group(±s,n=10)
*P<0.05,**P<0.01 vs control;△P<0.05,△△P<0.01 vs Pred
Group %L.Pm/% MAR/μm·d-1 BFR/TV/%·year-1 BFR/BV/%·year-1 BFR/BS/%·year -1 Control 6.15 ±2.11 1.17 ±0.13 14.17 ±4.50 45.82 ±13.41 2.59 ±0.86 Pred 1.83 ±1.22** 1.02 ±0.11* 3.62 ±2.46** 13.73 ±10.58** 0.68 ±0.49**Pred+Ca+VitD 4.79 ±1.43△ 1.14 ±0.11△ 10.39 ±4.22△△ 34.17 ±13.38△△ 2.00 ±0.68△△Pred+BBR(L)4.05 ±1.08△ 1.05 ±0.18 8.35 ±2.40△△ 26.21 ±8.44△ 1.56 ±0.43△△Pred+BBR(M)7.11 ±1.89△△ 1.26 ±0.09△ 17.36 ±4.25△△ 58.78 ±14.59△△ 3.28 ±0.92△△Pred+BBR(H)5.32 ±2.73△ 1.18 ±0.17△ 12.29 ±6.93△△ 39.96 ±23.95△△ 2.36 ±1.46△△
Tab 3 The changes of static paramerers of Tx in rats in each group(±s,n=10)
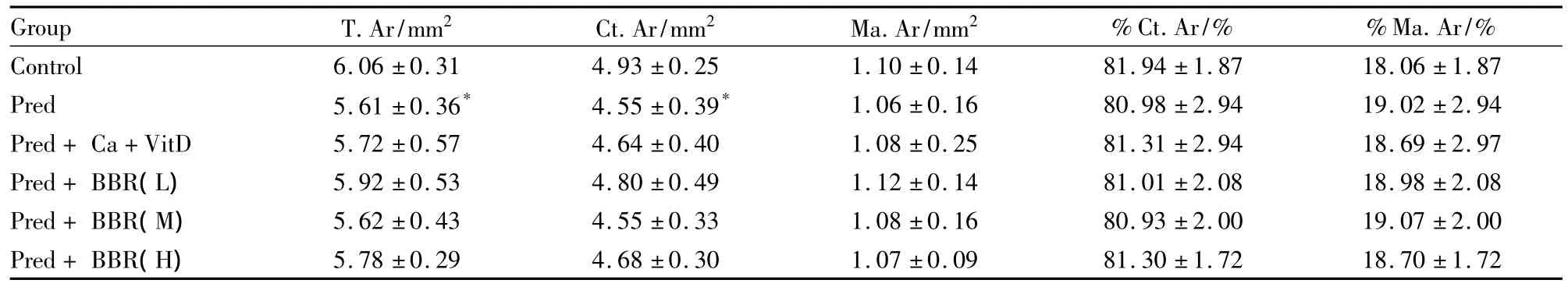
Tab 3 The changes of static paramerers of Tx in rats in each group(±s,n=10)
*P<0.05 vs control
Group T.Ar/mm2 Ct.Ar/mm2 Ma.Ar/mm2%Ct.Ar/% %Ma.Ar/%Control 6.06 ±0.31 4.93 ±0.25 1.10 ±0.14 81.94±1.87 18.06 ±1.87 Pred 5.61 ±0.36* 4.55 ±0.39* 1.06 ±0.16 80.98 ±2.94 19.02 ±2.94 Pred+Ca+VitD 5.72 ±0.57 4.64 ±0.40 1.08 ±0.25 81.31 ±2.94 18.69 ±2.97 Pred+BBR(L)5.92 ±0.53 4.80 ±0.49 1.12 ±0.14 81.01 ±2.08 18.98 ±2.08 Pred+BBR(M)5.62 ±0.43 4.55 ±0.33 1.08 ±0.16 80.93 ±2.00 19.07 ±2.00 Pred+BBR(H)5.78 ±0.29 4.68 ±0.30 1.07 ±0.09 81.30 ±1.72 18.70 ±1.72

Fig 3 Micrographs of the dynamic changes of the tibial shaft(Tx)in different groups in rats(×40)
3 讨论
骨质疏松症是以骨量减少、骨的微观结构退化为特征,致使骨的脆性增加,易发生骨折的一种全身性骨骼疾病。骨质疏松症分为原发性、继发性和特发性骨质疏松。继发性骨质疏松是由其它疾病或药物等因素诱发的骨质疏松,GIOP是最常见的继发性骨质疏松,其发病率仅次于绝经后骨质疏松及老年性骨质疏松而居第3位,GIOP患者受到轻微外力骨折的风险增加30%~40%,发生骨折的部位主要在腰椎及髋骨等。
由Tab 1和Fig 1的结果可见,泼尼松组大鼠腰椎松质骨的骨量减少,骨小梁厚度降低,但每毫米破骨细胞数、破骨细胞贴壁周长均增加。由Tab 2的结果可见,泼尼松组腰椎松质骨标记周长百分数、骨矿化沉积率、骨形成率均降低。由Fig 2的结果可见,泼尼松组腰椎生长板纵向生长荧光标记间距明显缩小。结果提示,泼尼松既抑制大鼠腰椎松质骨的骨形成和骨矿化,又促进骨吸收,但以抑制骨形成为主,导致松质骨的丢失。糖皮质激素诱发骨丢失的可能机制为[8-9]:①激素可直接抑制成骨细胞的产生,加速成骨细胞的凋亡,同时可抑制胰岛素样生长因子在成骨细胞的表达,降低骨的转换率。②继发性甲状旁腺素分泌增加,激活破骨细胞,促进骨吸收,导致骨量减少。③抑制胃肠道对钙的吸收,增加钙磷的排泄。④可引起睾酮缺乏,抑制十二指肠跨膜钙离子转运载体活性,减少钙离子结合蛋白的合成,导致肠道钙吸收障碍,继而抑制骨形成,促进骨吸收。⑤抑制雌激素分泌,降低钙磷在骨质的沉着。⑥引起脂质代谢异常,造成骨髓微脂肪栓形成,骨髓微循环压力增高,骨缺血坏死。
由Tab 3的结果可见,泼尼松使胫骨中段骨组织总面积、皮质骨面积均减少。由Fig 3的结果可见,泼尼松使皮质骨的骨外膜的荧光减少。提示泼尼松抑制皮质骨的骨外膜的骨形成,导致骨代谢的负平衡,皮质骨量减少,胫骨中段变小。文献报道[10],糖皮质激素对大鼠皮质骨的影响主要是使骨外膜面的骨形成减少,并使骨内膜面的骨吸收增加,从而导致皮质骨变薄,骨髓腔增大。但本实验结果显示泼尼松对骨髓腔面积、骨内膜的骨形成无影响,提示泼尼松对皮质骨的骨内膜影响不大,具体机制有待于进一步研究。
由结果可见,碳酸钙维D使泼尼松大鼠腰椎松质骨的骨量、骨小梁厚度、标记周长百分数、骨矿化沉积率、骨形成率均增加,而使骨吸收参数降低,提示碳酸钙加维生素D可预防糖皮质激素诱发的松质骨的骨丢失。碳酸钙加维生素D预防骨丢失的机制为[11]:①碳酸钙补充骨矿物质,促进骨矿化,利于骨形成;②维生素D3能增加小肠吸收饮食中钙和磷,维持钙磷平衡。在骨重建过程中,维生素D3可增加成骨细胞活性。③维生素D3合并小剂量钙,能增加小肠对钙的吸收,补充矿物质,预防骨量丢失和减少骨折的发生。
由结果可见,小檗碱 15、30、60 mg·kg-1·d-1均使泼尼松大鼠腰椎松质骨的骨量、骨小梁厚度、标记周长百分数、骨矿化沉积率、骨形成率均增加,而使骨吸收参数降低,提示小檗碱可预防GC诱发的腰椎松质骨的骨丢失,主要是通过促进骨形成,抑制骨吸收而实现的。小檗碱为中草药黄连、黄柏中的主要活性成分,文献报道[12],小檗碱可通过抑制骨吸收预防去卵巢大鼠的胫骨上段松质骨的丢失。黄柏小檗碱可增加去卵巢大鼠股骨干骺端的骨密度,其机制可能是抑制骨吸收、促进骨形成,促进雌二醇和降钙素合成[13]。小檗碱可促进骨髓间充质干细胞向成骨细胞分化,增强骨钙化[14]。小檗碱通过p38 MAPK激活 Runx2而促进成骨细胞分化[15]。小檗碱抑制抗酒石酸酸性磷酸酶(tartrate-resistant acid phosphatase,TRAP)阳性多核破骨细胞的形成和TRAP活性,减少破骨性骨吸收陷窝的面积,提示小檗碱通过抑制破骨细胞的形成、分化和骨吸收功能减少骨质的丢失[16]。小檗碱还可能通过上调肝脏Insig-2基因表达,抑制肝脏中胆固醇的合成代谢,发挥调节血脂作用[17],从而改善糖皮质激素所致血脂代谢异常[18],预防糖皮质激素诱发的骨丢失和骨坏死。
由Tab 2的结果可见,小檗碱30 mg·kg-1·d-1中剂量组%L.Pm、BFR/TV、BFR/BV、BFR/BS虽然较正常对照组增加明显,但与15 mg·kg-1·d-1低剂量组和 60 mg·kg-1·d-1高剂量组之间无统计学意义,提示小檗碱3个剂量的作用效果相似,在15 ~60 mg·kg-1·d-1剂量范围内没有剂量相关性。小檗碱的剂量相关性还有待于进一步的探索。
由结果可见,碳酸钙维 D和小檗碱15、30、60 mg·kg-1·d-1对泼尼松大鼠胫骨中段皮质骨各项参数均无影响,提示碳酸钙维D和小檗碱不能预防糖皮质激素诱发的大鼠皮质骨的骨丢失。可能是由于皮质骨对药物反应程度不如松质骨敏感,抗骨质疏松药物如氟化物、双膦酸盐类以及PTH对皮质骨的效果也均不明显[19]。
[1]Hara K,Kobayashi M,Akiyama Y.Vitamin K2(menatetrenone)inhibits bone loss induced by prednisolone partly through enhancement of bone formation in rats[J].Bone,2002,31(5):575 -81.
[2]Kong W,Wei J,Abidi P,et al.Berberine is a novel cholesterollowering drug working through a unique mechanism distinct from statins[J].Nat Med,2004,10(12):1344 -51.
[3]房 辉,汪 晖.小檗碱作用的研究进展[J].时珍国医国药,2006,17(3):421-3.
[3]Fang H,Wang H.Progress in the role of berberine[J].Lishizhen Med Mat Med Res,2006,17(3):421 -3.
[4]Xu D H,Yang W,Zhou C H,et al.Preventive effects of berberine on glucocorticoid-induced osteoporosis in rats[J].Planta Med,2010,76(16):1809 -13.
[5]刘钰瑜,崔 燎,姚卫民,等.前列腺素衍生物对去卵巢大鼠骨质疏松的治疗作用[J].中国药理学通报,2009,25(10):1327-30.
[5]Liu Y Y,Cui L,Yao W M,et al.Effects of prostaglandin on osteoporosis in ovariectomized rats[J].Chin Pharmacol Bull,2009,25(10):1327-30.
[6]Parfitt A M,Drezner M K,Glorieux F H,et al.Bone histomorphometry:standardization of nomenclature,symbols and units.Report of the ASBMR histomorphometry nomenclature committee[J].J Bone Miner Res,1987,2:595 -610.
[7]许碧莲,崔 燎,陈文双,等.维甲酸致大鼠骨质疏松模型探讨及丹参骨宝的预防作用[J].中国药理学通报,2010,26(4):539-43.
[7]Xu B L,Cui L,Chen W S,et al.Effects of retinoic acid on induction osteroporosis model rats and preventive effects of DanShen-GuBao[J].Chin Pharmacol Bull,2010,26(4):539 -43.
[8]Canalis E.Mechanisms of glucocorticoid-induced osteoporosis[J].Curr Opin Rheumatol,2003,15(4):454 -7.
[9]Pereira R M,Delany A M,Canalis E.Cortisol inhibits the differentiation and apoptosis of osteoblasts in culture[J].Bone,2001,28(5):484-90.
[10]吴 铁,冯冰虹.药理学[M].北京:科学出版社,2010:435-6.
[10]Wu T,Feng B H.Pharmacology[M].Beijing:Science Press,2010:435-6.
[11]李青南.骨质疏松实验动物研究—骨组织形态计量学[M].成都:四川大学出版社,2001:45.
[11]Li Q N.The study of animal experiment on osteopenia-bone histomorphometry[M].Chengdu:Sichuan University Press,2001:45.
[12]Qin L,Han T,Zhang Q,et al.Antiosteoporotic chemical constituents from Er-Xian Decoction,a traditional Chinese herbal formula[J].J Ethnopharmacol,2008,118(2):271 -9.
[13]年 华,徐玲玲,马明华,等.黄柏小檗碱对去卵巢大鼠骨质疏松症的作用[J].药学服务与研究,2007,7(1):41-4.
[13]Nian H,Xu L L,Ma M H,et al.Effects of berberine from Cortex Phellodendri Chinensis on osteoporosis in ovariectomized rats[J].Pharma Care Res,2007,7(1):41 -4.
[14]杨 玮,徐道华,周晨慧,等.小檗碱对骨髓间充质干细胞成骨分化的影响[J].中国药理学通报,2010,26(12):1560-3.
[14]Yang W,Xu D H,Zhou C H,et al.Effect of berberine on the osteogenic differentiation of bone marrow mesenchymal cells[J].Chin Pharmacol Bull,2010,26(12):1560 -3.
[15]Lee H W,Suh J H,Kim H N,et al.Berberine promotes osteoblast differentiation by Runx2 activation with p38 MAPK[J].J Bone Miner Res,2008,23(8):1227-37.
[16]魏 鹏,焦 磊,秦路平,等.小檗碱对大鼠骨髓源性破骨细胞的分化及骨吸收功能的影响[J].中西医结合学报,2009,7(4):342-8
[16]Wei P,Jiao L,Qin L P,et al.Effects of berberine on differentiation and bone resorption of osteoclasts derived from rat bone marrow cells[J].J Chin Integr Med,2009,7(4):342 - 8.
[17]常 伟,王 红,尹华峰,等.小檗碱对胆固醇代谢及肝脏Insig-2基因表达的影响[J].中国药理学通报,2009,25(1):85-8.
[17]Chang W,Wang H,Yin H F,et al.Effects of berberine on cholesterolmetabolism and Insig-2 gene expression of hyperlipidemic rats[J].Chin Pharmacol Bull,2009,25(1):85 -8.
[18]徐道华,周晨慧,刘钰瑜,等.小檗碱对糖皮质激素大鼠血脂异常的调节作用[J].时珍国医国药,2010,21(5):1033-4.
[18]Xu D H,Zhou C H,Liu Y Y,et al.Regulative effect of berberine on glucocorticoid-induced dyslipidemia[J].Lishizhen Med Mat Med Res,2010,21(5):1033 -4.
[19]许碧连,吴 铁,崔 燎,等.己烯雌酚对去卵巢大鼠不同部位骨骼的影响[J].中国老年学杂志,2004,24(12):1173-6.
[19]Xu B L,Wu T,Cui L,et al.The effects of diethylstilbestrol on different part of the bone in ovariectomized rats[J].Chin J Gerontol,2004,24(12):1173 -6.

