白藜芦醇对人黑色素瘤细胞增殖及凋亡的影响
刘 浩,蒋琛琛,程 秀,方 琳,陈 超,张旭东,蒋志文
(蚌埠医学院药学系,安徽省生化药物工程技术研究中心,安徽蚌埠 233030)
白藜芦醇(resveratrol,Res),化学名称为 3,4 ,5-三羟基芪(3,4 ,5-trihydroxystilbene),是非黄酮类的多酚化合物。主要存在于葡萄、虎杖、藜芦等植物中。1940年首次从毛叶叶黎芦(Veratrum grandiortuaLoes)的根部分离得到,1977年在葡萄中发现Res作为植物抗毒素存在。有研究认为从饮用葡萄酒中摄取Res是法国人心血管疾病发病率低的重要原因之一。随后的研究发现Res其具有许多重要的生理活性,如:抗肿瘤、保护心血管系统、抗氧化等作用[1-2]。Res甚至被喻为继紫杉醇之后又一新的绿色抗癌药物。其存在的形式有顺式和反式,植物中主要以反式存在,其生理活性强于其顺式异构体[3]。本研究旨在观察反式Res对人黑色素瘤细胞增殖的抑制及诱导凋亡的作用。
1 材料与方法
1.1细胞株人黑色素瘤细胞株 Mel-RM和MM200由Commonwealth Serum实验室提供(Australia),本实验室保种。培养条件:含5%FCS的DMEM高糖型培养基,37℃,5%CO2饱和湿度培养箱。
1.2主要试剂白藜芦醇(纯度大于99.5%),购于美国Sigma公司,用DMSO溶解,母液浓度为80 mmol·L-1,-20℃避光保存;胎牛血清购于杭州四季青公司;DMEM培养基购于Gibco公司;溴化丙啶(propidium iodide,PI)购于美国Sigma公司;JC-1检测试剂购于美国Molecular Probes公司;Caspase-3活性检测试剂盒购于碧云天生物技术研究所。
1.3MTT法检测细胞存活率取对数生长期细胞,0.25%胰蛋白酶消化制成单细胞悬液,并调整细胞密度为1×107·L-1,接种于96孔板中,每孔200 μl,于 5%CO2、饱和湿度、37℃培养箱中培养 24 h。不同浓度(10、20、40、80、160 μmol·L-1)Res处理,每组设3个复孔,继续培养24、48、72 h后每孔加入MTT(5 g·L-1)15 μl,继续培养4 h,弃去培养液,每孔加入 DMSO 150 μl,培养箱内孵育30 min,微量振荡器振荡10 min使结晶物充分溶解,酶标仪在570nm波长下检测每孔的吸光度(A)值,计算细胞存活率:细胞存活率/%=实验组A值/对照组A值×100%。以上实验重复3次。
1.4PI染色应用24孔细胞培养板,接种细胞1×105个/孔,培养24 h后加Res,继续培养24 h后收集各孔培养液至对应流式管中,用预冷PBS清洗每孔,收集清洗液至对应培养液中,1200r·min-1离心10 min,弃上清;培养板中加入PI缓冲液(0.005 g PI、0.1g 柠檬酸钠、100 μl Triton X-100、100ml dH2O)750μl/孔,37℃孵育10min,吹打收集细胞至对应流式管中,轻轻摇动混匀。4℃避光保存,过夜,上流式细胞仪检测具有亚G1期DNA含量的细胞比例,代表凋亡细胞数。

Fig 1 Res inhibits the proliferation of human melanoma cells
1.5JC-1染色接种细胞至24孔板,1.0×105/孔,培养过夜后给予Res处理细胞24 h后,收集细胞按照试剂盒说明进行操作,流式细胞仪检测并进行软件分析。
1.6Caspase-3活性检测按照说明书进行检测,反应温度为 37℃。取样本 100 μl,Ac-DEVD-AMC(Caspase-3四肽荧光底物)10 μl加到HEPES缓冲液中,在37℃下作用1 h,应用荧光分光光度计在波长405 nm处测吸光度,以不加底物的样本作空白,结果以吸光度值表示。
1.7统计学方法采用SPSS13.0统计软件包分析,实验数据以±s表示,各组间比较采用单因素方差分析。
2 结果
2.1Res对人黑色素瘤细胞增殖的抑制作用实验中使用不同浓度的Res处理人黑色素瘤细胞株Mel-RM,MM200,使用MTT法检测细胞存活率。结果表明,随着 Res浓度的增加(10、20、40、80、160 μmol·L-1),Mel-RM,MM200 细胞的存活率明显减少,实验分别检测了Res处理24、48、72 h后细胞的存活率,显示,随着作用时间的延长,Res表现出对人黑色素瘤细胞增殖的抑制作用,见Fig 1。
2.2Res诱导黑色素瘤细胞凋亡的作用根据MTT 结果,实验给予 80 μmol·L-1和 160 μmol·L-1两个不同浓度的Res处理黑色素瘤细胞24 h,采用PI染色,流式细胞仪测细胞凋亡率,结果显示,Res可使黑色素瘤细胞出现subG1细胞增多,即出现凋亡峰。浓度为 80 μmol·L-1和 160 μmol·L-1的Res诱导黑色素瘤细胞的凋亡率分别为30.8%和49.9%(Mel-RM),40.2%和67.2%(MM200),较对照组明显增加(P<0.05),见Fig 2。
2.3Res对黑色素瘤细胞线粒体膜电位的影响分别给予 80 μmol·L-1和 160 μmol·L-1的 Res处理黑色素瘤细胞,24 h后收集细胞,进行JC-1染色,流式细胞仪检测线粒体膜电位变化。Fig 3可见Res处理后Mel-RM和MM200的线粒体膜电位比例均明显降低。
2.4Res对黑色素瘤细胞Caspase-3活性的影响根据Res对黑色素瘤细胞凋亡的影响作用,实验中给予 80 μmol·L-1和 160 μmol·L-1的 Res 分别处理Mel-RM和MM200细胞,24 h后收集细胞,按照Caspase-3活性试剂盒检测Caspase-3活性,结果表明:Res刺激人黑色素瘤细胞后,Caspase-3活性有明显的增强(P<0.05)。
3 讨论
近年来,黑色素瘤的发病率不断的上升,给人类的健康带来巨大的威胁。早期诊断的黑色素瘤患者通常仅用手术治疗即可取得良好的效果。而对播散的黑色素瘤,通常对目前所有的抗肿瘤药物均不敏感,预后较差,其一年生存率仅为50%。因此探明黑色素瘤早期诊断的分子标志,寻求安全有效的治疗药物十分迫切[4]。
越来越多的研究证明了白藜芦醇对包括鼻咽癌,肝癌,肺癌,胃癌,前列腺癌.甲状腺癌,白血病等多种肿瘤都有作用。对白藜芦醇抗肿瘤活性机制的研究显示,白藜芦醇在肿瘤起始、促进和发展3个阶段都具有抑制效果。能够抗突变,抗氧化,抑制自由基并诱导Ⅱ期药代酶;能抑制环氧化酶(COX-2),具有很强的抗炎作用;能诱导癌细胞分化,诱导癌细胞凋亡。同时,白藜芦醇还具有潜在的抗肿瘤转移作用[5-6]。白藜芦醇作用于高转移卵巢癌细胞后能抑制细胞体外趋化运动和黏附能力,但不影响其侵袭人工基底膜的能力[7]。有文献报道,白藜芦醇对小鼠黑色素瘤细胞增殖具有诱导作用,并可诱导其凋亡[8-9]。本实验以人黑色素瘤细胞为研究对象,观察了白藜芦醇体外诱导黑色素瘤细胞凋亡的作用及对Caspase-3的影响。
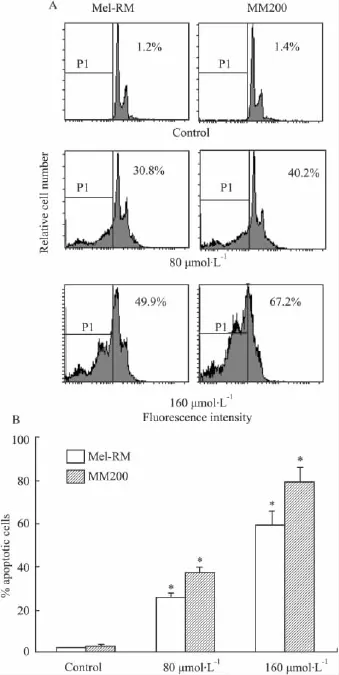
Fig 2 Res induces apoptosis in human melanoma cells
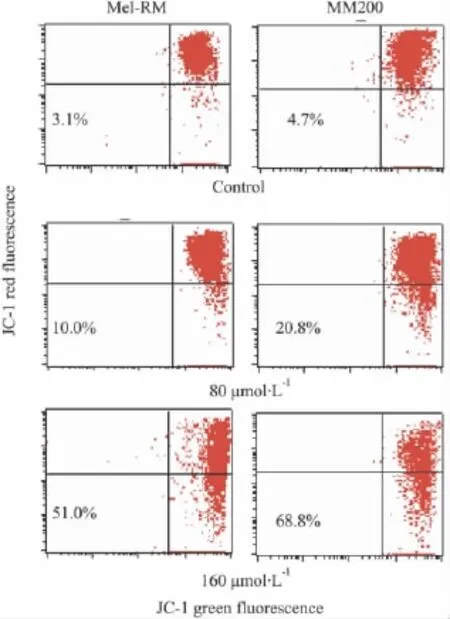
Fig 3 Effect of Res on the mitochondrial membrane potential(△Ψm)in Mel-RM and MM200 cells

Fig 4 Effect of Res on the activity of Caspase-3 in Mel-RM and MM200 cells
线粒体在细胞凋亡的过程中起着枢纽作用,多种细胞凋亡刺激因子均可诱导细胞发生凋亡,而线粒体跨膜电位的下降,被认为是细胞凋亡级联反应过程中最早发生的事件,它发生在细胞核凋亡特征(染色质浓缩、DNA断裂)出现之前,一旦线粒体跨膜电位崩溃,则细胞凋亡不可逆转[10-11]。本实验中使用亲脂性阳离子荧光染料 Tetrechloro-tetraethylbenzimidazol carbocyanine iodide(JC-1)进行染色分析,JC-1可结合到线粒体基质,其荧光的增强或减弱说明线粒体内膜电负性的增高或降低[12-13]。白藜芦醇对黑色素瘤细胞线粒体跨膜电位的影响也提示了其诱导凋亡的作用。但其降低线粒体跨膜电位诱导凋亡的机制尚不明确,可能是线粒体膜电位变化直接激活线粒体途径的凋亡通路。由于△Ψm下降,通过不同的途径活化Caspase-3,从而引起细胞凋亡。
Caspases是一组由无活性的酶原合成的半胱氨酸蛋白酶,通过上游Caspases前体的裂解而激活,引起一组级联反应,Caspase家族在介导细胞凋亡的过程具有极为重要的作用,其中Caspase-8参与凋亡的起始,可剪切活化,而Caspase-3为关键的执行分子,它在凋亡信号传导的许多途径中发挥功能[14-15]。Caspase-3正常以前体(32 ku)的形式存在于胞质中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17 ku)和两个小亚基(12 ku)组成,裂解相应的胞质胞核底物,最终导致细胞凋亡[16-17]。Caspase-3 可以催化底物 Ac-DEVD-pNA(acetyl-Asp-Glu-Val-Asp p-nitroanilide)产生黄色的pNA(p-nitroaniline),从而可以通过测定吸光度来检测Caspase-3的活性。本实验结果发现,白藜芦醇在诱导人黑色素瘤细胞凋亡的过程中出现Caspase-3的活化。
本实验证明了白藜芦醇对人黑色素瘤细胞凋亡的诱导作用,观察了其对线粒体膜电位的影响及激活Caspase-3的作用,表明白藜芦醇在黑色素瘤的治疗中一定的价值,但其分子机制尚需进一步的探讨,且需毒性试验及体内试验的研究支持。
[1]Guerrero R F,García-Parrilla M C,Puertas B,Cantos-Villar E.Wine,resveratrol and health:a review[J].Nat Prod Commun,2009,4(5):635-58.
[2]李延华,王伟君,张兰威,等.白藜芦醇的研究现状及应用前景[J].中国酿造,2008,184(7):10 -2.
[2]Li Y H,Wang W J,Zhang L W,et al.Current situation and prospect of resveratrol research[J].China Brew,2008,184(7):10 -2.
[3]初 明,魏兰兰,胡志强.白黎芦醇的化学防癌作用及其分子机制的研究进展[J].中国新药与临床杂志,2005,3(24):235-8.
[3]Chu M,Wei L L,Hu Z Q.Progress in studies on cancer chemopreventive activity and molecular mechanism of resveratrol as chemopreventive agent[J].Chin J New Drugs Clin Remed,2005,3(24):235-8.
[4]Bhatia S,Tykodi S S,Thompson J A.Treatment of metastatic melanoma:an overview[J].Oncology(Williston Park),2009,23(6):488-96.
[5]Liu H,Jiang C C,Lavis C J,et al.2-Deoxy-D-glucose enhances TRAIL-induced apoptosis in human melanoma cells through XBP-1-mediated up-regulation of TRAIL-R2[J].Mol Cancer,2009,8(12):122.
[6]Bishayee A.Cancer prevention and treatment with resveratrol:from rodent studies to clinical trials[J].Cancer Prev Res(Phila Pa),2009,2(5):409-18.
[7]Tyagi A,Singh R P,Agarwal C,et al.Resveratrol causes Cdc2-tyr15 phosphorylation via ATM/ATR-Chk1/2-Cdc25C pathway as a central mechanism for S phase arrest in human ovarian carcinoma Ovcar-3 cells[J].Carcinogenesis,2005,26(11):1978 -87.
[8]Hsieh T C,Wang Z,Hamby C V,Wu J M.Inhibition of melanoma cell proliferation by resveratrol is correlated with upregulation of quinone reductase 2 and p53[J].Biochem Biophys Res Commun,2005,334(1):223-30.
[9]Gatouillat G,Balasse E,Joseph-Pietras D,et al.Resveratrol induces cell-cycle disruption and apoptosis in chemoresistant B16 melanoma[J].J Cell Biochem,2010,110(4):893 -902.
[10]Jiang C C,Wroblewski D,Yang F,et al.Human melanoma cells under endoplasmic reticulum stress are more susceptible to apoptosis induced by the BH3 mimetic obatoclax[J].Neoplasia,2009,11(9):945-55.
[11]刘 浩,蒋志文,童旭辉,张旭东.硫酸乙酰肝素蛋白聚糖对C3H小鼠乳腺癌移植瘤的抑制作用及其机制[J].中国药理学通报,2008,24(6):744-8.
[11]Liu H,Jiang Z W,Tong X H,Zhang X D.Inhibitory effects of heparan sulfate proteoglycan on mice transplanted tumors[J].Chin Pharmacol Bull,2008,24(6):744 -8.
[12]Bedner E,Li X,Gorczyca W,et al.Analysis of apoptosis by laser scanning cytometry[J].Cytometry,1999,35(3):181 - 95.
[13]Nimmanapalli R,Bhalla K.Targets in apoptosis signaling:promise of selective anticancer therapy[J].Methods Mol Biol,2003,223:465-83.
[14]程 秀,刘 浩,方 琳,等.2-DG增强乳腺癌细胞对阿霉素化疗敏感性的作用[J].中国药理学通报,2010,26(10):1371-6.
[14]Cheng X,Liu H,Fang L,et al.2-DG enhances chemosensitivity of breast cancer cells to adriamycin[J].Chin Pharmacol Bull,2010,26(10):1371-6.
[15]Lin C,Crawford D R,Lin S,et al.Inducible COX-2-dependent apoptosis in human ovarian cancer cells[J].Carcinogenesis,2011,32(1):19-26.
[16]Gupta S C,Kannappan R,Reuter S,et al.Chemosensitization of tumors by resveratrol[J].Ann N Y Acad Sci,2011,1215(1):150-60.
[17]Bursch W,Karwan A,Mayer M,et al.Cell death and autophagy:cytokines,drugs,and nutritional factors[J].Toxicology,2008,254(3):147-57.

