吡格列酮对糖尿病大鼠肾组织podocalyxin表达的影响
邢 燕,叶山东,胡 闻,陈 珂,陈玉米,陈 燕,范爱红
(安徽医科大学附属省立医院1.内分泌科、2.病理科、3.肾内科,安徽 合肥 230001)
近来不少动物实验和临床研究显示噻唑烷二酮类药物(TZDs),包括吡格列酮(pioglitazone,PIO)和罗格列酮等可明显减少糖尿病动物及糖尿病患者尿白蛋白的排泄,对肾脏提供明确的保护作用[1],但确切机制尚未明了,可能是多因素的,如改善血流动力学、抑制系膜增生和保护足细胞,抑制炎症反应等[2]。Podocalyxin(PCX)作为足突顶端质膜的主要结构部分,是足突顶膜区主要的带负电荷的唾液酸蛋白,参与维持足细胞的正常结构和滤过屏障的完整。本实验旨在观察不同剂量PIO对糖尿病大鼠肾脏的保护作用及其对肾小球足细胞相关分子PCX表达及经尿排泄的影响,探讨PIO对糖尿病大鼠足细胞的保护作用及其剂量依赖性,为临床应用PIO防治DN提供实验依据。
1 材料与方法
1.1实验动物健康清洁级♂ Sprague-Dawley(SD)大鼠50只,2月龄,体质量(196±20)g,由安徽医科大学实验动物中心提供〔合格证号:SCXK(皖)2005-001〕。实验期间,室温控制在(19±1)℃,湿度48%,12 h交替照明,大鼠自由进食饮水。
1.2药品及试剂盐酸吡格列酮由江苏恒瑞公司提供(批号:07062551),临用时用生理盐水溶解。尿白蛋白试剂盒购自北京北方生物技术研究所(批号:20090320);肌酐测定试剂盒购自上海荣盛生物药业有限公司(批号:20100120);STZ购自Sigma公司(批号:S0130);PCX ELISA试剂盒购自R&D公司(批号:201002);甘精胰岛素购自赛诺菲-安万特公司;PCX多克隆抗体购自北京博奥森生物技术有限公司(批号:bs1345R),免疫组化Elivision TM-plus试剂盒(鼠/兔)购自福州迈新生物技术开发公司;逆转录试剂盒购自 TaKaRa公司(批号:DRR036A),PCR试剂盒购自TaKaRa公司。
1.3仪器德国罗氏公司优越型血糖仪,Unico UV-2600系列紫外分光光度计(美国),DFM-96型10管放射免疫γ计数仪(安徽合肥众成机电公司),Biocell HT-1酶标仪(奥地利),Ultra2全自动糖化血红蛋白分析仪(Primus公司,美国),显微镜(日本OlympusBX41),PCR 仪(Biometra gradient),日产JEM-1230型透射电镜。
2 方法
2.1糖尿病大鼠模型的制备和分组50只大鼠适应性喂养1周,检测血糖均正常。设立正常对照组(NC组,n=8),其余42只大鼠禁食12 h后,在空腹状态下,链脲佐菌素(STZ)按65 mg·kg-1一次性腹腔注射。STZ临用前用0.1 mmol·L-1无菌枸橼酸缓冲液配制为6.5 g·L-1,pH 4.3。72 h后测血糖≥16.7 mmol·L-1为糖尿病大鼠模型,其中6只大鼠因不能耐受血糖急骤增高而死亡,余下36只大鼠全部造模成功。稳定1周后,造模成功的36只大鼠随机分4组:糖尿病模型组(模型组,DM组)、吡格列酮1组(DR1组)、吡格列酮2组(DR2组)和吡格列酮3组(DR3组),每组各9只。DR1、DR2、DR3组分别予以吡格列酮10、20和30 mg·(kg·d)-1的混悬液灌胃,NC组和模型组给予等量生理盐水灌胃,每天1次,持续8周。为防止血糖过高或糖尿病酮症酸中毒的发生,对于血糖过高者(>33.3 mmol·L-1)给予皮下注射甘精胰岛素0.5 U,视情况每周注射2~3次,维持血糖在 20~30 mmol·L-1。实验过程中DR3组1只大鼠死于尾部感染,DR1、模型组各有1只大鼠因血糖过高死亡,DR2组大鼠1只大鼠死于灌胃窒息。
2.2标本留取注射STZ稳定7 d后设为0周,开始分组干预治疗。分别于0周、8周末留尿置于-40℃冰箱保存待测尿白蛋白(Alb)、视黄醇结合蛋白(RBP)、PCX和肌酐。8周末各组大鼠在10%的水合氯醛腹腔注射麻醉下行腹主动脉插管收集血标本检测HbA1c、血脂和肾功能,然后留取左侧肾脏,经生理盐水反复灌洗去除包膜后称重,肾脏肥大指数(KI)=左肾重/体重(mg·g-1),部分肾脏组织分离皮质和髓质,液氮保存待做PCR。
2.3实验室指标的检测放射免疫法测定尿Alb和RBP;苦味酸法检测尿肌酐;亲和层析HPLC系统检测HbA1c;参考Kanno等[3]的方法利用酶联免疫分析法检测尿沉渣中的PCX。本实验均留取随机尿,为消除尿量的差异,UPCX、UAlb、URBP均以尿肌酐(Ucr)校正,简称为 UPCR、UACR、URCR。
2.4肾脏病理取约1 mm3的肾皮质组织块,经2.5%戊二醛固定,制作超薄切片,透射电镜下观察。超薄切片在20 000倍下拍摄10个视野,随机测量连续8处肾小球毛细血管基底膜厚度,取平均值为GBM厚度(GBMT)。测量出基底膜的总长度设为X,基底膜上融合足突的总长度设为Y,以Y/X计算足突融合率(FPFR)。
2.5免疫组化检测肾组织PCX水平Elivision法检测肾组织PCX蛋白,每张切片在200倍下,随机采集皮质区10个视野,全自动图像分析系统 (Image pro plus 6.0)对图像中的阳性反应部位测定累积光密度(integrated optical density,IOD)及相应面积,取IOD作为每张切片阳性物质的相对含量。
2.6 RT-PCR检测肾皮质PCX mRNA水平TRIzol法提取肾皮质总RNA,取2 μg总RNA,70℃温浴10 min后立即放置冰上,加入RT mix经37℃ 60 min,85℃ 5 min孵育,逆转录合成cDNA,用特异性引物对逆转录产物进行半定量PCR。PCX上游引物5'-GCAGGGCTTTGAACCTCTTG-3',下游引物5'-GCTCTGTGACACTCGGATTT-3',目的片段长度为343 bp;反应条件:94℃预变性5 min,95℃变性45 s,60.9℃退火 30 s,72℃延伸 1 min 的热循环,循环38次后,终末72℃延伸7 min,以 GAPDH为内参照。GAPDH上游引物5'-AGATCCACAACGGATACATT-3',下游引物5'-TCCCTCAAGATTGTCAGCAA-3',目的片段为308 bp。取8 μl PCR产物经1.5%琼脂糖凝胶电泳,EB染色,紫外灯下照相,Biosens 805型凝胶成像系统分析电泳条带的光密度并以GAPDH校正作相对量分析,数值以PCX/GAPDH条带光密度比值表示PCX mRNA产物的相对半定量值。
2.7统计学处理所有计量资料以±s表示。同一时间点的多组分析采用单因素方差分析,组间两两比较采用LSD法,采用Pearson相关分析相关指标,所有统计均用SPSS17.0统计软件包进行。
3 结果
3.1一般情况、血糖、及8周末HbA1c、血脂、肾功能实验观察期间,各糖尿病大鼠均表现出多饮、多尿、多食以及体重减轻;各时间点血糖和8周末HbA1c均明显高于NC组(P<0.01组),各糖尿病组间差异无统计学意义。各吡格列酮组BUN、TG明显低于模型组(P<0.05),DR2及DR3组HDL-C水平高于模型组(P<0.05),DR1组虽轻度升高但与模型组比较差异无统计学意义,见Tab 1。
3.2各组UACR、URCR、UPCR、KI和GBMT比较0周时NC组与各糖尿病大鼠之间UACR、URCR和UPCR差异均无统计学意义。
8周末,各糖尿病组大鼠UACR,URCR、UPCR、KI和GBMT均明显高于NC组(均P<0.05);与模型组比较,各吡格列酮组UACR和URCR、KI和GBMT明显降低(均P<0.05),且DR2组和DR3组明显低于DR1组(均P<0.05);DR2和DR3组UPCR明显低于模型组(P<0.01),且DR2和DR3组低于DR1组(P<0.05),DR1组UPCR轻度降低,但与模型组比较差异无统计学意义。见Tab 2。
3.3肾脏病理学变化8周末,电镜下NC组基底膜结构清晰,均匀一致,足突完整,基本无足突融合。与NC组相比,模型组大鼠肾小球毛细血管基底膜呈不规则增厚,结构模糊不清,可见足突破坏、融合、消失,基底膜厚度(GBMT)及足突融合率(FPFR)均明显高于NC组(均P<0.05)。各PIO组肾小球基底膜厚度、足突融合率高于NC组,但明显低于模型组 (均P<0.05),且 DR2及 DR3组低于 DR1组(均P<0.05),见 Fig 1。
3.4肾组织PCX蛋白的表达8周末,免疫组化显示NC组肾小球PCX为棕黄色颗粒状沿肾小球外周毛细血管袢呈强阳性分布。各糖尿病组肾小球PCX表现为分布不均,甚至部分消失,累积吸光度(IOD)较NC组明显下降(P<0.05),模型组最低,DR1、DR2及DR3组均明显高于模型组(P<0.05),且DR2及DR3组高于DR1组(P<0.05)。见Fig 2。

Fig 1 The tissues pathological change of the five groups observed by electron microscope(×20 000)
Tab 1 Comparison of the levels of UPCR,UACR,URCR,BG,HbA1C,KI,SCr,BUN,TG,TC,HDL-C,LDL-C,FDFR and GBMT among five groups(±s,n=8)

Tab 1 Comparison of the levels of UPCR,UACR,URCR,BG,HbA1C,KI,SCr,BUN,TG,TC,HDL-C,LDL-C,FDFR and GBMT among five groups(±s,n=8)
NC:normal control;DM:diabetic model group;DR1,DR2,DR3:10,20,30 mg·kg-1·d-1pioglitazone.*P <0.05,**P <0.01 vs NC group at the same time point;#P <0.01,##P <0.05 vs DM group at the same time point
Parameter Time/wk NC DM DR1 DR2 DR3 BG/mmol·L-1 0 3.95 ±0.64 19.79 ±1.75** 20.03 ±2.33** 20.14 ±2.24** 19.91 ±2.11**8 4.00 ±0.77 21.76 ±1.57** 22.26 ±2.02** 21.96 ±2.10** 21.83 ±1.89**HbA1c/% 8 3.80 ±0.57 11.07 ±1.55** 10.55 ±1.24** 10.54 ±1.43** 10.49 ±1.10**SCr/μmol·L-1 8 55.10 ±8.04 106.50 ±16.20** 93.18 ±13.06** 93.67 ±17.28** 98.30 ±13.64**BUN/mmol·L-1 8 2.96 ±0.49 10.01 ±1.52** 8.12 ±1.02**## 7.80 ±1.28**## 7.16 ±0.88**##TG/mmol·L-1 8 1.11 ±0.21 1.74 ±0.24** 1.43 ±0.35*# 1.43 ±0.10*# 1.41 ±0.39*#TC/mmol·L -1 8 1.25 ±0.27 1.57 ±0.35 1.55 ±0.29 1.53 ±0.39 1.48 ±0.35 HDL-C/mmol·L-1 8 1.24 ±0.22 0.71 ±0.11** 0.85 ±0.14** 0.93 ±0.23**# 0.93 ±0.27**#LDL-C/mmol·L-1 8 0.73 ±0.12 1.28 ±0.23** 1.12 ±0.25** 1.16 ±0.17** 1.09 ±0.18**
Tab 2 Comparison of the levels of UPCR,UACR,URCR,BG,HbA1C,KI,SCr,BUN,TG,TC,HDL-C,LDL-C,FDFR and GBMT among five groups(±s,n=8)
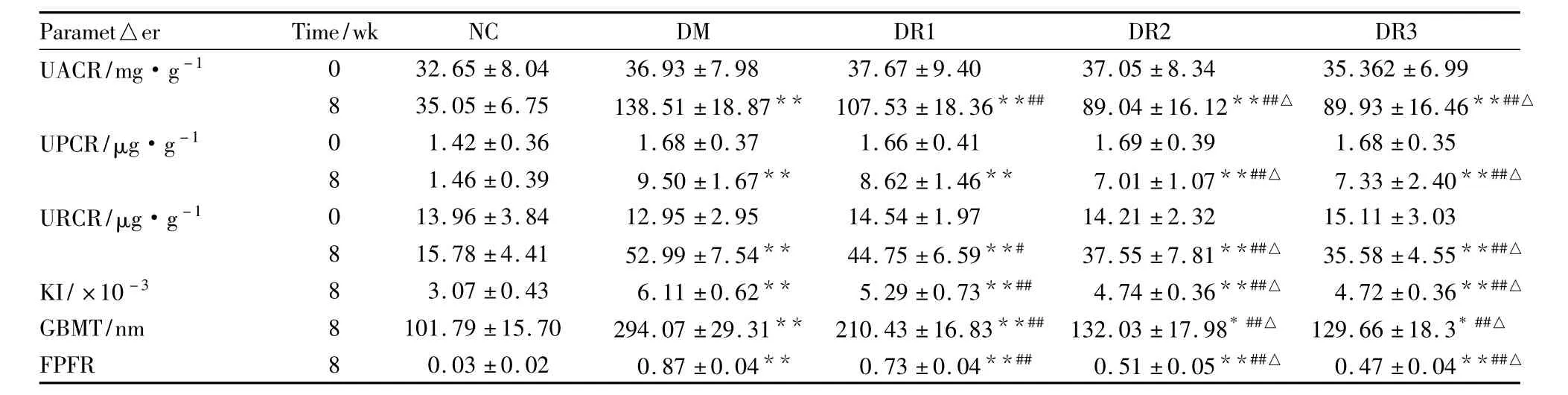
Tab 2 Comparison of the levels of UPCR,UACR,URCR,BG,HbA1C,KI,SCr,BUN,TG,TC,HDL-C,LDL-C,FDFR and GBMT among five groups(±s,n=8)
*P <0.05,**P <0.01 vs NC group at the same time point;#P <0.05,##P<0.01 vs DM group at the same time point;△P <0.05 vs DR1 group at the same time point
UACR/mg·g-1 0 32.65 ±8.04 36.93 ±7.98 37.67 ±9.40 37.05 ±8.34 35.362 ±6.99 8 35.05 ±6.75 138.51 ±18.87** 107.53 ±18.36**## 89.04 ±16.12**##△ 89.93 ±16.46**##△UPCR/μg·g-1 0 1.42 ±0.36 1.68 ±0.37 1.66 ±0.41 1.69 ±0.39 1.68 ±0.35 8 1.46 ±0.39 9.50 ±1.67** 8.62 ±1.46** 7.01 ±1.07**##△ 7.33 ±2.40**##△URCR/μg·g-1 0 13.96 ±3.84 12.95 ±2.95 14.54 ±1.97 14.21 ±2.32 15.11 ±3.03 8 15.78 ±4.41 52.99 ±7.54** 44.75 ±6.59**# 37.55 ±7.81**##△ 35.58 ±4.55**##△KI/×10-3 8 3.07 ±0.43 6.11 ±0.62** 5.29 ±0.73**## 4.74 ±0.36**##△ 4.72 ±0.36**##△GBMT/nm 8 101.79 ±15.70 294.07 ±29.31** 210.43 ±16.83**## 132.03 ±17.98*##△ 129.66 ±18.3*##△FPFR 8 0.03 ±0.02 0.87 ±0.04** 0.73 ±0.04**## 0.51 ±0.05**##△ 0.47 ±0.04**##△

Fig 2 Comparison of expression of PCX protein among the five groups(Immunohistochemistry×400)
3.5肾皮质PCX mRNA的表达8周末,与模型组比较,DR1、DR2、DR3组PCX mRNA均较模型组升高(P<0.05),但低于NC组(P<0.05),各 PIO组间差异无统计学意义。见Fig 3。
3.6相关分析UPCR与UACR和KI呈正相关(r=0.86,r=0.83,P<0.01)。
4 讨论
PPAR-γ作为核受体超家族成员,是一类由配体激活的转录因子,TZDs-吡格列酮作为PPAR-γ受体的高选择性、强效激动剂,两者结合后可激活PPAR-γ通路,提高胰岛素敏感性和改善脂肪代谢。近来一些研究报道TZDs-吡格列酮在改善代谢紊乱、提高胰岛素敏感性的同时,可降低尿白蛋白排泄,对DN发生发展有较好的防治作用,其确切的机制目前尚未阐明。本研究结果显示STZ诱导的糖尿病大鼠8周末尿白蛋白(反映肾小球病变)和视黄醇结合蛋白(反映肾小管-间质损害)排泄明显增多。与模型组比较,吡格列酮干预治疗8周后UACR及URCR均明显降低,同时肾脏肥大指数及病理指标(基底膜厚度和足突融合率)明显降低,中高剂量组优于低剂量组,但中、高剂量组间差异无显著性,进一步证实了TZDs对肾脏的保护作用并具有一定的剂量依赖性。吡格列酮组与模型组血糖及HbA1c水平差异无统计学意义,提示吡格列酮的肾脏保护作用不依赖于血糖的降低,与文献报道一致[4-5]。临床观察显示糖尿病患者常合并脂代谢紊乱,吡格列酮干预治疗可明显改善脂代谢[6]。我们的研究显示,8周末各组糖尿病大鼠TG,LDL-C升高,HDL-C下降,与文献报道一致[7]。吡格列酮组TG水平较模型组明显下降,并且发现中高剂量干预可明显抑制HDL-C水平的降低。低剂量组HDL-C虽较模型组有所升高,但差异无统计学意义,提示吡格列酮在改善高脂血症方面的作用可能存在一定的剂量依赖性。对此尚待进一步延长观察时间,并扩大样本量深入研究。

Fig 3 Comparison of expression of PCX mRNA among the five groups by RT-PCR
目前研究认为TZDs的肾脏保护作用部分可能与其对肾小球足细胞的保护有关[8-9]。PCX作为足细胞的标志蛋白,是一种CD34相关性唾液酸糖蛋白,参与维持足细胞的正常结构及滤过膜电荷屏障。PCX基因敲除的大鼠无法形成足突[10]。Hara等[11]研究证实足细胞损伤后,尿沉渣中PCX含量增加。本研究显示糖尿病大鼠8周末肾组织PCX蛋白和mRNA表达较正常对照组明显降低,尿PCX排泄增加,且尿PCX与尿白蛋白呈正相关,提示足细胞损害参与蛋白尿及糖尿病肾小球硬化的发生。进一步观察显示,各吡格列酮组8周末肾组织PCX蛋白及mRNA表达明显高于模型组,尿PCX排泄明显降低(DR2及DR3组尿PCX排泄明显减低,DR1组虽低于模型组但差异无统计学意义),提示早期吡格列酮干预可抑制糖尿病大鼠肾小球PCX蛋白及mRNA表达的下调,抑制大鼠PCX经尿的排泄,且中、高剂量组优于低剂量组,而中、高剂量组间差异无统计学意义,进一步证实这一作用具有一定的剂量依赖性,20 mg·(kg·d)-1吡格列酮可使 PPARγ 结合位点充分饱和,再增高剂量不能进一步提高治疗效果。有关吡格列酮抑制PCX表达下调,保护足细胞的机制尚未明确。体外研究发现[12]高糖可经ERK1/2通路下调小鼠肾小球足细胞PCX蛋白的表达;PPAR-γ激动剂[13]可抑制AT1受体表达和AngⅡ介导的信号通路,阻断RAS系统的活化并保护足细胞。Miyata等[14]报道吡格列酮可通过抑制终末糖基化产物的生成发挥肾脏保护作用。另外,体内及体外实验均证实了吡格列酮的抗炎作用[15-16]。Miglio等[17]报道吡格列酮可下调减少TGF-β的表达,并减少足细胞的凋亡,抑制高糖诱导的足细胞肥大[18]。Toblli等[5]研究还证实吡格列酮可通过抗氧化应激及抗炎来延缓糖尿病大鼠肾纤维化。上述研究显示,吡格列酮可能通过多种途径来保护糖尿病肾病,其确切机制尚待进一步研究。
本研究在为期8周的观察中发现,与模型组比较,低剂量吡格列酮组尿PCX排泄轻度降低,但差异无统计学意义,可能与研究周期偏短有关,有待进一步延长观察时间。
总之,我们的研究初步证实吡格列酮可明显降低足细胞标志蛋白PCX随尿排泄,抑制肾组织PCX蛋白及mRNA表达的下调,这一肾脏保护作用具有一定的剂量依赖性,其确切机制尚待进一步探讨。
[1]Sarafidis P A,Stafylas P C,Georgianos P I,et al.Effect of thiazolidinediones on albuminuria and proteinuria in diabetes:a meta-analysis[J].Am J Kidney Dis,2010,55(5):835 -47.
[2]Hu Y Y,Ye S D,Zhao L L,et al.Hydrochloride pioglitazone decreases urinary cytokines excretion in type 2 diabetes[J].Clin Endocrinol(Oxf),2010,73(6):739 -43.
[3]Kanno K,Kawachi H,Uchida Y,et al.Urinary sediment podocalyxin in children with glomerular diseases[J].Nephron ClinPract,2003,95(3):c91 -9.
[4]Ohga S,Shikata K,Yozai K,et al.Thiazolidinedione ameliorates renal injury in experimental diabetic rats through anti-inflammatory effects mediated by inhibition of NF-kappaB activation[J].Am J Physiol Renal Physiol,2007,292(4):F1141 -50.
[5]Toblli J E,Ferrini M G,Cao G,et al.Antifibrotic effects of pioglitazone on the kidney in a rat model of type 2 diabetes mellitus[J].Nephrol Dial Transplant,2009,24(8):2384 -91.
[6]Vergès B.Effects of glitazones in the treatment of diabetes and/or hyperlipidaemia:glycaemic control and plasma lipid levels[J].Fundam Clin Pharmacol,2007,21(Suppl 2):15 -8.
[7]Miyazaki Y,DeFronzo R A.Rosiglitazone and pioglitazone similarly improve insulin sensitivity and secretion,glucose tolerance and adipocytokines in type 2 diabetic patients[J].Diabetes Obes Metab,2008,10(12):1204 -11.
[8]Wang G,Lai F M,Lai K B,et al.Urinary messenger RNA expression of podocyte-associated molecules in patients with diabetic nephropathy treated by angiotensin-converting enzyme inhibitor and angiotensin receptor blocker[J].Eur J Endocrinol,2008,158(3):317-22.
[9]Nakamura T,Ushiyama C,Osada S,et al.Pioglitazone reduces urinary podocyte excretion in type 2 diabetes patients with microalbuminuria[J].Metabolism,2001,50(10):1193 - 6.
[10]Doyonnas R,Kershaw D B,Duhme C,et al.Anuria,omphalocele,and perinatal lethality in mice lacking the CD34-related protein podocalyxin[J].J Exp Med,2001,194(1):13 - 27.
[11]Hara M,Yanagihara T,Kihara I,et al.Apical cell membranes are shed into urine from injured podocytes:a novel phenomenon of podocyte injury[J].J Am Soc Nephrol,2005,16(2):408 -16.
[12]祁 佳,肖跃飞,张冬娟,等.高糖引起小鼠肾小球足细胞podocalyxin蛋白的表达下调[J].北京大学学报(医学版),2007,39(2):167-70.
[12]Qi J,Xiao Y F,Zhang D J,et al.High glucose downregulates the expression of podocalyxin protein in glomerular podocytes of mice[J].J Peking Univ(Health Sci),2007,39(2):167 -70.
[13]Sugawara A,Uruno A,Kudo M,et al.Effects of PPARγ on hypertension,atherosclerosis,and chronic kidney disease[J].Endocr J,2010,57(10):847 -52.
[14]Miyata T,Izuhara Y.Inhibition of advanced glycation end products:an implicit goal in clinical medicine for the treatment of diabetic nephropathy[J]?Ann N Y Acad Sci,2008,1126:141 -6.
[15]Ye S,Zheng M,Hu Y,et al.Hydrochloride pioglitazone decreases urinary monocyte chemoattractant protein-1 excretion in type 2 diabetics[J].Diabetes Res Clin Pract,2010,88(3):247 -51.
[16]隋海娟,金 英,潘月星,等.吡格列酮对脂多糖诱导的星形胶质细胞炎性细胞因子释放的影响[J].中国药理学通报,2010,26(9):1226-30.
[16]Sui H J,Jin Y,Pan Y X,et al.Effects of pioglitazone on the cultured cortical astrocytes induced by lipopolysaccharide expressions of inflammatory cytokines[J].Chin Pharmacol Bull,2010,26(9):1226-30.
[17]Miglio G,Rosa A C,Rattazzi L,et al.The subtypes of peroxisome proliferator-activated receptors expressed by human podocytes and their role in decreasing podocyte injury[J].Br J Pharmacol,2011,162(1):111 -25.
[18]Okada T,Wada J,Hida K,et al.Thiazolidinediones ameliorate diabetic nephropathy via cell cycle-dependent mechanisms[J].Diabetes,2006,55(6):1666 -77.

