脂质相关膜蛋白体外诱导hBD-2基因表达的研究
陈 芸,刘晓健,赵松兰
(江苏大学附属人民医院妇产科,江苏镇江,212000)
近年研究发现,解脲支原体(UU)是女性生殖器感染的重要致病因子,妊娠尤其是晚期妊娠妇女的生理变化有助于UU生长,UU感染可导致胎膜早破(PROM)、早产、胎儿宫内感染、孕妇产褥期感染等。本研究探讨 UU感染的致病因素脂质相关膜蛋白(LAMPs)刺激绒毛膜细胞与胎盘滋养细胞产生的hBD-2表达的关系。
1 材料与方法
1.1 冻干UU3标准株
由中心实验室提供。
1.2 支原体培养
购自珠海丽珠试剂公司。取解脲支原体菌液按1∶10比例接种于固体培养基,在95%CO2、37℃恒温培养箱中培养,当培养基颜色由玫瑰红色转变为橙色(2~4周)后,表示UU已生长至对数期。传代2~3次后提取其LAMPs。
1.3 LAMPs提取
LAMPs的提取按照有关参考文献的方法进行。500 mL生长至对数期的UU培养液于无菌离心管中14 000 r/min离心20 min,弃上清,沉渣经PBS洗涤(共洗涤2次),14 000 r/min离心。所得Mg沉渣重悬浮于5 mL含有1 mmol/L EDTA的Tri缓冲盐液(TBS,50 mmol/L T ris pH 8.0,0.15 mol/L NaCL)当中(TBSE)。随后加入Triton X-114,使其终浓度为2%,4℃静置1 h,然后置入37℃水浴箱中孵育10 min使其发生相分离。弃去上层水相,加入等体积TBSE,重复相分离过程1次。第2次相分离结束,弃去水相,再加入等体积TBSE恢复至最初体积。最后加入2.5倍体积无水乙醇,-20℃过夜以沉淀LAMPs。次日于14 000 r/min离心20 min,弃上清,PBS重悬浮LAMPs,超声处理1~3 min。BCA测定蛋白浓度后置于-80℃备用。LAMPs在使用前用100 μ g/mL多黏菌素B处理 2 h,以去除提取过程中可能存在的内毒素污染。
1.4 实验标本
取自健康的足月妊娠剖宫产妇女及 UU感染足月妊娠剖宫产妇女各10例,均由江苏大学附属人民医院产科提供。标本采集常规消毒外阴、阴道,以无菌窥器暴露宫颈,以无菌棉球将宫颈揩干净,再以无菌试子插入宫颈内1~2 cm,旋转数周后停留半分钟取出,置培养试管中立即送检。将采集标本接种于固体培养基,在95%CO2、37℃恒温培养箱中培养,当培养基颜色由玫瑰红色转变为橙色者为阳性;培养基未见颜色变化为阴性。
晚孕蜕膜组织及胎盘组织所有标本均于剖宫产后按无菌程序操作获取,标本离体后迅速快送实验室。
蜕膜上皮培养分离纯化:蜕膜条件培养液的制备改进陈晓等的方法[14],术中无菌瓶收集标本,置于盛有100 mg/mL链霉素和100 U/mL青霉素的冰生理盐水中,即刻送进实验室。挑取较厚实的底蜕膜组织,在冰生理盐水中反复吹洗,清除血污。取小片组织剪碎成糊状(约1 m3大小),加入0.83%NH4Cl进一步破除红细胞。再加入冰生理盐水反复清洗组织悬液数次,待上清清亮为止。称取剪切清洗后的蜕膜组织(湿重)300 mg,均匀接种于培养瓶,4 h后加入含10%小牛血清的RPMI 1640完全培养液,次日换成无血清RPMI 1640培养5 mL,收集48 h后的培养上清,4℃,12 000 r/min离心,无菌过滤,-70℃冻干备用。
胎盘滋养细胞的分离:①将收集的胎盘组织置于DMEM中充分洗涤3次,仔细去除蜕膜及绒毛基质,将剩余组织剪碎至1 mm3左右。②加入0.125%胰蛋白酶液十37℃水浴中消化约3 0 min(不予摇晃)。期间隔5 min吸少量消化液镜下监测,适时终止消化。③收集上清液并加10%小牛血清终止消化,100 μ m孔径金属筛网过滤,300 g离心10 min。④调整细胞密度为6~8×105/mL,种植于MetrigeL包被(MetrigeL:DMEM=1∶2)的塑料培养板或盖玻片上。
1.5 培养条件
培养液为高糖型条件下培养24 h,DMEM,加入20%胎牛血清,pH值7.0~7.2,于37℃,5%C02除去未贴壁细胞并换入新鲜培养液。以后每日更换培养液。
传代培养待原代的细胞80%汇合后,弃去培养液,用PBS洗1次,加入1∶1的 0.25%胰蛋白酶:0.02%EDTA(Na)溶液,于37℃消化5~15 min,再加入含20%血清的培养液终止消化,1 000 r/min离心8 min,吹打成单细胞,以1.0×105/mL接种于新的培养皿培养。传代细胞约24 h可贴壁,5~7 d后约有80%聚集长满。
1.6 LAMPS刺激试验
LAMPS刺激前,蜕膜上皮细胞及胎盘滋养细胞分别800 rpm离心5 min,弃去培养液,无菌PBS洗涤后,用含有1%FBS的RPMI-1640培养液于细胞培养板6孔板中调整其密度为5×105/mL,37℃,5%CO2培养24 h,随后于每孔细胞加入 不同浓度(0 、0.1、1 、2、3 μ g/L)的LAMPS加以刺激,1.5~3 h提取细胞总 RNA,刺激2~4 h提取细胞胞质蛋白,每个实验均重复。
1.7 RT-PCR检测hBD-2 mRMA表达
上皮细胞总RNA的提取采用上海飞捷生物公司的总RNA极速抽提试剂盒,按其说明进行。最后用尤RNA酶去离子水溶解RNA沉淀,-70℃保存备用。
引物设计根据Genbank hBD-2cDNA序列(登录号为NM-004942.2),设计特经检查扩增片段均跨跃内含子hBD-2跨内含子引物:上游5′-CCAGCCATCAGCCATGAGGGT-3′,下游 5′-GGAGCCCTTTCTGAATCCGCA-3′,产物长255 bp,符合内参照,扩增片长度为RT-PCR要求,同时用PCR试剂盒里看家基因GAPDH引物为544 bp。
RT-PCR扩增:①RT:取等量(约 2 μ g)总RNA,1 μ L 随机引物,dNTP 0.5 mmoL/L,总体积20 μ L,按照RT-PCR试剂盒说明操作。②引物稀释按引物浓度(mmol/L)=[引物量(mg)/分子量]/体积(L),稀释引物,使引物终浓度为25 μ mol/L,-20℃保存。③参照《基因扩增临床检验指南》[15],PCR循环条件如下:95℃,变性5 min;94℃60 s,62℃30 s,72℃120 s共35个循环,72 ℃延伸5 min,取5 μ L扩增液加1 μ L溴酚蓝于2%琼脂糖凝胶电泳,电压50 V,电泳40 min,凝胶紫外线下观察结果,并摄相。
取诱导因素刺激过的细胞提取总蛋白,测定蛋白质浓度采用Bradford法,采用SDS-T ricine-PAGE电泳[16-19]hBD-2蛋白,电转印后Western bLotting检测,出现条带后,自来水冲洗,观察、照相。
免疫细胞化学检测hBD-2表达用兔抗人hBD-2多克隆抗体(一抗)作免疫细胞化学检测,二抗为山羊抗兔IgG。
2 实验结果
不同浓度的 LAMPs(0.1~3.0 μ g/mL)能明显诱导蜕膜上皮细胞及胎盘滋养细胞产生hBD-2,且HBD-2 mRNA表达与 LAMPs呈明显的剂量依赖性。
相同浓度的LAMPS刺激蜕膜上皮细胞及胎盘滋养细胞,HBD-2 mRNA表达呈现出时间依赖性。
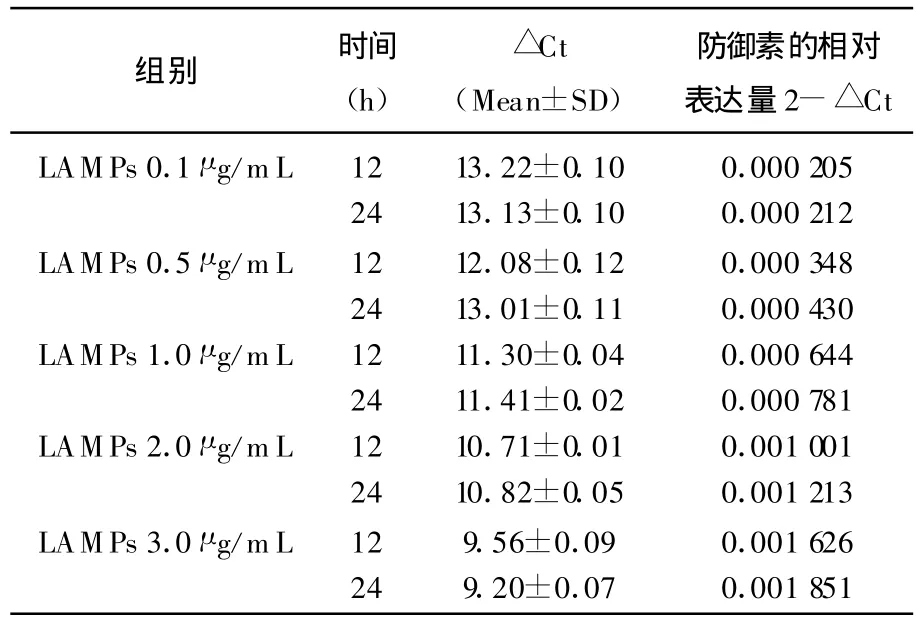
表1 添加不同浓度LAMPs对绒毛膜细胞sBD-2基因表达的影响
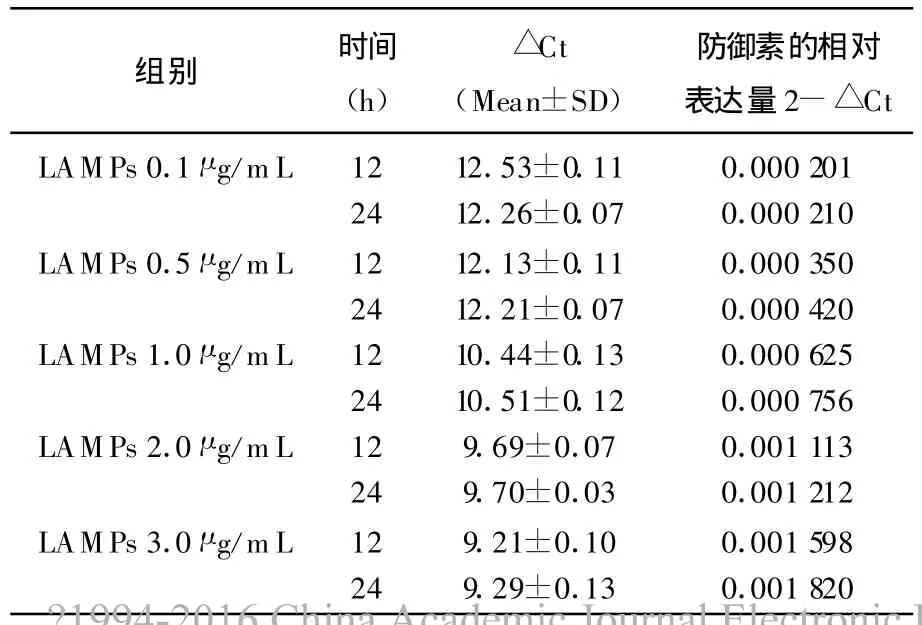
表2 添加不同浓度LAMPs对胎盘滋养细胞sBD-2基因表达的影响
LAMPs与细胞内sBD-2基因相对表达量的关系,用SPSS12.0统计软件分析表中数据,在P<0.05水平下,添加不同浓度SPSS12.0,sBD-2基因的相对表达量均有显著差异,其中添加LAMPs 3 μ g/mL 与 LAMPs 0.1 μ g/mL 之间差异极显著,其他浓度与对照组之间差异均显著,而且2个不同培养时间之间略有差异,此外每个浓度的2个重复之间也略有差异。结果表明在较低的浓度下,LAMPs浓度与sBD-2基因相对表达量变化基本呈正相关。
HBD-2 mRNA在正常产妇蜕膜及胎盘组织中表达量较低,而在UU感染的产妇蜕膜及胎盘组织中表达量明显升高。
HBD-2的RT-PCR及琼脂糖凝胶电泳结果显示10例UU感染组及10例正常对照组均获得预期的137 bp阳性片段,UU感染组HBD-2/β-actin辉度相对值为(0.63±0.09),而对照组HBD-2/β-actin辉度相对值(0.17±0.15),有统计学差异。
3 讨 论
经典的支原体细胞膜由脂质双层和膜蛋白组成,其中膜蛋白可分为2类:一类为膜本体蛋白,另一类外周膜蛋白。膜本体蛋白和外周膜蛋白统称为脂质相关膜蛋白(LAMPS),是暴露在表面与周围环境各种成分不断相互作用因是影响机体免疫系统的一种主要蛋白[1]。该膜蛋可能是介导支原体黏附宿主细胞表面,进入侵宿主细胞导致细胞受损与死亡的物质基础[2]。因此对支原体LAMPS的研究是了解支原体入侵宿主后与宿主免疫系统相互作用的关键。
孕期UU感染与胎膜早破密切相关[3],而支原体感染者发生胎膜早破是正常分娩者的8倍[4]。孕妇宫内感染UU造成绒毛受损,最终导致妊娠终止,其机制可能与UU产生的磷脂酶A、C促使细胞膜中游离的花生四烯酸释放,而花生四烯酸是前列腺素的必需前体物质,能损伤胚胎组织及其附属物而影响妊娠结局[5]。实验证实UU产生的高分子质量物质能刺激宿主免疫活性细胞产生释放多种细胞因子而造成早孕蜕膜的局部免疫损伤[6]。
防御素是一类分质量约为4.0~5.0 kMr,含有6个半肤氨酸残基、二对二硫键的阳离子多肽。防御素不仅通过直接杀菌作用抵御入侵机体的病原微生物,还在介导获得性免疫反应、调节机体的免疫炎症反应和创伤修复过程中起着重要作用[7-8]。防御素2是人体中第1个被发现的可诱导性防御素,在正常女性阴道、子宫颈、子宫内膜、输卵管、卵巢等5个组织中均有HBD-2 mRNA表达,HBD-2 mRNA在绒毛膜、绒毛及胎盘组织中表达[9]。防御素2在正常妇女生殖道及妊娠相关组织中广泛表达,提示防御素2的基因表达调控、生物学活性对于维系正常妇女及孕妇生殖道内环境稳定、宿主天然抗感染机制中起着重要的作用。另有作者提出胎膜的作用不仅是单纯的机械阻挡作用,在体外胎膜有明显的抗菌活性,在多种细菌培养皿上,胎膜覆盖的下方及周围均有明显的抑菌圈产生,而作为对照的载薄片无此效应[10]。推测胎膜的这种作用可能与防御素的产生有关。宫颈粘液具有强大而广谱的抗菌活性,防御素在子宫颈组织中固有表达,可能是子宫颈抗感染作用的重要介质[11]。
β-防御素毫摩尔浓度时具有杀伤细菌的能力,纳摩尔浓度时就具有趋化活性。β-防御素具有间接的免疫启动作用,其可能作为不成熟树突状细胞和记忆T细胞的趋化因子,成为先天免疫和后天免疫系统连接的桥梁。在较低的分子浓度下,β-防御素能够与这些细胞表面特异性的趋化因子受CCR6相结合,趋化这些细胞朝着受致病微生物侵袭的皮肤或粘膜病灶部位迁移,从而提高机体抵抗微生物感染的获得性免疫反应水平。Becker[12]等对LPS诱导hBD2表达,启动机体固有免疫的信号途径进行了研究,发现LPS需要一种CD14依赖途径启动人支气管上皮(hTBE)细胞合成和分泌hBD2,并最终激活NF-κ Bo由此可见,β-防御素在机体抗微生物入侵的固有性免疫和获得性免疫中均具有重要作用,防御素作为信号分子在浓度很低时不能直接杀死致病微生物时却能产生生物学效应。
本实验发现β-防御素-2在正常产妇蜕膜及胎盘组织中表达量较低,而在 Uu感染的产妇蜕膜及胎盘组织中表达量明显升高,2者有明显差异。用不同浓度的LAMPS刺激蜕膜上皮细胞与胎盘滋养细胞产生的hBD-2表达量不一样,当LAMPS的浓度从 0.1~3 μ g/mL,所产生的hBD-2的量逐渐增大,当浓度增加到3 μ g/mL时,所产生的hBD-2量最大,HBD-2 mRNA表达呈现浓度依赖性。相同浓度的LAMPS刺激蜕膜上皮细胞及胎盘滋养细胞,HBD-2 mRNA表达呈现出时间依赖性。Ganz等[13]在纯化的防御素对人及小鼠肿瘤的作用中发现,防御素能杀伤多种肿瘤细胞,特别是对抗肿瘤坏死因子的细胞系和抗NK细胞毒因子的细胞系。它能和靶细胞膜结合,引起细胞骨架易位,从而灭活靶细胞;同时还发现其活性由微丝、钙调节蛋白和溶酶体调节,裂解作用呈剂量和时间依赖性。
[1]Baseman J B,Reddy S P,DaLLo S F,et al.InterpLay between mycopLasma surface proteins,airwan ceLLs,and the protean manifestations of mycopLasma-mediated human infections[J].Am J Respir Crit Care Med,1996,154:137.
[2]Davis K L,Wise K S.Site-specific proteoLysis of the MALP-404 Lipoproteindetermines the reLease of a soLubLe seLective Lipoprotein-associated motif-containing fragment and aLteration of the surface phenotype of MycopLasma fermentans[J].Infect Immun,2002,70(3):1129.
[3]林 娟,翁云钦,郑巧玲,等.504例妊娠妇女性传播感染疾病相关行为分析[J].中国妇幼保健杂志,2005,20(3):3587.
[4]乐 杰.妇产科学[M].第5版.北京:人民卫生出版社,2000:164.
[5]TayLor-Robinson D,Furr P M.Observationson experimentaL coLonisation of ice by ureapLasmas of human origin[J].J Med MicrobioL,2002,51:866.
[6]王敬云,刘 杰.支原体感染与妊娠[J].中国实用妇科与产科杂志,2001,17(12):713.
[7]YA N G D,B IRA GYN A,HOO V ER D M,et al.M uL-tipLe roLes of antinicrobial defensins,cathelicidins,and eosinophil-derived neurotoxinin host defense[J].Annu Rev InmunoL,2004,22:181.
[8]Pazgier M,Hoover D M,Yang D,et al.Human beta-defensins[J].CeLL M of Le Sci,2006,63:1 294.
[9]冯 艳,潘小玲,黄 宁,等.女性生殖道人Beta-防御素基因的表达[J].中国病理生理杂志,2003,19(11):1564.
[10]Kjaergaard N,Hein M,HytteL L,et al.AntibacteriaL properties of human amnion and chorion in vitro[J].Eur J Obstet GynecoL Rep rod B ioL,2001,94(2):2242229.
[11]陈新年,黄 宁,吴 琦,等.β-防御素-2基因在子宫颈的固有表达[J].中国病理生理志,1999,8(6):741.
[12]Becker M N,Diamond G,Verghese MW,et al.CD14-dependent LipopoLysaccharide-induced beta-Defensin-2 expression in human tracheobrochial epitheLium[J].J BioL Chem,2000,275(38):29731.
[13]ALan K L,Tomas Ganz,Theminh Ngvgen,et al.M echanism of target cytoLysis by peptide defensins:Target ceLL metaboLic activities,possibLy invoLving endocytosis,are cruciaL for expression of cytotoxicity[J].J immunoL,1998,146(15):2486.

