黄芩对大鼠体内甲苯磺丁脲药动学的影响
谭朝丹, 马越鸣, 石 荣, 陈莹蓉
(上海中医药大学中药药代动力学实验室,上海 201203)
黄芩对大鼠体内甲苯磺丁脲药动学的影响
谭朝丹, 马越鸣*, 石 荣, 陈莹蓉
(上海中医药大学中药药代动力学实验室,上海 201203)
目的 研究黄芩对甲苯磺丁脲药动学的影响。方法 大鼠12只,雌雄各半,随机分为两组,生理盐水组(NS组)和黄芩组(HQ组)。分别灌服生理盐水和等体积的黄芩水提物,0.5 h后灌胃给予甲苯磺丁脲50 mg/kg。采用HPLC-UV法检测甲苯磺丁脲及其代谢产物4-羟基甲苯磺丁脲的血浆浓度,计算药代动力学参数。结果 在雌性大鼠体内,NS组中甲苯磺丁脲及其代谢产物4-羟基甲苯磺丁脲的AUC0-t分别为(1 760±82)μg/(mL·h)和(18±2)μg/(mL·h),HQ
甲苯磺丁脲;黄芩;药动学;大鼠
中西药合理并用具有提高疗效、降低毒副作用、标本兼治等优越性,但是不合理的中西药物并用,将会导致药效降低或毒副反应增加,甚至死亡[1]。药物的相互作用分为药效学水平上的相互作用和药动学水平上的相互作用,后者是造成临床上药物相互作用的主要原因[1]。
糖尿病是仅次于心血管病、肿瘤而居于第三位的致死性疾病,预计到2025年,患者人数将达到3亿。中药黄芩是一种较常用的清热燥湿类中药,具有清热燥湿、泻火解毒、止血、安胎等药理作用[2]。现代研究表明,黄芩中的相关成分对糖尿病有一定治疗作用[3],黄芩苷胶囊[4-5]可明显抑制糖尿病患者醛糖还原酶活性,有利于早期糖尿病肾病的治疗以及缓解糖尿病周围神经病变的临床症状。诸多治疗消渴病的中药复方中含有黄芩,如泻心汤[6]等。磺酰脲类胰岛素促泌剂可直接作用于胰岛β细胞,刺激内源性胰岛素释放,由于其作用强、价格低廉等特点,在近半个世纪以来广泛应用于临床,目前仍然是治疗2型糖尿病的常用药物[7],但此类降糖药极易在老年患者中引发低血糖,表现为气阴两虚,所以常配合益气养阴类中药使用[8],而相当一部分此类中药复方中含有黄芩,如郭赛珊等[9-10]采用在西药治疗的基础上加用益气养阴的仙贞片(10 g黄芩/110 g生药),临床效果良好。某些临床试验也采用了磺酰脲类与黄芩联用的治疗方法。刘长山[11]在研究黄芩对糖尿病患者的治疗机制时,对照组采用常规治疗,使用磺酰脲类降糖药格列喹酮,治疗组则是在常规治疗上增加黄芩苷。姜森[12]采用磺酰脲类药物格列吡嗪等作基础对照组,治疗组加用三黄安消胶囊(由黄芩、黄连、人参等组成)治疗2型糖尿病合并胰岛素抵抗,结果说明西药加用三黄安消胶囊可更好的改善胰岛素抵抗。可见,临床上黄芩与磺酰脲类降糖药常联合用于治疗糖尿病及其并发症。已有相关报道表明黄芩中的有效成分如黄芩苷对鼠类CYP4501A1、2B1及2C11三种同功酶的活性有诱导作用[13],而大鼠体内的甲苯磺丁脲绝大部分通过2C11亚型进行4-羟化反应生成4-羟基甲苯磺丁脲而消除,失去药效(详见图1),两种药物联合使用是否会产生相互作用尚不清楚。本实验研究黄芩对磺酰脲类代表药物甲苯磺丁脲药动学的影响,为磺酰脲类降糖药的临床合理用药提供依据。
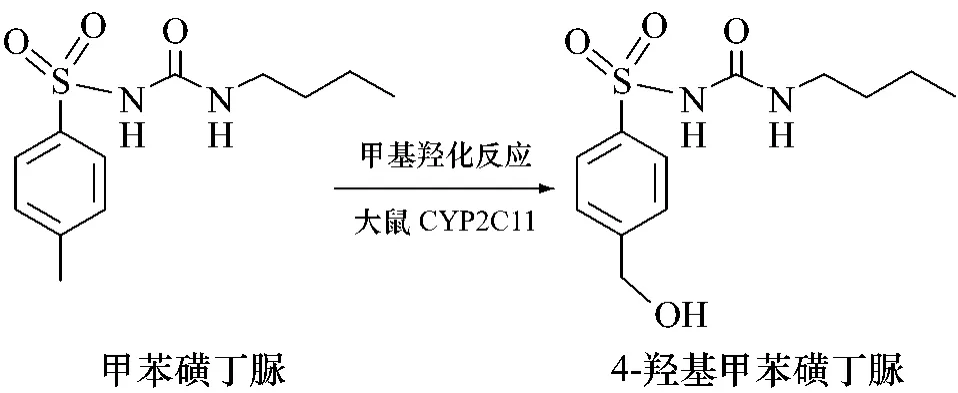
图1 甲苯磺丁脲在大鼠体内的代谢过程Fig.1 The metabolic process of tolbutamide in rats
1 材料
1.1 药品与试剂 甲苯磺丁脲(标准品),批号017K1025,购于Sigma公司;4-羟基甲苯磺丁脲(标准品),批号 Lot#1-PSB-27-2,购于 TRC;格列苯脲(化学对照品),批号100135-200404,购于中国药品生物制品检定所;黄芩(河北,批号080101),购自上海同济堂药业有限公司,经本校生药学赵志礼教授鉴定,按2010年药典方法进行测定,符合药典规定要求,黄芩水提物,228 g提取物/500 g生药,黄芩苷质量分数为(117.9 ± 2.8)mg/g生药;甲醇(色谱纯),批号 J1AG1H,购于 SK;磷酸(分析纯),批号Lot No 20080328,购自国药集团;CMC-Na(化学纯),批号F20070608,购自国药集团;生理盐水(NS),批号08072807,购自长富;实验用水为超纯水。
1.2 仪器 Waters Alliance高效液相色谱系统;Turbo Vap LV型氮吹仪(Caliper);USC-502超声波清洗器(上海波龙电子设备有限公司);XW-80A旋涡混合器(上海医科大学仪器厂);VXR B型自动涡旋器(IKA-WERKE);FA2004型分析天平(HANGPING);TGL-16G-A型高速冷冻离心机(上海安亭科学仪器厂)。
1.3 动物 清洁级SD大鼠,12只,雌雄各半,体质量200~230 g,上海中医药大学实验动物中心提供,合格证号:SCXK(沪)2003-2002。
2 方法
2.1 试药的配置 临用前,将黄芩水提物用NS配制成所需浓度,将甲苯磺丁脲用0.5%CMC-Na水溶液配制成所需浓度。
2.2 实验设计 将大鼠按体质量随机分为生理盐水组和黄芩组,每组6只,雌雄各半。灌服等体积的生理盐水和黄芩水液(2.4 g生药/kg体质量)。30 min后,灌服等量的甲苯磺丁脲(50 mg/kg体质量)。给予甲苯磺丁脲后 0.5、1、1.5、2、3、4、6、9、12、24、36 h眼球后静脉丛取血,肝素抗凝制备血浆,-20℃保存,待测定。
2.3 血浆中甲苯磺丁脲和4-羟基甲苯磺丁脲浓度的测定 血浆中甲苯磺丁脲及其代谢产物4-羟基甲苯磺丁脲测定在文献[14]方法基础上进行优化。
色谱条件:ZORBAX SB-C18色谱柱(5 μm,250 mm ×4.6 mm);流动相:0.1% 磷酸-甲醇梯度洗脱,0~18 min,甲醇 40% ~90%;18 ~19 min,甲醇90% ~40%;体积流量为1.0 mL/min。进样体积:30 μL。柱温:40℃。样品室温度:4℃。紫外检测波长:230 nm。
血浆样品处理:取血浆 50 μL,加入 150 μL 甲醇(含内标格列本脲,21 μg/mL),涡旋 5 min,离心(16 000 r/min,10 min),吸取上清液 100 μL,加入100 μL 水相,涡旋5 min,取上清30 μL 进样。
2.4 数据分析及统计检验 血浆中甲苯磺丁脲及4-羟基甲苯磺丁脲的峰面积与内标峰面积比值,由随行标准曲线计算出两者的血药浓度。采用DAS 2.0软件中统计矩法分析血药浓度-时间数据,计算药动学参数。并利用多因素方差分析以及t检验的方法进行统计分析。
3 结果
3.1 方法学考察
HPLC色谱图见图2。由图可见,血浆内源性物质不干扰甲苯磺丁脲、代谢产物4-羟基甲苯磺丁脲及内标格列苯脲的测定,方法具有较高的专属性。以甲苯磺丁脲、4-羟基甲苯磺丁脲与内标峰面积比值(y)对两者质量浓度(x,μg/mL)进行直线回归,回归方程分别为y=0.013 4x-0.001 9(r=0.999 8,n=5,w=1/c2),y=0.012 5x-0.000 3(r=0.999 8,n=5,w=1/c2)。结果表明甲苯磺丁脲、4-羟基甲苯磺丁脲分别在1~200 μg/mL和0.2-40 μg/mL的血浆质量浓度范围内线性关系良好;甲苯磺丁脲及4-羟基甲苯磺丁脲的相对回收率分别在95% ~103%和96% ~103%之间,日内精密度分别小于8.7%和6.4%,日间精密度分别小于7.2%和12.9%,绝对回收率均在100%左右,符合生物样品的检测要求。
3.2 方法学质控
在生物样品分析方法确证完成以后开始测定未知样品,同时进行质量控制。每个分析批生物样品测定时建立新的标准曲线,并进行三浓度双样本质控样品分析,并将质控样品相对回收率的RSD<15%作为当日数据是否接受的标准。结果表明质控符合要求。
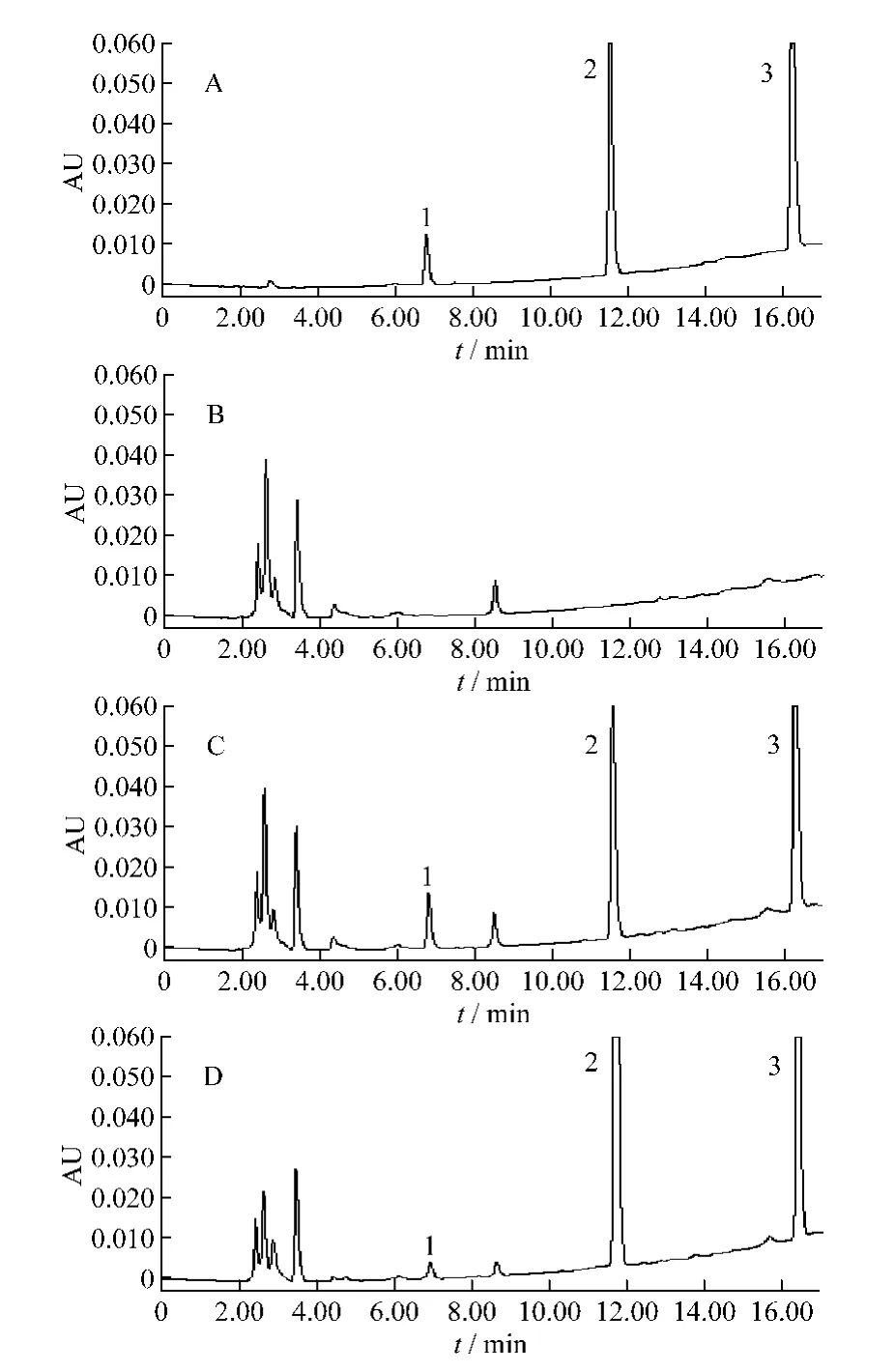
图2 甲苯磺丁脲和4-羟基甲苯磺丁脲的色谱图A.对照品(40 μg/mL甲苯磺丁脲,8 μg/mL 4-羟基甲苯磺丁脲)B.空白血浆 C.空白血浆加对照品(40 μg/mL甲苯磺丁脲,8 μg/mL 4-羟基甲苯磺丁脲)D.给药后血浆(灌胃给予50 mg/kg甲苯磺丁脲后3 h)1.4-羟基甲苯磺丁脲 2.甲苯磺丁脲 3.格列苯脲Fig.2 Chromatograms of tolbutamide and 4-HydroxytolbutamideA.standards(40 μg/mL tolbutamide,8 μg/mL 4-Hydroxytolbutamide)B.blank plasma C.blank plasma spiked with standards(40 μg/mL tolbutamide,8 μg/mL 4-Hydroxytolbutamide)D.plasma sample(3 h after ig administration of 50 mg/kg Tolbutamide)1.4-hydroxytolbutamide 2.tolbutamide 3.glibenclamide
3.3 血药浓度结果
大鼠灌服甲苯磺丁脲后甲苯磺丁脲及其代谢产物4-羟基甲苯磺丁脲的质量浓度-时间曲线见图3。甲苯磺丁脲在大鼠中的体内过程均符合口服一室模型。各组大鼠灌服甲苯磺丁脲30 min后,血中即可检测到较高质量浓度的甲苯磺丁脲,达峰时间基本在2~4 h之间。而4-羟基甲苯磺丁脲的血药浓度,远远低于其原形,在24 h时个别低于定量下限。三因素方差分析结果表明,甲苯磺丁脲的血药浓度性别和组别差异均具有统计学意义(P<0.05);在雌性大鼠体内,甲苯磺丁脲的浓度高于雄性大鼠(P<0.01),且黄芩组的浓度大于生理盐水组(P<0.01)。
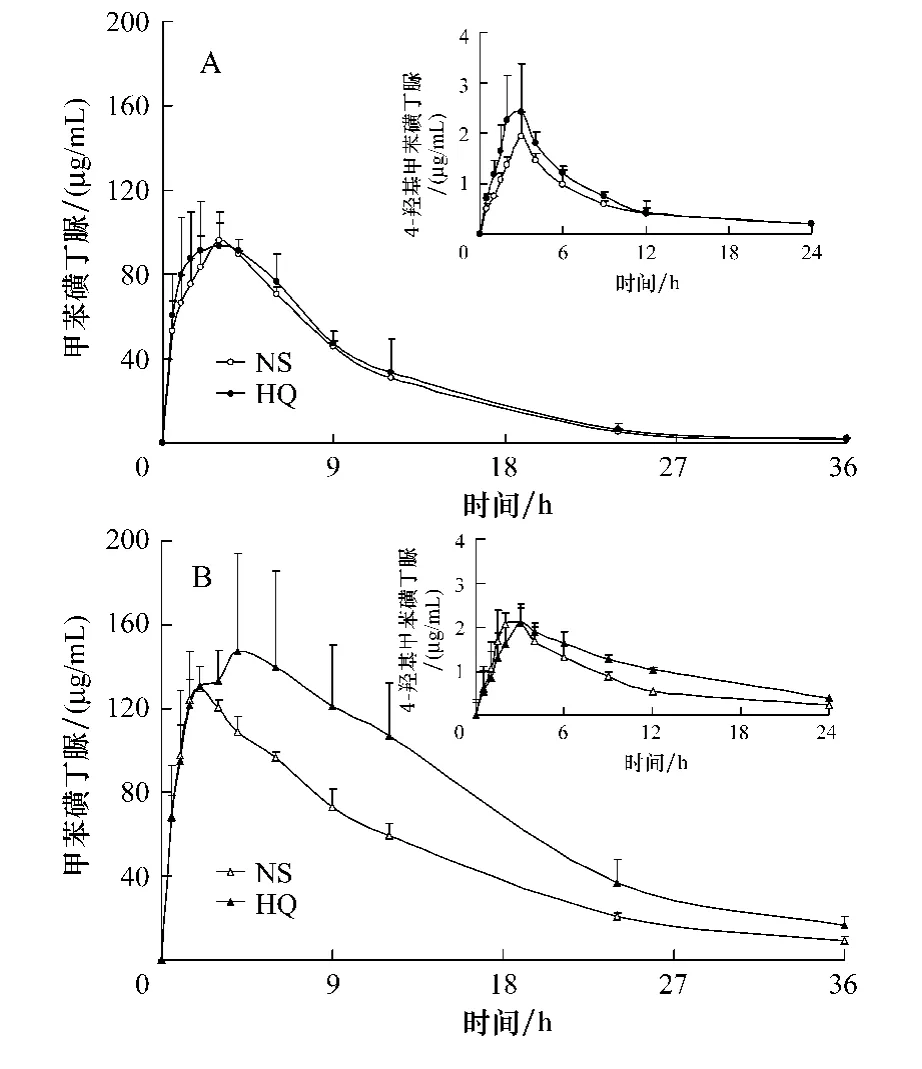
图3 黄芩干预下甲苯磺丁脲和4-羟基甲苯磺丁脲的血药浓度-时间曲线(±s,n=3)A.雄性 B.雌性 NS.生理盐水组 HQ.黄芩组Fig.3 The plasma concentration-time curves of tolbutamide(TB)and 4-Hydroxytolbutamide(TB-OH)after ig administration of tolbutamide in rats with or without the intervention of Scutellaria baicalensis(HQ)(±s,n=3)A.male B.female NS.normal saline HQ.scutellaria baicalensis
3.4 药动学参数结果
药代动力学参数见表1。性别和组别双因素方差分析结果表明,甲苯磺丁脲和4-羟基甲苯磺丁脲的AUC0-t存在显著的性别和组间差异,雌性大鼠高于雄性(P<0.01);在雌性大鼠体内,黄芩组甲苯磺丁脲的 AUC0-t高于生理盐水组(P<0.05,t检验),相对生物利用度约增加34.1%。双因素方差分析结果表明,甲苯磺丁脲的t1/2存在性别差异,雌性大鼠t1/2长于雄性(P<0.01)。雌雄分开后,不同组别t检验表明,甲苯磺丁脲的t1/2和 AUCTB/AUCTB-OH,在生理盐水组和黄芩组之间的差异均无统计学意义(P>0.05)。
4 讨论
本研究表明,黄芩对甲苯磺丁脲药动学的影响存在性别差异。而在雌性大鼠体内,给予黄芩后可使甲苯磺丁脲 AUC0-t升高约 34.1%(P<0.05),说明黄芩使甲苯磺丁脲在体内的总体暴露提高。临床上,在老年患者中磺酰脲类药物类降糖药易引发低血糖反应,表现为气阴两虚。因此,老年女性患者如果联用黄芩可能会导致磺酰脲类总体暴露的提高,很可能会加重低血糖反应。
表1 黄芩干预下甲苯磺丁脲及4-羟基甲苯磺丁脲的药动学参数(±s,n=3)Tab.1 Pharmacokinetic parameters of tolbutamide and 4-Hydrotolbutamide with or without the intervention of HQ(±s,n=3)

表1 黄芩干预下甲苯磺丁脲及4-羟基甲苯磺丁脲的药动学参数(±s,n=3)Tab.1 Pharmacokinetic parameters of tolbutamide and 4-Hydrotolbutamide with or without the intervention of HQ(±s,n=3)
TB:甲苯磺丁脲;TB-OH:4-羟基甲苯磺丁脲。与生理盐水组相比,*P<0.05。TB:Tolbutamide;TB-OH:4-Hydroxytolbutamide.*P <0.05 vs NS group.
参数 单位 雄性雌性生理盐水组 黄芩组 生理盐水组 黄芩组TB AUC0-∞ μg/(mL·h) 1020±90 1069±241 1890±78 2842±706*AUC0-t μg/(mL·h) 997±84 1041±229 1760±82 2360±298*Cmax μg/mL 97±6 102±14 133±16 158±34 tmax h 3.3 ±0.6 3.0 ±1.0 1.8 ±0.3 2.8 ±1.3 t1/2 h 5.2 ±0.6 5.4 ±0.8 8.7 ±0.8 9.4 ±0.9 Vd/F L/kg 0.37 ±0.03 0.37 ±0.04 0.33 ±0.04 0.25 ±0.08 Cl/F L/(h·kg) 0.050 ±0.005 0.049 ±0.013 0.026 ±0.001 0.018 ±0.004*TB-OH AUC0-∞ μg/(mL·h) 13±2 16±2 20±5 31±4*AUC0-t μg/(mL·h) 10±2 13±3 18±2 25±4 Cmax μg/mL 1.9 ±0.5 2 ±0.5 2.2 ±0.4 1.8 ±0.4 t1/2 h 3.6 ±0.1 3.0 ±1.7 5.6 ±0.8 8.6 ±1.8 TB/TB-OH AUC ratio - 94±20 81±30 102±29 96±26
联用黄芩导致雌性大鼠体内甲苯磺丁脲的总体暴露提高,这可能与药动学的某些环节相关。在人体内,甲苯磺丁脲经2C9代谢生成4-羟基甲苯磺丁脲,后者进一步经醛、醇脱氢酶作用转化为羧基甲苯磺丁脲,并排出体外[15],而磺酰脲类降糖药均在肝脏被此亚型肝药酶氧化生成羟基代谢产物从而消除[16]。另外,大鼠中代谢甲苯磺丁脲的相关亚型可能为 2C11[17],与人不同的是[15,17],大鼠体内的甲苯磺丁脲绝大部分通过此亚型进行4-羟化反应生成4-羟基甲苯磺丁脲而直接被代谢消除。而本次实验中,给予黄芩后甲苯磺丁脲与其代谢产物的AUC0-t的比值以及甲苯磺丁脲的t1/2均无显著的差异,说明在本实验中黄芩干预方式的条件下,黄芩可能对大鼠肝中相应亚型的活性影响不明显,黄芩对甲苯磺丁脲总体暴露提高的环节可能不在于消除环节。
对于磺酰脲类的胃肠道吸收机制,尚未有明确报道。代表药物甲苯磺丁脲[18-19]的 pKa为5.3,为弱酸性,水溶性较差,研究表明其在胃中也可以被吸收,可受胃内溶出以及胃排空速率影响,而与胃内pH关系不大。在小肠中的吸收机制可能与某些转运有机阴离子的转运体系有关,有人[20]通过caco-2实验发现pH以及能量对于磺酰脲类在肠道内的吸收有影响,有报道表明,小柴胡汤由于甘草相关成分对甲苯磺丁脲在胃中溶出度的影响而显示出抑制其吸收的效果[18],但是此复方可在甲苯磺丁脲吸收早期加速该过程[21],可能的机制是可促进此药在小肠壁的跨膜转运,这种转运需要能量的参与,而值得注意的是,小柴胡汤中含有黄芩,这有可能与本实验中黄芩提高雌性大鼠体内甲苯磺丁脲总体暴露的结果有一定的相关性。对于此种现象性别差异的原因尚不清楚。
本次实验结果发现单独给予大鼠甲苯磺丁脲时药动学存在性别差异,雄性大鼠体内甲苯磺丁脲消除更快。有研究报道大鼠体内的CYP2C11为雄性特异性的,即雄性的活性高于雌性[22]。甲苯磺丁脲在大鼠体内药动学上的性别差异与CYP2C11的性别差异有关。
5 结论
黄芩对甲苯磺丁脲药动学的影响存在性别差异。黄芩的干预状态下,甲苯磺丁脲在雌性大鼠体内的总体暴露有一定程度上的升高,而在雄性大鼠体内的影响无统计学意义。
[1]金玉琴,江照云.中成药与西药同服的利弊分析与药效探索[J].中国中药杂志,2008,33(20):2407-2409.
[2]黄兆胜.中药学[M].北京:人民卫生出版社,2002:79.
[3]陈 丽,刘晓城.关于黄芩对糖尿病防治作用的研究[J].国外医学中医中药分册,2001,23(6):323-326.
[4]张喜平,田 华,程琪辉.黄芩苷的药理作用研究现状[J].中国药理学通报,2003,19(11):1212-1215.
[5]冯友根,郭丽敏.黄芩苷防治糖尿病并发症的作用与临床应用[J].医学导报,2004,23(8):572-573.
[6]韩 超,潘竞锵,刘惠纯,等.泻心汤对正常和多种糖尿病模型动物的降血糖作用[J].中国实验方剂学杂志,2000,6(4):33-35.
[7]胡绍文,郭瑞林,童光焕.实用糖尿病学[M].北京:人民军医出版社,2003:160-166.
[8]梁东辉,黄国志.中西医结合治疗2型糖尿病的思路和方法[J].中国中医药信息杂志,2004,11(3):228.
[9]郭赛珊,陈玉碧,梁晓春,等.仙贞片对肾虚血瘀2型糖尿病患者红细胞SOD、血清LPO及血脂、血糖的影响[J].中医杂志,1995,36(5):291-293.
[10]潘明政,赛 珊,梁晓春,等.中药仙贞片对气阴两虚血瘀型糖尿病患者红细胞膜Na+-K+-ATP酶等的影响[J].中国中西医结合杂志,1997,17(1):13-16.
[11]刘长山,马丽丽,李 萍,等.黄芩苷对糖尿病患者红细胞醛糖还原酶活性及肾小球滤过率的影响[J].中国中药杂志,2001,26(9):632-633.
[12]姜 森.三黄安消胶囊治疗2型糖尿病及改善胰岛素抵抗作用的临床研究[J].新中医,2006,38(1):28-30.
[13]侯艳宁,程桂芳,朱秀媛.黄芩苷对小鼠肝细胞色素P450的选择性诱导[J].药学学报,2000,35(12):890-892.
[14]Gross A S,Bridge S,Shenfield G M.Pharmacokinetics of tolbutamide in ethic Chinese[J].Br J Clin Pharmacol,1999,47(2):151-156.
[15]Back D J,Sutcliffe F,Tjia JF.Tolbutamide as a model drug for the study of enzyme induction and enzyme inhibition in the rat[J].Br J Pharmac,1984,81:557-562.
[16]黄作君,黎月玲,黄 民.CYP2C9基因多态性与磺酰脲类降糖药代动力学相关性的研究进展[J].中国临床药理学与治疗学,2007,12(2):219-213.
[17]Matsunaga N,Nishijima T,Hattori K.et al.Application of the PKCYP-test to Predict the Amount ofin VivoCYP2C11 Using Tolbutamide as a Probe[J].Biol Pharm Bull,2001,24(11):1305-1310.
[18]Nishimura N,Naora K,Hirano H,et al.Changes in the Dissolution of Tolbutamide by a Traditional Chinese Medicine,Sho-saiko-to(Xiao Chaihu Tang)[J].Biol Pharm Bull,2001,24(4):409-413.
[19]Nishimura N,Naora K,Hirano H,et al.Effects of Sho-saiko-to(Xiaochaihu Tang),a Chinese Traditional Medicine,on the Gastric Function and Absorption of Tolbutamide in Rats[J].Pharmaceutical Soc Jpn,2001,121(2):153-159.
[20]Nishimura N,Naora K,Hirano H,et al.Transepithelial Permeation of Tolbutamide across the Human Intestinal Cell Line,Caco-2[J].Drug Metab Pharmacokin,2004,19(1):48-54.
[21]Nishimura N.Effects of Chinese Herbal Medicines on Intestinal Drug Absorption[J].Pharmaceutical Soc Jpn,2005,125(4):363-369.
[22]赵 阳,柳晓泉,钱之玉.药物代谢的性别差异[J].药学进展,2001,25(5):289-294.
Effect of Scutellaria baicalensis on the pharmacokinetics of tolbutamide in rats
TAN Zhao-dan, MA Yue-ming*, SHIRong, CHEN Ying-rong
(College of Pharmacy,Shanghai University of TCM,Shanghai 201203,China)
AIMTo investigate the influence ofScutellaria baicalensison the pharmacokinetics of tolbutamide in rats.METHODSTwelve rats of either sex were randomly divided into two groups,NS group(pretreated with 0.9%saline solution)and HQ group(pretreated with the aqueous extracts ofScutellaria baicalensis).After the pretreatment,each group was treated with a single oral administration of tolbutamide 50 mg/kg.The plasma concentrations of tolbutamide and 4-hydroxytolbutamide were measured by HPLC-UV,and then pharmacokinetic parameters were determined from the plasma concentration-time data.RESULTSIn the female rats,AUC0-tof tolbutamide and 4-hydroxytolbutamide were(1 760±82)and(18±2)μg/(mL·h)in NS group and(2 360±298)and(25±4)μg/(mL·h)in HQ group,respectively.Compared with NS group,Scutellaria baicalensisincreased AUC0-tof tolbutamide by nearly 34.1%(P<0.05).However,in male and female rats there was no significant difference in thet1/2of tolbutamide and AUC0-tratio of tolbutamide to 4-hydroxytolbutamide between NS group and HQ group.CONCLUSIONScutellaria baicalensismay increase the overall exposure of tolbutamide in female rats.
tolbutamide;Scutellaria baicalensis;pharmacokinetics;rat
R969.1
A
1001-1528(2011)07-1153-06
2010-10-20
上海高校创新团队建设项目(2009)
谭朝丹(1987—),女,硕士生,研究方向:中药药代动力学。Tel:(021)51322389,E-mail:tanzhaodan@126.com
*通信作者:马越鸣(1959—),女,硕士,教授,从事中药药代动力学研究。Tel:(021)51322386,E-mail:mayueming_117@126.com组中分别为(2 360±298)μg/(mL·h)和(25±4)μg/(mL·h),即给予黄芩后,甲苯磺丁脲的AUC0-t升高约34.1%(P<0.05);而甲苯磺丁脲的 t1/2以及 AUC0-t(甲苯磺丁脲)/AUC0-t(4-羟基甲苯磺丁脲)比值,无论雌雄,NS 组和 HQ 组间的差异无统计学意义。结论 黄芩可提高雌性大鼠体内甲苯磺丁脲的总体暴露水平。

