自发性高血压大鼠心脏中ACE,AT1R,ACE2和MasR表达变化的研究*
李鹏飞,张 伟,马 畅,张源淑
(南京农业大学农业部动物生理生化重点开放实验室,江苏 南京 210095)
肾素-血管紧张素系统(renin-angiotensin system,RAS)是人类及其他哺乳动物心血管系统体液调节机制中的重要组成部分,其包括两个轴:血管紧张素转化酶-血管紧张素Ⅱ-ATI受体轴(Angiotensin converting enzyme-AngiotensinⅡ-ATI Gx-ACE-AngII-AT1轴)和血管紧张素转化酶-血管紧张素(1-7)-Mas受体轴(Angiotensin converting enzyme 2-Angiotensin(1-7)-Mas axis,ACE2-Ang(1-7)-Mas);前者主要是通过血管紧张素Ⅱ(angiotensinⅡ,AngII)引起血管收缩、血压升高、促进心肌细胞和血管平滑肌细胞增生等效应[1];后者作用与前者作用相反[2]。现在关于ACE-AngII-AT1轴的研究比较多,但是关于ACE2-Ang(1-7)-Mas轴及两条轴在高血压时是如何变化的研究比较少。本研究通过观察自发性高血压大鼠(SHR)和与之匹配的正常Wistar-京都大鼠(WKY)心脏组织中血管紧张素转化酶(angiotensin-converting enzyme,ACE),血管紧张素转化酶2(angiotensin-converting enzyme,ACE2)表达的差异,并结合其相应受体AT1受体(ATR)和Mas受体(MasR)及血液中AngII的变化,从基因和蛋白水平上探讨R AS两条通路在高血压发病机制中的作用。
1 材料与方法
1.1 主要试剂
AngII放免试剂盒(北京北方);Trizol试剂盒(南京天根);PCR引物(上海英骏);MMLV反转录酶、RNA抑制剂、随机引物(南京生兴)。SYBR Premix Ex Taq(南京博飞);BCA蛋白定量试剂盒(上海碧云天);ACE2(C-18)兔多克隆抗体(美国Santa Cruz),羊抗兔IgG(武汉博士德)。
1.2 动物饲养与处理
14周龄雄性WKY和SHR各8只,体重300g左右(购于上海斯莱克实验动物有限公司,许可证号:SCXK沪2007-0005)。两组大鼠自由饮食,饲喂一周后用BSN-II多通道无创测压系统测定收缩压(systolic blood pressure,SBP)、舒张压(diastolic blood pressure,DBP)和心率(Heart rate,HR),并称重后断头取血,迅速取其心脏放入液氮,随后转入-80℃待测。
1.3 血浆AngII水平
放射免疫分析法测定血浆AngII水平。按说明书操作,FMJ-182放射免疫γ-计数器检测各管沉淀物的放射性计数(cpm)。
1.4 大鼠心脏组织中ACE、AT1R、ACE2和MasR mRNA表达的Real-time PCR分析
1.4.1 样品总RNA提取和反转录 Trizol一步法抽提大鼠心脏总RNA,比色法测定总RNA的浓度和纯度。用随机引物反转录样品总RNA成为cDNA。
1.4.2 引物设计 根据NCBI网上大鼠mR NA序列,用Primer 5.0软件设计引物,引物序列及参数见表1。
1.4.3 PCR条件 实时荧光定量PCR采用SYBRGreen染料法。PCR 反应总体积为 25μl,包括 2μl cDNA,12.5μl SYBR Green Master Mix,2μl目的基因引物和 8.5μl灭菌三 蒸水 ;反应条件为:94℃预变性1 min;94℃变性20s,62℃退火30s,72℃延伸30s,共40个循环,各样本结果均用其相应的β-actin标化,用相对△△CT法进行数据统计。
1.5 大鼠心脏组织中 ACE2的 Western blot分析
1.5.1 心脏总蛋白的提取及浓度测定 参照Gembardt F等人的方法提取大鼠心脏总蛋白。BCA法测定蛋白质浓度。
1.5.2 电泳、转印和抗体孵育 以 80μg总蛋白样品上样,经聚丙烯酰胺琼脂糖凝胶电泳后,转移到PVDF膜上,5%脱脂奶粉封闭,一抗4℃孵育过夜,洗膜;二抗室温孵育 2 h,洗膜。
1.5.3 化学发光反应和拍照分析 ECL试剂作用于PVDF膜上,反应3 min,然后于暗室中显影和定影。凝胶成像系统半定量分析测得的灰度值,确定样品中目的蛋白表达的相对含量。

Tab.1 Parameters of primer pairs for ACE ,AT1R,ACE2,MasR and β-actin genes
1.6 统计学处理
2 结果
2.1 大鼠体重与血压
SHR大鼠收缩压和舒张压均高于WKY大鼠,分别增加了38.2%和38.3%(P<0.01),两组大鼠心率和体重没有显著差异(P>0.05,表2)。
Tab.2 SBP,SDP,HR and BW of SHR andWKY(,n=8)

Tab.2 SBP,SDP,HR and BW of SHR andWKY(,n=8)
SBP:Systolic blood pressure;DBP:Diastolic blood pressure;HR:Heart rate;BW:body weight**P<0.01 vs WKY
WKY SHR SBP(mmHg) 138.72±4.97 191.75±4.06**DBP(mmHg) 101.68±3.96 140.67±4.39**HR(/min) 391.67±26.61 455.67±14.47 BW(g) 340±6.38 327.5±6.2
2.2 大鼠血浆 AngII含量
与WKY大鼠相比,SHR大鼠血浆中AngII含量显著升高(1.99±0.09 vs 2.60±0.08,P<0.05)。
2.3 WKY和 SHR大鼠心脏组织中ACE,ACE2,AT1R和MasR mRNA的表达
SHR大鼠心脏中ACE2 mRNA的表达较WKY大鼠显著降低(P<0.05),而ACE mR NA的表达显著升高(P<0.05)。心脏中ATR和MasR mRNA表达与WKY大鼠相比均有下降,但差异不显著。
2.4 WKY和 SHR大鼠心脏中ACE2 Western blot结果
免疫印迹结果显示,与WKY大鼠相比,SHR大鼠心脏ACE2蛋白含量均显著下降(图2,P<0.05)。

Fig.1 Expression of ACE,AT1R,ACE2 andMasR mRNA in heart of SHR and WKY(n=8)
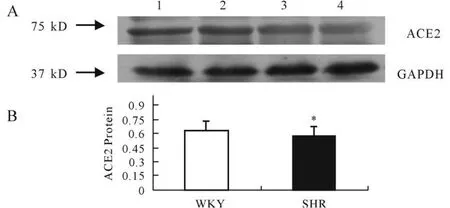
Fig.2 Protein expression of ACE2 in heart of SHR comparedwith WKY(n=8)
3 讨论
高血压是严重危害人类健康的一种疾病,人类高血压发病中90%为原发性高血压。肾素-血管紧张素系统(RAS)与高血压存在着很密切的关系,它是人类及其他哺乳动物心血管系统体液调节的机制中的重要组成部分。现已证明R AS的成员ACE基因多态性与高血压有密切的关系,其能酶解AngⅠ生成AngII,过量AngII通过AT1受体可导致血管收缩、水盐代谢失调等负面效应。ACE2是新近发现的ACE的同源物,研究表明,ACE2的主要生物学效应是降解AngII产生具有舒张血管、拮抗细胞增殖及抗炎症作用的Ang(1-7)。Ang(1-7)拮抗作用主要是通过其特异性受体MasR受体结合实现。即ACE和ACE2是一对相抗衡、功能效应相反的酶[3]。现已证明RAS系统存在着两条在生理作用上相互拮抗的通路:一条是ACE-AngII-AT1通路,引起血管收缩,血压升高;另一条是ACE2-Ang(1-7)-Mas通路,引起血管舒张血压下降。两条通路失衡往往导致高血压、心脏功能紊乱、糖尿病等疾病的发生。
ACE2与高血压方面的研究已有很多;Ling Li[4]小组发现心肌肥大高血压大鼠血压升高的同时心肌组织中ACE2 mRNA和蛋白表达显著升高,ACE/ACE2比值升高。在研究心衰竭和心肌梗死大鼠[5]时也得到了同样的结果,他们认为ACE2表达升高是对局部组织R AS激活的一种代偿性补偿,占主导作用的还是ACE。蔡冬梅等人的则发现,与WKY大鼠相比,SHR大鼠心肌组织ACE2 mRNA和蛋白表达均显著减低。本研究表明,与WKY大鼠相比,SHR大鼠心脏ACE2 mR NA和蛋白表达水平均显著下降(P<0.05),与蔡冬梅等人的结果一致,而ACE mRNA表达显著升高(P<0.05)。
本试验中我们发现,从ACE-AngII-AT1通路方面看,SHR大鼠心脏中ACE mRNA表达均显著高于WKY大鼠(P<0.05),AT1受体mRNA表达没有显著性变化但有升高的趋势(P>0.05),血浆中AngII含量显著升高(P<0.05),即ACEAngII-AT1轴成升高趋势。从ACE2-Ang(1-7)-Mas通路方面,SHR大鼠心脏中ACE2 mR NA和蛋白表达均显著低于WKY大鼠(P<0.05),其相关受体Mas mRNA表达有相应下降的趋势。因此,我们认为ACE和ACE2表达异常是引发高血压病的一个重要原因。SHR大鼠高血压的产生,其机理一方面可能是ACE-AngII-AT1通路的过度激活加速了AngII的生成;另一方面ACE2表达降低又减少了AngII的降解和Ang(1-7)的生成,即高血压时ACE-AngII-AT1R轴起主导作用。但其调控机制有待进一步的研究。
[1]Chappel M C,Ferrario C M.ACE and ACE2:their role to balance the expression of angiotensinII and angiotensin-(1-7)[J].Kidney Int,2006,70(1):8-10.
[2]Fernandes L,Fortes Z B,Nigro D,et al.Potentiation of bradykinin by angiotensin 1-7 on arterioles of spontaneously hypertensive rats studied in vivo[J].Hypertension,2001,37(2 Part 2):703-709.
[3]Fraga-Silva R A,Pinheiro S V,Goncalves A C,et al.The antithrombotic effect of angiotensin 1-7 involves mas-mediated NO release from platelets[J].Mol Med,2008,14(1-2):28-35.
[4]Li L,Yi-Ming W,Li Z Z,et al.Local RAS and inflammatory factors are involved in cardiovascular hypertrophy in spontaneously hypertensive rats[J].Pharmacol Res,2008,58(3-4):196-201.
[5]Burrell LM,Risvanis J,Kubota E,et al.Myocardial infarction increases ACE2 expression in rat and humans[J].Eur Heart J,2005,26(4):369-375.

