随年龄增长心肌线粒体PT孔开放改变及其机制*
赵淑琴,王秀静,张世忠,曹 阳,陈慧颖,李从德
(三峡大学医学院,湖北 宜昌 443002)
线粒体通透性转换(mitochondrial permeability transition pore,MPTP)孔是位于线粒体内膜上的一种非特异孔道[1]。近年来国内外的研究发现它在细胞死亡和/或凋亡的启动或终止以及缺血/复灌损伤的发生、发展和转归过程中都具有关键作用[2]。研究发现在老年小鼠的肝脏和淋巴细胞,线粒体上PT孔较易于开放的现象[3],这一发现提示线粒体PT孔与衰老有联系[4]。由于在心肌衰老退化过程中,往往伴随心肌细胞的死亡和凋亡,因此有理由推测,线粒体PT孔可能在心肌的自然衰退中扮演重要的角色。基于此,本研究对不同月龄SD大鼠心功能自然衰退过程中线粒体PT孔开放改变以及诱发其改变的相关机制进行了研究。
1 材料与方法
1.1 实验分组
SD大鼠(32只,购自同济医学院)分为3、6、9、12月龄4组(n=8),各组大鼠雌雄各半。
1.2 心功能检测
将SD大鼠(雌雄各半)用水合氯醛(0.4 g/kg)麻醉,固定于鼠手术台。实验过程中,大鼠体温保持在37℃,每隔30min定量补充麻药(0.016 g/kg,)以维持麻醉状态。在颈部作正中切口,暴露气管,作气管插管并接呼吸机(潮气量为2 ml,呼吸频率为70counts/min),然后分离大鼠右侧颈总动脉,将颈总动脉插管一端与压力传感器相连,另一端缓慢插入颈总动脉直至左心室,用Biopac16道生物信号记录系统记录左室收缩压(left ventrucular systolic pressure,LVSP)、左室舒张末压(left ventricular end-diastolic pressure,LVEDP)、左室压上升/下降最大速率±dp/dtmax(the maximal rate of rise/fall of left ventricular pressure)。
1.3 线粒体形态学检测
梯度离心法分离心肌细胞的线粒体,10%福尔马林固定,切片电镜观察线粒体形态。
1.4 线粒体PT孔开放检测
以梯度离心法分离心肌细胞的线粒体,以200μmol/L Ca2+,诱发MPTP孔的开放,采用线粒体基质肿胀法检测520nm处线粒体吸光度的减小速度和幅度,持续观察线粒体TP孔开放状态变化10min。
1.5 线粒体Mn-SOD活性检测
梯度离心法分离心肌细胞线粒体,各组心肌线粒体Mn-SOD活性用试剂盒(购自南京建成)检测。
1.6 统计学处理
采用SPSS13.0软件进行分析,实验结果以均数±标准差()表示,多组间均数比较用ANOVA和 Newman-Keuls法分析。
2 结果
2.1 各组大鼠心功能检测
随大鼠月龄增加,9月龄和12月龄大鼠心室功能开始出现减退改变,同 3月龄大鼠相比,LVSP减小(P<0.01),LVEDP增高(P<0.01),+dp/dtmax和-dp/dtmax均明显减小(P<0.01,表 1)。
2.2 线粒体形态学检测
电镜形态学检测显示,本实验所用的心肌线粒体分离方法得到的心肌线粒体呈圆形,电子密度较高,外膜光滑完整,内脊排列整齐,完整无断裂,线粒体内无基质肿胀(图1)。
2.3 各组线粒体PT孔开放检测结果
随大鼠月龄增长,心肌线粒体PT孔开放程度(图2 A)和开放速率(图2B)逐渐增加,6月龄大鼠心肌线粒体PT孔开放速率增加与3月龄比具有统计学差异(P<0.05),9月龄和12月龄大鼠线粒体PT孔开放速率增加尤为明显,同3月龄大鼠相比具有显著差异(P<0.01)。
Tab.1 Cardiac function measurement of rats from different months(,n=8)

Tab.1 Cardiac function measurement of rats from different months(,n=8)
M:Month;LVSP:Left ventrucular systolic pressure;LVEDP:Left ventricular end-diastolic pressure;HR:Heart rate;+dp/dt max:The maximal rate of rise of left ventricular pressure;-dp/dt max:The maximal rate of fall of left ventricular pressure**P<0.01 vs 3M group;##P<0.01 vs 9M group
Month LVSP(mmHg) LVEDP(mmHg) HR(beat/min) +dp/dt max(mmHg/s) -dp/dt max(mmHg/s)3 126.81±10.92 -1.04±0.21 424.71±63.72 3063.52±307.51 -3319.13±401.946 143.34±11.62 -4.77±0.79** 413.86±27.53 3695.23±223.25** -3624.53±319.979 89.04±12.35** 5.53±1.26** 423.67±27.45 2040.24±385.55** -2100.52±136.73**12 85.03±3.07** 17.00±3.00## 375.71±63.02 1679.53±225.27** -1372.42±215.45##
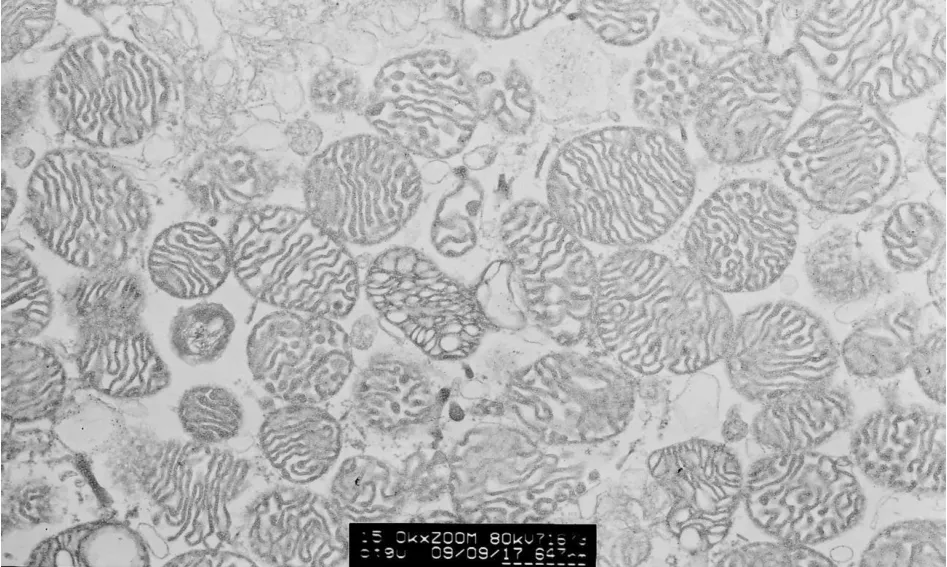
Fig.1 Electrograph of mitochondria from rat heart(×50k)

Fig.2 Changes of mitochondrial PT pore opening with month in-creasing
2.4 各组线粒体Mn-SOD活性检测结果
除6月龄大鼠外,随大鼠月龄增长,心肌线粒体Mn-SOD活性逐渐减小,其中9月龄和12月龄大鼠心肌线粒体Mn-SOD活性减小显著,与3月龄和6月龄大鼠相比具有显著统计学差异(P<0.01,图3)。

Fig.3 Activity of Mn-SOD from mitochondria in different months group
3 讨论
在衰老机制的研究中,线粒体功能障碍与衰老的关系受到极大的关注,这方面的研究文献积累已相当丰富。总的观点认为,线粒体是细胞ROS产生的主要场所,线粒体产生过多的ROS可造成线粒体DNA(mtDNA)的氧化应激损伤和呼吸链功能障碍,呼吸链功能障碍又可使线粒体产生更多的ROS,这三者相互联系在一起形成一个恶性循环,逐渐发展导致线粒体功能障碍并最终损害细胞的功能和活性[5]。这些研究结果表明,线粒体功能障碍确实与衰老有着密切的联系。
MPTP孔是位于线粒体内膜上的一种非特异孔道。近年来国内外的研究发现它在细胞钙稳态调节、细胞死亡和/或凋亡的启动或终止以及缺血/复灌损伤的发生、发展和转归过程中都具有关键作用。由于在心肌衰老退化过程中,往往伴随心肌细胞的死亡和凋亡,因此有理由推测,线粒体PT孔在心肌的自然衰退中扮演重要的角色。
为验证这一推测,本实验分别对3、6、9、12月龄大鼠心功能进行检测,并对线粒体PT孔开放状态进行同期检测,从而动态观察了在心功能自然衰退过程中PT孔开放状态改变。
我们的研究结果表明,线粒体PT孔开放随大鼠月龄增加而呈逐渐增大的趋势,其中9月龄和12月龄大鼠PT孔开放程度明显增强。对不同月龄大鼠心功能的检测表明,9月龄和12月龄大鼠心功能开始明显减退。据此,我们推测,心肌线粒体PT孔开放改变是先于心功能减退发生而出现的一个生理现象,从心功能减退时心肌线粒体PT孔开放程度明显增加的实验结果推测,心肌线粒体PT孔开放增强有可能是诱发心功能减退的一个重要生理启动机制。
实验中,我们检测到随月龄增加,大鼠线粒体Mn-SOD活性总体呈下降趋势,其中在9月龄和12月龄心功能减退大鼠的下降尤为明显,因此推测线粒体抗氧化能力的减退可能是造成线粒体PT孔开放改变的一个重要因素,但是尚需进一步通过实验证实。另外,线粒体PT孔开放诱发心功能减退的确切机制还有待于进一步研究。
[1]Bernardi P,Forte M.The mitochondrial permeability transition pore[J].Novartis Found Symp,2007,287:157-164.
[2]Gomez L,Li B,Mewton N,et al.Inhibition ofmitochondrial permeability transition pore opening:translation to patients[J].Cardiovasc Res,2009,83(2):226-233.
[3]Rottenberg H,Wu S.Mitochondrial dysfunction in lymphocytes from old mice:enhanced activation of the permeability transition[J].Biochem Biophys Res Commun,1997,240(1):68-74.
[4]Crompton M.Mitochondria and aging:a role for the permeability transition[J].Aging Cell,2004,3(1):3-6.
[5]Hiona A,Leeuwenburgh C.The role of mitochondrial DNA mutations in aging and sarcopenia:implications for the mitochondrial vicious cycle theory of aging[J].Exp Gerontol,2008,43(1):24-33.

