内质网应激及其特有凋亡途径Caspase-12与糖尿病大鼠肾组织固有细胞凋亡之间的关系*
曹延萍,郝咏梅,刘青娟,王 建,李 航,段惠军△
(1.河北医科大学病理教研室,2.河北医科大学第二医院内分泌科,石家庄 050017;3.邯郸市第一医院急诊科,河北 邯郸 056002)
糖尿病肾组织损害是糖尿病(DM)最严重的微血管并发症之一,肾脏固有细胞过度凋亡导致的细胞增殖与凋亡关系的不平衡是肾脏功能恶化甚至衰竭的重要机制,内质网应激是近年来新发现的介导细胞凋亡的途径之一,并已证明在糖尿病脏器损害过程中普遍存在。本研究观察了内质网应激(endoplasmic reticulum stress,ERS)标志蛋白GRP78及其特有的凋亡途径Caspase-12的表达及其与肾脏固有细胞凋亡之间的关系,探讨ERS是否存在于糖尿病肾损害过程中以及相应的作用,为临床寻求防治糖尿病肾损害的有效方法提供理论依据。
1 材料与方法
1.1 材料
Wistar雄性大鼠由河北省实验动物中心提供。链脲佐菌素(Streptozotocin,STZ,Sigma公司)。小鼠抗大鼠PCNA单克隆抗体(武汉博士德生物工程公司),兔抗GRP78单克隆抗体(NeoMarkers公司),CASPASE-12单克隆抗体(abcam生物制品有限公司),TUNEL试剂盒(Promega公司)
1.2 方法
1.2.1 动物模型及分组 选取体重 120~140g Wistar大鼠24只,随机分A组:右肾切除对照组(n=10);B组:糖尿病(DM)组(n=14)。所有大鼠均用戊巴比妥钠(40mg/kg)腹腔注射麻醉,行右肾切除术,2周后大鼠切口完全愈合。B组大鼠按65 mg/kg腹腔注射STZ(溶于0.1 mol/L枸椽酸缓冲液中,pH值4.5),A组只注射相当体积的枸椽酸缓冲液,48 h后于大鼠尾尖取血。血糖仪测定血糖,并测尿糖。血糖≥16.7 mmol/L,尿糖+++~++++者确定为DM模型。实验期间动物自由进饮食,不使用胰岛素及其他降糖药物。
1.2.2 标本收集 DM模型建成后,每周测血糖1次,不符合标准者弃去;于成模8周称重后用代谢笼收集24h尿,乙醚麻醉,股动脉取血,分离血清,用于生化指标测定。切取左肾,去掉被膜,滤纸吸干血迹后称重,部分置于4%多聚甲醛固定留做HE、PAS染色及免疫组化、TUNEL检测,部分置于70%乙醇固定后行流式细胞术检测。
1.2.3 血、尿生化指标测定 血糖(blood glucose,Glu)、血肌酐(Serum creatinine,Scr)、尿肌酐(Urine creatinine,Ucr)、血尿素氮(blood urea nitrogen,BUN)、尿蛋白均用日立7170A全自动生化分析仪测定,并计算肌酐清除率(creatinine clearance,Ccr)。
1.2.4 常规病理学观察 肾组织石蜡包埋后切片2μm,常规 HE、高碘酸-希夫(PAS)染色 ,光镜下观察肾组织形态学改变。
1.2.5 免疫组织化学检测 采用SP法。2μm肾组织切片,常规脱蜡至水,一抗 PCNA、GRP78(1∶100),Caspase-12(1∶1000)稀释 ,二抗为生物素化山羊抗兔IgG,PBS替代一抗作为阴性对照,DAB显微镜控制下显色。免疫组化结果应用IPP图文分析软件分析,每张切片取10个高倍视野,综合阳性面积和染色深度计算阳性区域的积分光密度值(IOD),以各组的均值进行比较。
1.2.6 TUNEL法检测细胞凋亡 肾脏2μm切片常规脱蜡入水,蛋白酶K室温下消化,TDT酶反应液37℃孵育1 h,0.3%H2O2抑制内源性过氧化物酶,Streptavidin-HRP室温5 min,DAB显色,苏木精复染。阴性对照采用无酶标记液(删除TDT)代替TDT酶反应液。凋亡细胞核呈棕褐色颗粒,光镜下观察并计数凋亡细胞。
1.2.7 流式细胞术检测细胞凋亡水平及GRP78和Caspase-12的表达 将标本用网搓法制成单细胞悬液,采用间接免疫荧光法,在细胞悬液中分别加入1∶200稀释的兔抗GRP78和1∶1000的兔抗Caspase-12单克隆抗体,37℃温浴30min后洗涤,加入羊抗兔FITC-IgG,温浴洗涤后行流式细胞仪(美国Beckman Coulter公司,Epics-XLⅡ型)检测,测量的数据应用相应的程序进行资料处理,测定前以标准样品调整仪器CV值在2%以内。GRP78和Caspase-12表达的定量分析以荧光指数(FI)表示其相对含量:FI=(样品的平均荧光强度-对照样品平均荧光强度)/正常组织平均荧光强度;
1.3 统计学分析
2 结果
2.1 一般情况
实验期间,B组Glu明显升高,并逐渐出现多饮多食、多尿、毛色晦暗和体重下降等症状,建模8周,B组与A组相比,BUN,Scr及尿蛋白等指标均显著升高。一只出现白内障。整个实验过程中B组1只大鼠死亡,1只血糖未达成膜标准,予以剔除。最终共22只完成实验,其中A组10只,B组12只。
2.2 肾功能改变
8周时B组与A组相比,血糖、BUN和尿蛋白明显增高,Ccr显著降低(P<0.05,表 1)
Tab.1 Serum glucose,blood urea nitrogen,creatinine clearance and 24h urinary protein excretion in control group and diabetic group()

Tab.1 Serum glucose,blood urea nitrogen,creatinine clearance and 24h urinary protein excretion in control group and diabetic group()
Glu:Serum glucose;Pro:24h urinary protein excretion;BUN:Blood urea nitrogen;Ccr:creatinine clearance*P<0.05 vs control group
Group n Glu(mmol/L)Pro(mg/24h)BUN(mmol/L)Ccr(ml/min)Control 10 8.68±0.66 6.57±1.03 5.81±0.13 0.64±0.21 Diabetic 12 20.15±1.56* 17.42±1.22* 12.98±2.04* 0.20±0.16*
2.3 肾组织病理学检查
光镜下对照组肾组织未见病理改变,糖尿病组大鼠肾小球细胞外基质略增生,肾小管上皮细胞肿胀,可见空泡变性,部分萎缩或扩张,小动脉管壁略增厚(图1)。
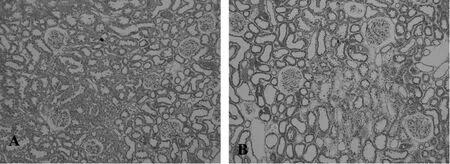
Fig.1 HE staining in renal cortex at week 8(×100)
2.4 免疫组织化学检测
PCNA、GRP78及Caspase-12在肾脏定位表达:PCNA、GRP78、Caspase-12在正常对照组大鼠肾皮质均有表达,PCNA阳性细胞为细胞核呈棕黄色,在100倍视野中连续不重叠的计数100个肾小管的细胞总数和阳性细胞数及50个肾小球的阳性细胞数,以肾小管细胞的阳性率和单个肾小球切面的阳性细胞数作为比较指标。对照组和糖尿病组肾皮质小球、小管内均可见阳性细胞,差别无统计学意义。GRP78在正常对照组弱表达,主要位于远端小管和集合管上皮细胞胞浆内;糖尿病组却是广泛的强阳性表达,尤以近曲小管胞浆最为显著,部分肾小球内细胞胞浆也呈强阳性表达,两组的阳性着色区域积分光密度值分别为4177.50±1864.22和147085±8626.40,差异有统计学意义(P<0.05,图2)。Caspase-12正常对照组有表达,主要位于肾小管上皮细胞胞浆内,糖尿病组表达明显增强,小管及小球内均可见阳性表达,阳性区域的积分光密度值分别为74207.33±6980.38和175874.0±7826.11,差异有统计学意义(P<0.05,图3)。
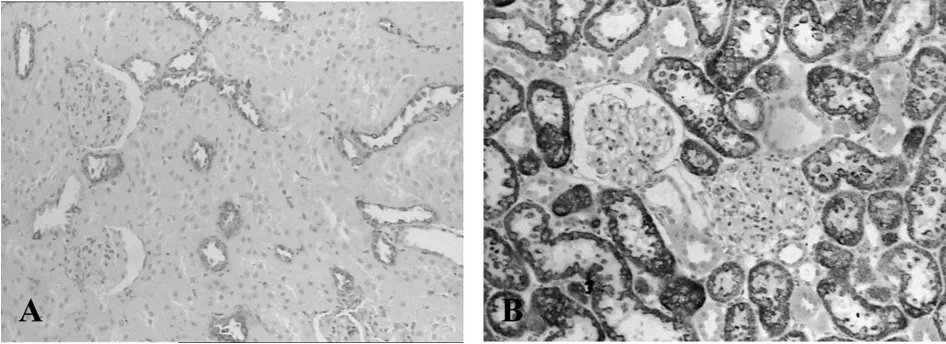
Fig.2 Immunohistochemical staining of GRP78 protein in renal cortex at week 8(×100)
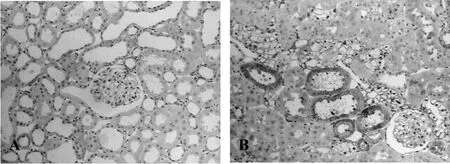
Fig.3 Immunohistochemical staining of Caspase-12 protein in renal cortex at week 8(×100)
2.5 流式细胞术检测细胞凋亡程度及对GRP78和Caspase-12半定量分析结果
糖尿病组细胞凋亡率(图4)、GRP78及Caspase-12表达程度较正常对照组明显增高(P<0.01,表2)

Fig.4 Apoptosis rate of cells in renal cortex at week 8 by FCM
Tab.2 Examin the expression of GRP78 、Caspase-12 protein and apoptosis rate by flow cytometry(,FI)

Tab.2 Examin the expression of GRP78 、Caspase-12 protein and apoptosis rate by flow cytometry(,FI)
FI:Fluorescence intensity;GRP78:78kDa glucose-regulated protein*P<0.01 vs control group
Group n GRP78(ng/ml) Caspase-12(ng/ml) Apoptosis rate(%)Control 10 1.000±0.047 1.000±0.057 7.872±1.143 Diabetic 12 1.182±0.026* 2.000±0.300* 12.264±0.523*
2.6 TUNEL定位检测肾脏凋亡细胞
正常对照组肾小管偶见凋亡细胞,糖尿病组细胞凋亡数明显增高,小球、小管内均有阳性表达,但主要位于小管上皮细胞,尤以皮髓质交界处多见(图5见下页)。
3 讨论
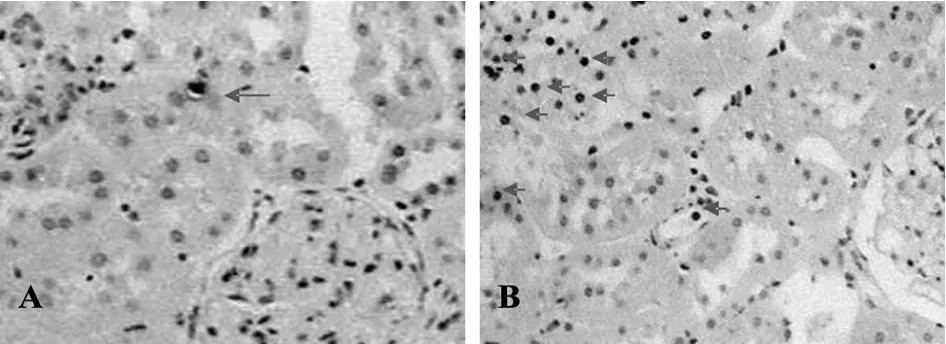
Fig.5 Assessment of the apoptotic cells in renal cortex at week 8 by TUNEL staining(×100)
糖尿病肾病(DN)是糖尿病(DM)最严重的微血管并发症之一,也是导致终末肾衰竭的常见原因,肾脏固有细胞过度凋亡引起的细胞增殖与凋亡关系的不平衡是肾脏功能恶化甚至衰竭的重要机制。本实验以流式细胞术及TUNEL染色检测糖尿病大鼠肾组织细胞凋亡程度及定位,以免疫组织化学检测糖尿病大鼠肾组织中PCNA的表达,以此代表细胞的增殖水平,结果显示,DM大鼠8周时肾组织中细胞凋亡数较正常对照组明显增高,TUNEL染色与流式细胞术结果相吻合,DM组肾组织凋亡细胞主要位于小管上皮细胞,部分肾小球也有阳性表达,然而二组间肾小球和肾小管细胞PCNA的阳性细胞数与对照组比较差别无统计学意义,提示与细胞增殖程度相比,建模8周DM组肾脏细胞过度凋亡,成熟的肾小管上皮细胞增殖能力较弱,足细胞是终末分化的细胞,几乎没有增殖能力,肾脏固有细胞过多凋亡可能是促进糖尿病肾脏损害和肾功能恶化的重要原因之一。
凋亡的起源问题,既往认为线粒体在其发生过程中起核心作用,近来研究结果证明,内质网在控制细胞命运中具有更重要的作用。内质网(ER)是真核细胞中蛋白质翻译合成和细胞内钙离子的储存场所,对细胞应激反应起调节作用。缺血、缺氧、错误折叠蛋白的积聚、Ca2+稳态失衡等都可干扰内质网正常生理功能,这种亚细胞器病理状态称为内质网应激(endoplasmic reticulum stress,ERS)。ERS激活未折叠蛋白反应(unfolded protein response,UPR),使蛋白质生物合成减少,内质网的降解功能增强,从而降低内质网负担,维持细胞内稳态,如果ERS持续存在,则可能诱发凋亡。研究表明,高糖可以诱导引起ERS的许多因素[1],据报道,高糖影响内环境中的Ca2+,抑制Ca2+通过内质网的能力,使得Ca2+在内质网储积、释放以及再次泵人障碍,并且,高糖易引起氧化产生过氧化氢并产生活性中间体,氧化应激在DM肾损伤中起重要作用[2、3],氧化应激与ERS呈正相关[4]。除了高血糖,低氧、脂质沉积、分泌性蛋白合成增多等因素均可引起ERS,并有研究证实,DM肾损害过程中激发了ERS并在其发病机制中扮演重要角色[5]。
78 kDa-糖调节蛋白(78-kDa glucose-regulated protein,GRP78)属于热休克蛋白(HSP70)家族,也称免疫球蛋白重链结合蛋白(immunoglobulin heavy chain binding protein(BiP)),是内质网分子伴侣蛋白,通过与内质网应激元件PKR、IRE1以及ATF6的结合抑制ERS的激活,在未折叠蛋白反应中发挥主要调控作用[6],生理情况下,GRP78在基础水平表达,主要功能是作为分子伴侣参与新生多肽链的折叠、装配和转运,GRP78的诱导广泛被认为是ERS的标志性分子[7][8],本研究结果显示,糖尿病组GRP78表达明显高于对照组,主要位于肾皮质近曲小管,部分肾小球也有表达,提示糖尿病大鼠肾脏损害过程中发生了ERS,且主要位于此区域。
早期ERS通过激活UPR及时有效的逆转ERS增强细胞的存活能力,但ERS持续存在时,凋亡是其最终的结局。ERS可以激活多条途径诱导细胞凋亡,尽管ERS介导的凋亡途径并没有完全阐明,但是内质网膜上的Caspase-12的活化已经被确认参与这个过程[9]。Caspase-12定位于ER外膜,是介导ERS凋亡的关键蛋白酶,在膜受体或线粒体凋亡途径中不被活化[8][9]。Rao等[6]报道 ERS导致GRP78-procaspase12-procaspase7复合物形成,过度应激最终使这一多聚复合物裂解,释放活性Caspase-12,我们的结果显示,正常对照组大鼠肾组织中Caspase-12仅有少量表达,DM组大鼠肾脏固有细胞凋亡数增多并伴有GRP78、Caspase-12表达上调,提示可能通过Caspase-12途径介导肾脏固有细胞凋亡,参与糖尿病肾损害的发生发展过程并一定程度上介导了肾功能衰竭。研究表明,GRP78在大量白蛋白刺激鼠近端肾小管上皮细胞中呈高表达趋势并诱导凋亡[10],蛋白尿可以通过ERS相关凋亡途径,激活Caspase-12引起肾小管损伤,此外,大量蛋白积聚可在体外培养的足细胞中诱导ERS引起足细胞损伤,而足细胞损伤对蛋白尿的进展发挥中心作用,本实验糖尿病组大鼠8周时,已有大量蛋白尿形成,这是ERS的原因还是ERS的结果尚需进一步研究,进一步检测ERS诱导的凋亡途径在其发病中的地位以及通过干扰ERS不同环节,减少细胞凋亡,从而起到保护肾脏的作用,将为疾病治疗方案的全新设计提供新思路。
[1]Cheng D W,Jiang Y,Shalev A,et al.An analysis of high glucose and glucosamine-induced gene expression and oxidative stress in renal mesangial cells[J].Arch Physiol Biochem,2006,112(4-5):189-218.
[2]Kaneto H,Matsuoka T A,Nakatani Y,et al.Oxidative stress,ER stress,and the JNK pathway in type 2 diabetes[J].J Mol Med,2005,83(6):429-439.
[3]陈国荣,刘 毅,毛孙忠,等.黄芪对糖尿病性肾病大鼠心肌脂质过氧化作用及一氧化氮水平的影响[J].中国应用生理学杂志,2001,17(2):186-188.
[4]King G L,Loeken M R,Hyperglycemia-induced oxidative stress in diabetic complications[J].Histochem Cell Biol,2004,122(4):333-338.
[5]曹延萍,李 航,王 建,等.转录因子GADDl53/CHOP的激活与糖尿病大鼠肾组织固有细胞凋亡的关系初探[J].中国组织化学与细胞化学杂志,2010,19(5):453-456.
[6]Rao R V,Peel A,Logvinova A,et al.Coupling endoplas-mic reticulum stress to the cell death program:role of the ER chaperone GRP78[J].FEBS Lett,2002,514(2-3):122-128.
[7]Schroder M,Kaufman R J.The mammalian unfolded protein response[J].Annu Rev Biochem,2005,74:739-789.
[8]Ni M,Lee A S.ER chaperones in mammalian development and human diseases[J].FEBS Lett,2007,581(19):3641-3651.
[9]Ohse T,Inagi R,Tanaka T,et al.Albumin induces endoplasmic reticulum stress and apoptosis in renal proximal tubular cells[J].Kidney Int,2006,70(8):1447-1455.
[10]Hetz C,Russelakis-Carneiro M,Maundrell K,et al.Caspase-12 and endoplasmic reticulum stressmediate neurotoxicity of pathological prion protein[J].EMBOJ,2003,22(20):5435-5445.
——疾病防治的新靶标

