海马神经元缺血/再灌注后自噬的表达及其作用*
苏 方,张 培,姜治伟,彭德清,高璐滢,刘书琴,钱令波,叶治国,夏 强
(浙江大学医学院生理学系,杭州 310058)
缺血性脑血管疾病已成为威胁人类健康的三大杀手之一,其在中国的死亡率已居各种疾病之首。我国每年新发完全性脑中风约200万人,死亡者约150万人,600~700万脑中风幸存者中50~70%遗留瘫痪、失语等严重残疾,需要医疗照顾者300余万,给患者家庭和社会带来沉重的经济负担。及时恢复缺血区域的血液灌流是减小脑缺血梗死面积、减少病死率和致残率的最有效办法,然而临床和实验研究均发现缺血区恢复血液灌流后缺血损伤进一步加重,即存在脑缺血/再灌注损伤[1]。由于脑缺血/再灌注损伤机制复杂,临床上至今尚未有效对策减少这种损伤,研究表明自噬可以被急性缺血诱导,在维持缺血缺氧等应激状态下细胞存活中有重要意[2]。但是自噬在脑缺血/再灌注过程中起保护作用还是损伤作用,至今仍不明确。本实验以对脑缺血损伤敏感的海马神经元为研究对象[3],通过检测神经元在缺血缺氧/再灌注不同阶段自噬的表达,探讨自噬在神经元缺血缺氧/再灌注过程中的作用及其可能机制。
1 材料与方法
1.1 主要试剂与溶液
3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT),多聚-D-赖氨酸,3-甲基腺嘌呤(3-MA)为Sigma公司产品。Neurobasal Medium A,B27,L-谷氨酸,DMEM高糖培养基为Gibco公司产品。LC3B为Cell Signaling公司产品。其余试剂均为市售分析纯,其中0.01 mmol/L磷酸盐缓冲液(PBS,mmol/L):NaCl 136.75 ,KCl 2.68 ,Na2HPO44.02 ,KH2P041.76 ,pH 7.4。
1.2 海马神经元原代培养
出生24h内的SD大鼠由浙江大学实验动物中心提供,经乙醇消毒后断头取脑,无菌条件下急性分离海马组织并去除脑膜和血管,在0.25%的胰酶中37℃消化20min。终止消化后,依次进行3次机械吹打以分离细胞,分别收集细胞悬液离心沉淀,再把细胞重悬于含20%体积分数的B27,青霉素链霉素双抗和0.2 mmol/L L-谷氨酰胺的Neurobasal培养基中,并于培养初期添加L-谷氨酸至终浓度为 0.2 mmol/L,然后种植在预先用多聚-D-赖氨酸包被过的24孔培养板中或玻璃片上。置于37℃,5%CO2饱和湿度培养箱内(Thermo公司,美国),每隔3 d进行半量换液,培养10d后的细胞用于实验。
1.3 神经元氧糖剥夺/再灌注
将培养基换为预先通以无氧混合气体(95%N2+5%CO2)30min的无糖培养液(mmol/L):NaCl 137,KCl 5.4,CaCl21.8 ,MgSO40.8 ,HEPES 10,pH 7.4。然后将细胞立即置于通有无氧混合气体的密闭容器中,37℃、饱和湿度条件下培养2 h。正常对照组细胞的培养液则换成添加5 mmol/L葡萄糖的细胞外液后置于培养箱内培养。在达到设定的神经元氧糖剥夺/再灌注(oxygen-glucose deprivation/reperfusion,OGD/R)时间后,把细胞外液换回Neurobasal培养基,在培养箱内继续培养。根据需要,3-MA用PBS溶解,于氧糖剥夺前1 h加入,使3-MA终浓度为5 mmol/L。
1.4 细胞存活度检测
OGD/R结束后,在培养孔中加入0.5 mg/ml的MTT与神经元在37℃共同孵育4h,弃上清后每孔加入400μl的二甲基亚砜溶解甲瓒,利用酶标仪(Tecan公司,瑞士)在490nm波长下测定甲瓒的吸光度值,以此反映细胞存活度。以正常对照组的细胞存活度为100%,OGD/R组细胞存活度(%)=OGD/R组吸光度值/对照组吸光度值×100%。
1.5 自噬体检测
OGD/R处理后的细胞,用0.25%的胰蛋白酶消化液消化,待光镜下见细胞回缩,胞体变圆,细胞间隙变大时,立即加入胎牛血清终止消化,经1000r/min×10min离心沉淀,收集细胞于离心管内,弃上清后,用2.5%戊二醛4℃固定。固定后的细胞用0.1 mol/L PBS冲洗两次,每次15 min,1%锇酸4℃后固定1 h。0.1 mol/L PBS冲洗两次,每次15 min,2%醋酸铀水溶液染色30min,50%、70%、90%酒精依次脱水各15 min,100%酒精脱水20min,100%丙酮脱水20min两次。渗透无水丙酮与包埋剂按1∶1体积混合渗透组织并振荡2 h,纯包埋剂渗透组织并振荡1.5~2 h,纯包埋剂包埋,并置于37℃烘箱内聚合24h。超薄切片用铜网固定,用PHILIPS2 TECNA I 10透射电镜80kV观察并照相。
1.6 LC3B表达检测
大鼠海马神经元经氧糖剥夺/再灌注处理后,于盖玻片上用冰甲醇(-20℃)固定细胞5 min,固定的细胞用PBS冲洗两次后,加入0.25%Triton-X 100,冰上放置5 min,PBS冲洗2次,然后加入5%牛血清白蛋白(bovine serum albumin,BSA)处理30min,加入1%BSA稀释的兔抗鼠MAP1-LC3B(1∶200),4℃孵育过夜,次日用PBS冲洗3次后,加入TRITC标记的羊抗兔IgG(0.01 mol/L PBS以1∶200的比例稀释),室温下避光孵育2 h,PBS再次洗涤细胞后,用5μg/ml DAPI室温下细胞核DNA染色 30min,荧光显微镜(OLYMPUS公司,日本)下观察LC3B的表达。
1.7 自噬抑制剂的作用
3-MA用PBS溶解,储存浓度为100mmol/L,其冷却时有沉淀,使用前加热使之溶解。于氧糖剥夺前1 h加入,使3-MA终浓度为5 mmol/L。
1.8 数据处理
2 结果
2.1 OGD/R对神经元存活率的影响
与正常对照组相比,培养的海马神经元经OGD/R处理后,细胞存活率显著降低(P<0.05)。自噬抑制剂3-MA(5 mmol/L)对正常对照神经元的细胞存活率影响甚微,在OGD前1 h用3-MA处理细胞,神经元的死亡率与对照组相比均有不同程度的增加,且都具有显著性差异(P<0.05,图1B)。表明OGD/R处理对神经元有损伤作用,而自噬则可能起到对抗此损伤的作用(图1,表1)。
2.2 OGD/R对海马神经元自噬的影响
OGD 2 h的神经元胞质内即出现双层膜的自噬体结构,分别经再灌注不同时间的神经元胞质中也充满了自噬泡,其内含有变性的胞质成分及被消化降解后形成的髓鞘样结构(图2)。表明OGD/R处理诱导了自噬的发生。

Fig.1 Effect of OGD/R on rat hippocampal neurons viability without 3-MA(A)and pretreated with 3-MA(B)(,n=8)

Fig.2 Autophagosomes in OGD/R treated rat hippocampal neurons during different reperfusion time detected by transmission electronic microscopy(×6.2 k).
Tab.1 Effects of OGD/R on rats hippocampal neurons viability without 3-MA and pretreated with 3-MA(,n=8)

Tab.1 Effects of OGD/R on rats hippocampal neurons viability without 3-MA and pretreated with 3-MA(,n=8)
*P<0.05 vs control
Group Control R 0h R 2 h R 4h R 6 h R 12 h R 24h R 48 h 3-MA(-)(%) 100±066.04±0.02*66.51±0.02*65.98±0.01*68.15±0.02*79.74±0.03*70.01±0.02*88.87±0.02*3-MA(+)(%)100±052.87±0.02*43.51±0.01*38.27±0.01*37.58±0.02*44.85±0.02*45.12±0.02*39.46±0.03*
2.3 OGD/R对海马神经元自噬特异性蛋白LC3B的影响
在荧光显微镜下,经红色荧光TRITC标记的自噬特异性蛋白LC3B在OGD期间就已经存在(图3)。LC3B红色荧光呈点状散在分布于细胞膜附近,此变化一直持续到再灌注48 h,而对照组只有极弱的荧光。再灌注0h至48 h各组LC3B荧光阳性细胞数与对照组相比均有显著增加,且都具有显著性差异(P<0.05,图4)。但再灌注各组间无显著性差异。表明OGD/R处理诱导了自噬的发生,且在再灌注的0h至48 h时间段中,自噬呈持续性高度发生。
3 讨论
缺血性脑中风是临床常见病、多发病,死亡率及致残率极高,缺血缺氧/再灌注损伤涉及极其复杂的病理生理过程,其中各个环节、各种影响因素的相互作用尚未完全阐明,研究此类疾病的机制具有重要的临床意义。神经元是神经系统的基本功能单位,是脑缺血损伤保护的核心所在。氧糖缺乏是脑缺血产生损伤的两个基本因素,脑细胞的损害在本质上主要是脑组织氧糖缺乏而引起的一系列事件的结果。本实验用体外氧糖剥夺/再灌注模型来模拟体内缺血/再灌注损伤。结果显示大鼠海马神经元氧糖剥夺处理2 h后,再灌注过程中细胞活力明显降低。
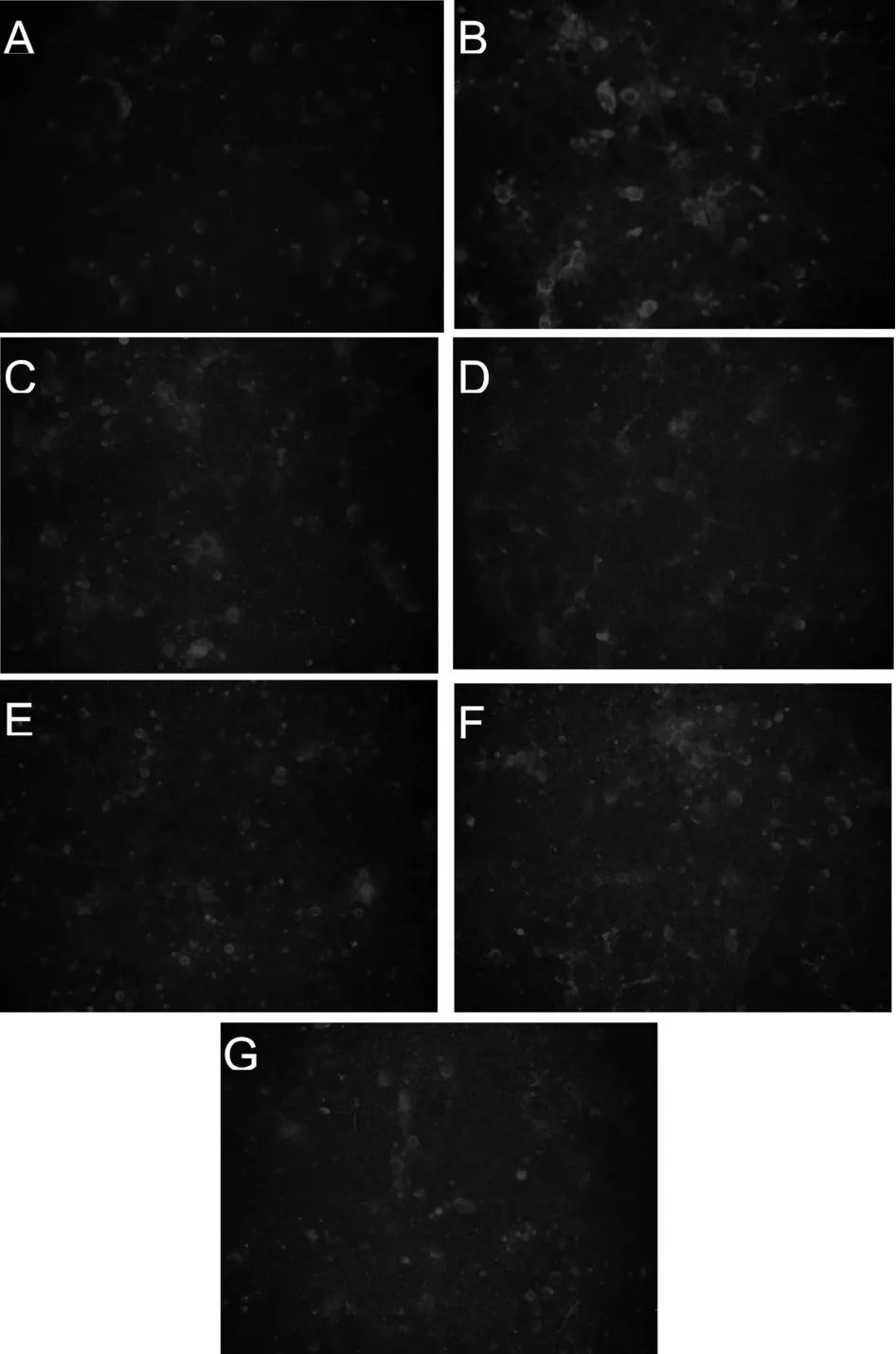
Fig.3 LC3B(red fluorescense)in OGD/R treated rat hippocampal neurons during different reperfusion time detected by immunofluorescense microscopy

Fig.4 LC3B fluorescense cell rate in OGD/R treated rat hippocampal neurons during different reperfusion time(,n=8)
细胞死亡是指细胞生命活动的终止与消亡。在多细胞生物中,一直认为细胞死亡有两种不同的形式,一种是细胞坏死,它是由于某些外界因素,如局部贫血、物理化学损伤或生物的侵袭等造成细胞急速死亡;另一种称为程序性细胞死亡,凋亡只是程序性细胞死亡的方式之一,自噬被称为Ⅱ型程序性细胞死亡[4]。自噬既广泛存在于正常的生理过程中,如清除细胞废物、结构重建、生长分化等,又是细胞对不良环境的一种防御机制,如对抗营养缺乏、电离辐射,同时还参与多种疾病的病理过程,无论是自噬过度还是自噬不足都可能导致疾病发生。自噬现象最早是由电镜观察发现的,迄今为止,电镜也是检测自噬最可靠的方法[5]。自噬主要包括4个环节,即底物诱导自噬前体的形成、自噬体形成、自噬体与溶酶体融合和自噬体内容物被降解[6]。自噬在不同的发生阶段具有其形态学特点。自噬起始时,细胞质内出现许多游离双层膜结构,并逐渐形成杯状凹陷,这些结构称为自噬前体。自噬前体逐渐延伸,包裹细胞质或损伤的细胞器形成泡状结构,称为自噬体。自噬体膜的来源还不十分清楚,内质网、高尔基体、线粒体内膜和外膜等多种来源的膜结构均为自噬体的形成提供了脂质[7]。自噬体多位于细胞核周围以及线粒体和粗面内质网附近。自噬体的外膜与溶酶体膜融合,内膜及其所包裹的物质进入溶酶体腔,形成自噬溶酶体。自噬溶酶体多呈圆形,内含单层膜包被的自噬体。进入溶酶体中的底物被降解后,所生成的脂肪酸和氨基酸可被重新用于细胞的能量代谢和蛋白质合成[8]。本实验用透射电镜方法检测证实了缺血缺氧/再灌注后自噬体的形成,是自噬被激活的直接证据。微管相关蛋白质1轻链(3MAP1-LC3)是哺乳动物自噬体形成相关蛋白,在自噬过程中经过翻译后修饰形成三种 LC3同工型:LC3A,LC3B和LC3C[9]。本实验中我们用LC3B这个自噬标记物,进一步证实了缺血缺氧/再灌注后自噬体的形成,自噬被激活。由免疫荧光结果可以看出,在正常状态下自噬的发生率非常低,缺血处理及缺血/再灌注处理均能显著诱导细胞自噬。在本实验中,从缺血结束到再灌注48h均有大量细胞发生自噬。这是细胞对外界损伤的一种反应。3-甲基腺嘌呤(3-MA)是磷脂酰肌醇3激酶(PI3K)的抑制剂,可促进溶酶体碱化,导致自噬体不能与溶酶体融合而特异性阻断自噬的发生[10]。本实验应用3-MA后缺血缺氧/再灌注的各组神经元存活率均显著下降,由此推断自噬可能在缺血/再灌注过程中对神经元有保护作用。并可以推断PI3K/PKB通路在自噬过程中发挥作用,其调节机制有待进一步研究。
在缺血缺氧/再灌注应激情况下,细胞启动自噬机制来清除受损线粒体,避免凋亡因子释放进入胞质,同时提高细胞对低氧的耐受力,对细胞起到一定保护作用。本实验结果初步表明,在神经元缺血缺氧/再灌注后自噬被激活并可能对受损的细胞起保护作用。但自噬是否会导致缺血缺氧/再灌注神经元的自噬性程序性死亡,及自噬性程序性死亡与凋亡及坏死的关系,仍有待于进一步探讨。本实验结果提示,在临床治疗缺血性脑中风过程中,要充分考虑细胞自噬的存在,充分发挥自噬对细胞存活有利的一面,以提高对缺血性脑中风的治疗手段。
[1]Bates B,Hirt L,Thomas S S,et al.Neurotrophin-3 promotes cell death induced in cerebral ischemia,oxygen-glucose deprivation,and oxidative stress:possible involvement of oxygenfree radicals[J].Neurobiol Dis,2002,9(1):24-37.
[2]Young A R,Chan E Y,Hu X W,et al.Starvation and ULK1-dependent cycling of mammalian Atg9 between the TGN and endosomes[J].J Cell Sci,2006,119(Pt18):3888-3900.
[3]刘红梅,佟振清,张敬东,等.大鼠全脑缺血后海马CA1区锥体细胞DND的实验研究[J].中国应用生理生理学杂志,1998,14(3):201-204.
[4]Levine B,Kroemer G.Autophagy in the pathogenesis of di-sease[J].Cell,2008,132(1):27-42.
[5]Mizushima N:Methods for monitoring autophagy[J].Int J Biochem CellBiol,2004,36(12):2491-2502.
[6]Reggiori F,Wang C W,Nair U,et al.Early stages of the secretory pathway,but not endosomes,are required for Cvt vesicle and autophagosome assembly in Saccharomyces cerevisiae[J].MolBiol Cell,2004,15(5):2189-2204.
[7]Juhasz G,Neufeld T P.Autophagy:a forty-year search for a missing membrane source[J].PLoS Biol,2006,4(2):e36.
[8]VenugopalB,MesiresN T,Kennedy J C,et al.Chaperonemediated autophagy is defective inmucolipidosis type IV[J].J Cell Physiol,2009,219(2):344-353.
[9]Kabeya Y,Mizushima N,Ueno T,et al.LC3,a mammalian homologue of yeast Apg8p,is localized in autophagosome membranes after processing[J].EMBO J,2000,19(21):5720-5728.
[10]Blommaart E F,Krause U,Schellens J P,et al.The phosphatidylinositol 3-kinase inhibitorswortmannin and LY294002 inhibit autophagy in isolated rat hepatocytes[J].Eur J Biochem,1997,243(1-2):240-246.

