高原脑水肿患者血浆的蛋白质组学研究*
张元元,段瑞峰,汪 海
(军事医学科学院卫生学环境医学研究所心血管管物研究中心,北京 100850)
高原脑水肿是一种严重的高原地区特发病,发病急、病情重。机体快速暴露于高原低氧环境后,因机体缺氧导致脑循环严重障碍而产生脑细胞水肿,产生严重的脑功能障碍和意识丧失,某些病例可并发肺水肿。高原脑水肿的发病主要因素是急性高原低氧暴露、劳累、寒冷、呼吸道感染、精神剧变等,个人的易感性也是高原脑水肿发病的重要因素[1]。高原脑水肿的发病机制尚不十分清楚。一般认为高原低氧暴露导致血氧分压下降,造成脑细胞肿胀及血管内液外渗。脑细胞代谢障碍,能量供应不足,细胞膜钠-钾泵功能失常,钠与水进入细胞内造成细胞肿胀、细胞外间隙减少;脑微血管内皮细胞受损,微血管通透性增加,液体渗出;脑血管扩张和脑血流量增加,脑循环内流体静脉压升高,引起液体外渗。高原脑水肿形成后,若进一步发展,使颅内压升高可压迫血管,脑血管受压以及血管内皮细胞肿胀均可影响脑血液循环,从而加重脑的缺氧,形成恶性循环[2]。
目前高原脑水肿发病机制仍然不清楚,对高原脑水肿易感者的早期预测和诊断缺乏有效的生化指标。因此研究脑水肿发病的分子机制、寻找疾病诊断标志物具有重要意义。近年蛋白质组学技术的应用为研究疾病发病机制、寻找适宜的生物标志物提供了可能[3]。本实验首次将蛋白质组学技术应用于高原脑水肿分子机制的研究中,采用蛋白质组学经典技术二维双向凝胶电泳结合质谱技术探讨了一例高原脑水肿患者与高原肺水肿和急性高原反应患者血浆蛋白表达的变化,结果发现载脂蛋白 E(apolipoprotein E,apo E)表达均发生变化。该蛋白的发现对于研究高原脑水肿发病分子机制具有重要意义。
1 材料与方法
1.1 样本收集
人员急进海拔4000m左右玉树地区执行任务时,一例发生高原肺水肿并发脑水肿(high-altitude cerebral edema,HACE),另选高原肺水肿(high-altitude pulmonary edema,HAPE)和急性高原反应(mild acute mountain sickness,mAMS)血浆样本各一例与高原肺水肿并发脑水肿进行血浆蛋白质组分析(表1)。取研究对象发病后七日内静脉血5 ml,肝素钠抗凝,室温放置 15 min,2000r/min 离心10min,吸取上层血浆,保存于-70℃冰箱备用。
Tab.1 Characteristics of plasma sample used for 2D in this study()
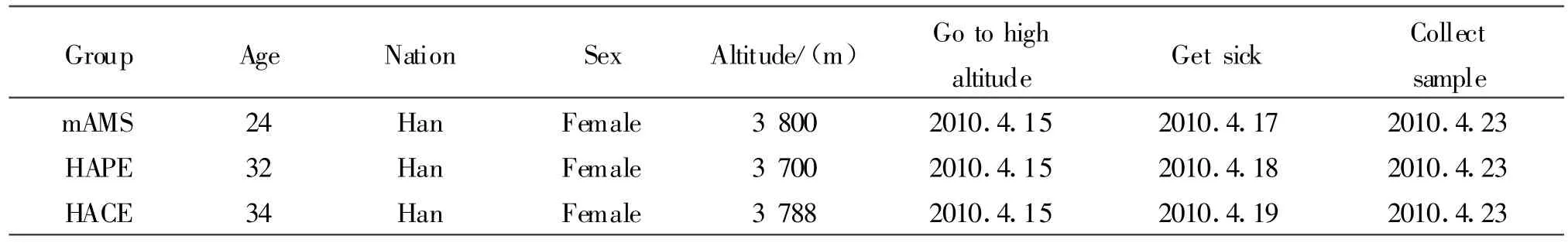
Tab.1 Characteristics of plasma sample used for 2D in this study()
Group Age Nation Sex Altitude/(m) Go to high altitude Get sick Collect sample mAMS 24 Han Female 3800 2010.4.15 2010.4.17 2010.4.23 HAPE 32 Han Female 3700 2010.4.15 2010.4.18 2010.4.23 HACE 34 Han Female 3788 2010.4.15 2010.4.19 2010.4.23
1.2 试剂和仪器
硫脲、二硫苏糖醇(DTT)、碘乙酰胺、CHAPS、IPG buffer(pH3~10)、固相pH梯度干胶条(IPGstrip pH 4-7,24 cm)、蛋白银染试剂盒、丙烯酰胺、甲叉双丙烯酰胺、Tris、SDS、DNA酶、双向凝胶电泳蛋白质标准品均购自GE公司;Bradford蛋白定量试剂盒(博迈德);IPGphorⅢ等电聚焦仪、Ettan DALTⅡ垂直平板电泳系统、Image Master 2D Platinum 6.0凝胶图像分析软件、Imagescanner扫描仪、Labscan扫描控制和分析前处理软件为GE公司产品。
1.3 试剂盒去除高丰度蛋白
血浆样本置于4℃融解,ProteoPrepRBlue Albumin and IgG Depletion Kit(Sigma)去除血浆中白蛋白和免疫球蛋白。70μl平衡缓冲液与30μl原血浆混合后加入平衡好的柱子中,室温放置10min,其余步骤均按照试剂盒说明书严格进行。将去除白蛋白和免疫球蛋白后的血浆收集到样品管中,结合在柱子上的白蛋白和免疫球蛋白用试剂盒中Type4试剂洗脱到离心管中。Bradford法测定去除白蛋白和免疫球蛋白后血浆蛋白质浓度。
1.4 二维凝胶电泳及染色
第一向等电聚焦电泳:250μg去除白蛋白和免疫球蛋白后的血浆样本与水化液(7 mol/L urea,2 mol/L thiourea,2%(w/v)CHAPS,0.3%(w/v)DTT,0.5%(v/v)IPG Buffer)混合后总体积为 450μl,4℃放置1 h。将混合液加入标准胶条槽中并放入24 cm,pH 4-7线性IPG干胶条,加入矿物油覆盖。在Ettan IPGphorⅢ等电聚焦系统上进行IEF电泳,程序设置如下:30V,12 h;200V,1 h;500V,1 h;1000V~10000V,1 h;10000V,60000Vh到结束。将等电聚焦后的固相 pH梯度胶条放入15 ml平衡液(1.5 mol/L Tris,6 mol/L 脲,30%甘油,2%SDS ,微量溴酚蓝)中,于摇床上震荡2×15 min。其中,第一种平衡液中含有1%DTT,而第二种平衡液中代之以2.5%碘乙酰胺。
第二向SDS-PAGE:配制10%的均匀SDS-聚丙烯酰胺凝胶,将平衡后的IPG胶条移至凝胶的上方,0.5%低熔点琼脂糖封胶,上下电泳槽中加入电极缓冲液,初始功率为每块胶1 W,电泳1 h后改为每块胶10W直到溴酚蓝到达凝胶最底端停止电泳,采用质谱兼容的硝酸银染色法进行染色。用LabScan扫描仪以投射方式、300dpi扫描获取mell格式的图像文件。
1.5 差异分析和质谱鉴定
将保存的凝胶图像文件导入ImageMaster 2D Platinum 6.0软件系统进行分析,主要包括图像加工、蛋白质斑点检测与定量、凝胶匹配、数据分析等过程。1.5 mg蛋白进行双向凝胶电泳分离后采用热考马斯亮兰染色,将双向电泳胶上经热考马斯亮蓝染色的斑点用刀片切下,切成1 mm×1 mm的胶块,置于 Eppendorf管中,用 100μl 50%乙腈/100mmol/L碳酸氢铵洗涤20min重复2~3次,至脱色干净。脱色后的胶片置于真空干燥器中干燥20min,然后加入10ng/μl的胰蛋白酶液(25 mmol/L碳酸氢铵溶液,pH 8.0)5~ 10μl,置于4℃冰箱放置40min使胶片完全吸收酶液,再补加10μl 25 mmol/L碳酸氢铵缓冲液,于37℃温育过夜。用5%TFA 50~100μl于 40℃提取酶切肽段 1 count/h,再用相同体积的50%ACN/2.5%TFA溶液于30℃提取1 count/h,最后用 50μl ACN超声提取一次,合并 3次提取液,用真空干燥器进行干燥。干燥后的样品用3-5μl 0.1%的甲酸溶液溶解。而后用基质辅助激光解吸电离-飞行时间质谱(matrix assisted laser desorption/ionization time of flight mass spectrometry,MALDI-TOF-MS)进行分析。将质谱鉴定所得肽质量指纹图谱(peptide mass fingerprinting,PMF)数据于数据库中查询,数据库检索程序根据输入的蛋白质等电点、分子质量范围及肽质量指纹谱数据和其他一些参数在数据库中寻找与这些参数相匹配的蛋白质,检索数据库为http://www.matrixscience.com。
1.6 ELISA验证
采用人血液ELISA试剂盒(R&D公司,USA)对apo E进行定量,验证双向凝胶电泳结果。所有操作均按照试剂盒说明书进行。
2 结果
2.1 高原肺水肿并发脑水肿与高原肺水肿血浆蛋白质图谱比较
对1例高原脑水肿与1例高原肺水肿的血浆蛋白质进行二维凝胶电泳分析,每一样品同时跑6块双向电泳凝胶,经银染显色后采用LabScanner扫描仪扫描获取图像,将图像保存为mell格式,导入ImageMaster 2D Platinum 6.0软件,对凝胶图谱进行计算机匹配分析,匹配率>60%。寻找两血浆样品比较中表达丰度差异在2倍以上的蛋白质点,发现高原脑水肿与高原肺水肿比较时,发生变化的蛋白质点有6个,它们在高原脑水肿样本中表达均下调(图1)。
2.2 高原肺水肿并发脑水肿与急性高原反应患者血浆蛋白质图谱比较
用相同方法对1例高原脑水肿与1例急性高原反应患者的血浆蛋白质进行二维凝胶电泳分析,发现有6个蛋白质点发生变化,在高原脑水肿样本中点12下调,其余上调(图2)。
2.3 质谱鉴定结果
切取胶上的12个相应的差异蛋白质点,经胶内原位酶解后进行MALDI-TDF-MS测定,选用Mascot软件搜索NCBInr数据库,鉴定各蛋白质点(表2)。

Fig.1 Differential expression of proteins from serum samples between the HACE and HAPE.Proteins were separated by 2D PAGE(the first dimension,24 cm,pH 4-7,linear gradient of IPG strips;the second dimension,12.5%SDS-PAGE)and visualized by Silver staining.The numbered arrows indicated corresponding differentially expressed protein spots between the HACE and HAPE
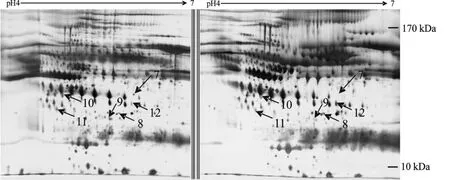
Fig.2 Differential expression of proteins from plasma samples between the HACE and mAMS.Proteins were separated by 2D PAGE(the first dimension,24 cm,pH 4-7,linear gradientof IPG strips;the second dimension,12.5%SDS-PAGE)and visualized by silver staining.The numbered spots indicated corresponding differentially expressed protein spots between the HACE and mAMS
2.4 ELISA检测载脂蛋白E结果
ELISA检测apo E在高原脑水肿、高原肺水肿和急性高原反应患者血浆中含量,测得波长450nm条件下A(光密度值)分别为1.523、2.595和0.537,以上结果验证了蛋白质双向电泳的结果。
3 讨论
一般认为高原脑水肿是急性高山病的晚期阶段,共济失调、意识改变为其临床特征[4],诊断治疗不及时可能发展为昏迷甚至死亡。高原脑水肿发病时可见神经精神体征方面明显改变,如剧烈头痛、呕吐、表情淡漠、精神抑郁或欣快多语、烦躁不安、共济失调等,随之神智恍惚、意识蒙、嗜睡、昏睡,甚至昏迷等,可出现肢体功能障碍,脑CT和核磁共振提示高原脑水肿与不可逆的脑皮质性痴呆有因果关系[5]。高原肺水肿并发高原脑水肿患者精神神经病学后遗症发生率为21.5%,其中痴呆为21.8%[6]。
二维凝胶电泳结合质谱技术是一种寻找差异蛋白质的高通量的方法,广泛应用于心血管疾病的研究中。应用蛋白质组学技术,可以更有效地在血浆中寻找疾病相关标志物,为疾病的预防、诊断及治疗提供重要的依据。本实验首次将蛋白质组学技术应用于高原脑水肿研究中,应用二维凝胶电泳结合质谱鉴定的技术,得到可能与高原脑水肿发病相关的蛋白质。结果显示与高原肺水肿、急性高原反应发病者比较,高原脑水肿患者血浆载apo E均发生变化。
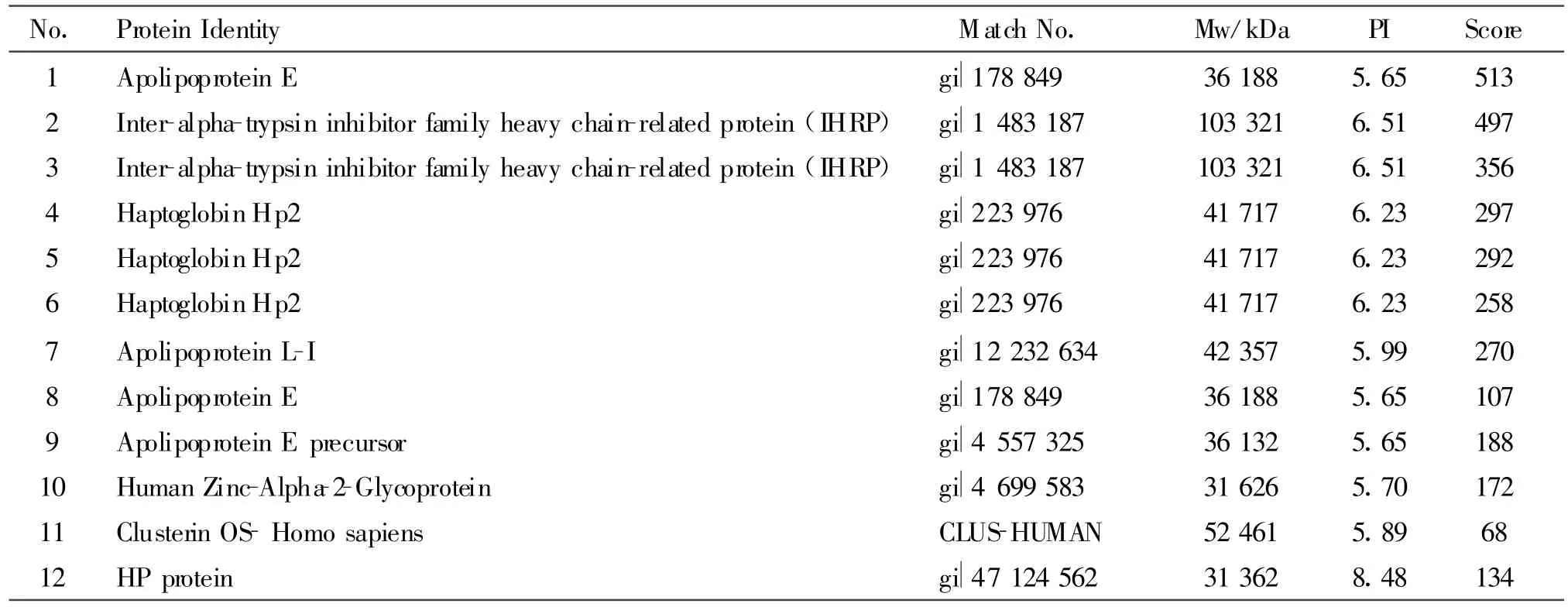
Tab.2 Identification of the eight differentially expressed proteins among HACE and mAMS groups
载脂蛋白E是一种多态性蛋白质,相对分子质量为37 kDa。apo E主要在肝脏和大脑中合成,中枢神经系统中主要是脑星形胶质细胞,外周神经系统则由巨噬细胞参与合成。apo E的主要功能是通过低密度脂蛋白(LDL)受体介导的摄入、极低密度脂蛋白(VLDL)内甘油A酯的水解、VLDL分泌及VLDL向LDL的转化等[7]参与机体脂质代谢。在中枢神经系统中apo E参与神经细胞膜修复、再生长与维持。创伤性脑损伤后,apo E蛋白表达强度在大鼠和人脑中均较对照组有显著性增强,这表明当中枢神经系统受损时,apo E蛋白表达量越多,损伤越重,可能通过转运胆固醇和磷脂到损伤神经元内促进细胞修复。apo E基因有三种等位基因形式:ε 2,ε 3和ε 4,ε 3 为最常见的等位基因[8]。诸多研究表明,apo E基因及其多态性和多种疾病的发生有密切关系。近年来,apo E的不同基因型对心血管病影响已得到公认,而对脑血管病的作用尚存在争议。在众多研究中,普遍认同的是ε 2与ε 4等位基因是缺血性脑血管病发作易感性的遗传标志。apo E ε 4等位基因不仅与阿尔茨海默病AD的发病密切相关,也影响AD的进展和病理过程,其在发病中的作用机制至今仍不十分清楚,可能通过与β/A4肽结合而促进其沉积,进而促进老年斑的形成[9]。也有研究发现,ε 2有明显的保护性效应[10]。有关apo E多态性在其它神经系统疾病中的作用,观点也存在分歧,但诸多学者均认为存在相关性。本实验中发现高原脑水肿并发肺水肿和高原肺水肿患者血浆中apo E含量明显高于急性高原反应患者,但是高原脑水肿并发肺水肿患者血浆中apo E含量低于高原肺水肿患者血浆含量这可能与不同个体apo E表达亚型不同,对中枢神经发挥作用不同,而其亚型表达的不同与高原脑水肿发病的关系有待进一步的研究。
高原脑水肿患者存在不同程度的精神变化,严重者无法完全恢复,出现痴呆、失语、记忆障碍等后遗症。apo E与脑血管疾病和神经系统疾病具有密切的关系,提示脑内脂蛋白代谢紊乱很可能与高原脑水肿发病时认知功能障碍及后遗症痴呆的发生有关。然而,由于高原脑水肿样本较少,因此apo E和其它蛋白质是否可以作为生物标志物,对疾病的预防、诊断及治疗的意义需要在新的样本以及后续的实验中不断研究。
[1]Roach R C,Hackett P H.Frontiers of hypoxia research:acute mountain sickness[J].Exp Biol,2001,204(18):3161-3170.
[2]Hackett P H,Roach R C.High altitude cerebral edema[J].High Alt Med Biol,2004,5(2):136-146.
[3]Baumann S,Ceglarek U,Fiedler M G,et al.Standardized approach to proteome profiling of human serum based onmagnetic bead separation and matrix-assisted laser desorption/ionization time of flight mass spectrometry[J].Clin Chem,2005,51(6):973-980.
[4]West J B.The physiologic basis of high altitude diseases[J].Ann Intern Med,2004,141(10):780-800.
[5]Fukushima M,Kobayashi T,Kubo K,et al.A case of high altitude pulmonary edema followed by brain computerized tomography and electroencephalogram[J].Aviat Space Environ Med,1988,59(1):1076-1079.
[6]孔 晟,叶平安,马丽慧,等.影响高原肺水肿预后因素[J].高原医学杂志,1988,8(4):37-39.
[7]Srinivasan S R,Ehnholm C,Elkasabany A ,et al.Influence of apolipoprotein E polymorphism on serum lipids and lipoprotein changesfrom childhoodto adulthood:the BogalusaHeart Study[J].Atherosclerosis,1999,143:435-443.
[8]Mahley R W.Apolipoprotein E:cholesterol transport protein with expanding role in cell biology[J].Sci,1988,240:622-630.
[9]Craft S,Tefi L,Edland S D,et al.Accelerated decline in apolipoprotein E-epsilon4homozygotes with Alzheimer's disease[J].Neurol,1998,5l(1):149-153.
[10]Rubinsztein D C,Hon J,StevensF,et al.Apo Egenotypes and risk of dementia in Down's syndrome[J].Am J Med Gene,1999,88(4):1-3.
——过敏性休克和肺水肿的抢救流程

