虫草素对胰腺癌BxPc-3、BxPc3-LN5细胞株增殖抑制作用的研究*
许文彦 龙江 唐亮 吴明生 张倩 倪泉兴 虞先濬
(1.复旦大学附属肿瘤医院,上海200032;2.上海国宝企业发展中心,上海200001)
胰腺癌是一种较常见的恶性肿瘤。在我国胰腺癌的发病率也有逐年增多趋势,90%的患者在诊断后1年内死亡,1年生存率仅为1%~3%。药物治疗是重要的治疗手段之一,它能明显延长患者的生存时间,提高患者的生存质量。虫草素即3-脱氧腺苷(3-deoxyadenosine),为含氮配糖体的核酸衍生物,属嘌呤类生物碱,是一种核苷类抗生素,最早由Cunningham于1951年在蛹虫草(Cordyceps militaris)原浆液中分离得到,该成分后被证实为我国中草药冬虫夏草(Cordyceps sinensis)的有效成分[1]。分子式为C10H13N5O3,相对分子质量为251,熔点为230~231℃,溶于水、热乙醇和甲醇,不溶于苯、乙醚和氯仿,紫外光的最大吸收波长为259nm[2]。研究证明虫草素能抑制mRNA合成,诱导肿瘤细胞凋亡[3],使细胞分化,从而对多种肿瘤细胞的生长有抑制作用[4-9]。本文采用四甲基噻唑蓝比色法(MTT比色法)研究虫草素对胰腺癌细胞株BxPc3、BxPc3-LN5的生长抑制作用,为虫草素是否可用于胰腺癌临床化疗进行理论探讨。
1 材料与方法
1.1 细胞
人胰腺癌细胞株BxPc3购买自中国科学院上海生命科学研究院细胞库中心。BxPc3-LN5是人原位胰腺腺癌细胞BxPc3在裸鼠体内多次细胞注射成瘤后取裸鼠转移淋巴结原代培养所得。所有细胞株在含有10%胎牛血清的RPMI Medium 1640(RPMI 1640)+Dulbecco’s modified Eagle Medium(DMEM)各半的培养基中(pH7.2),并置于37℃、饱和湿度和5%CO2孵育箱内培养传代。
1.2 药物
四甲基噻唑蓝(MTT)、DMSO购买自Sigma公司;RPMI1640培养基、血清购自Hyclone公司;虫草素来自上海国宝企业发展中心,纯度为99.9%。
1.3 细胞培养
将冻存的人胰腺癌细胞株BxPc3、BxPc3-LN5从液氮罐中取出。细胞常规复苏及传代。取对数生长期的BxPc3、BxPc3-LN5细胞株,配制成1×107/mL单细胞悬液,接种于96孔培养板,每孔0.1mL。
1.4 MTT检测
实验组分别加入虫草素至培养孔中,质量浓度为10、20、40、80、160μg/mL,每个药物质量浓度设6个复孔,空白对照组不加药,置于37℃、饱和湿度、5%CO2条件下常规培养24h及48h,每孔加入20μL MTT(5mg/mL),再置培养箱内继续培养4h。吸弃上清液,每孔加入100μL DMSO振荡5min,用酶联仪(瑞士Tecan公司、Sunrise酶标仪)在492nm波长下测定各孔光吸收值(OD值),记录结果。细胞抑制率计算公式为:细胞抑制率=(空白对照组OD均值-药物组OD均值)/空白对照组OD均值× 100%。
1.5 统计学处理
用SPSS11.0软件进行方差分析。
2 结果
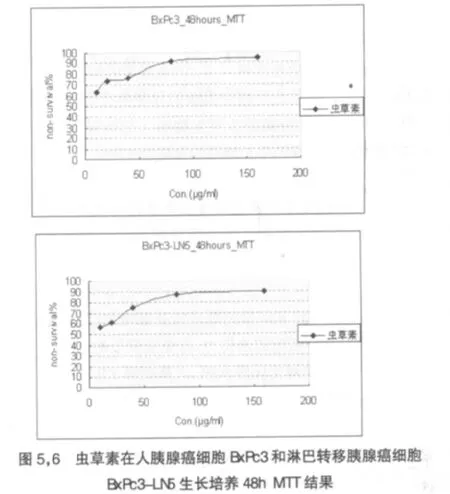
本次MTT实验显示,虫草素对于胰腺癌BxPc3以及淋巴转移胰腺癌BxPc3-LN5细胞株均具有一定的细胞毒效应。且细胞生长的抑制率都随着药物作用时间的延长及药物质量浓度的升高而增加。比较各组浓度的虫草素对于两株细胞在24h和48h末所产生的细胞抑制率,发现无论是BxPc3或是BxPc3-LN5,在48h末的细胞抑制率均高于其在24h末的抑制率。见图1,2。可以认为虫草素对于胰腺癌BxPc3、BxPc3-LN5细胞株的细胞抑制作用呈时间依赖性。
而比较两株细胞分别于24h与48h在不同浓度的虫草素作用时的细胞抑制率,发现随着虫草素剂量的升高,细胞的抑制率也随着上升,呈现一个明显的剂量依赖性。见图3~6。
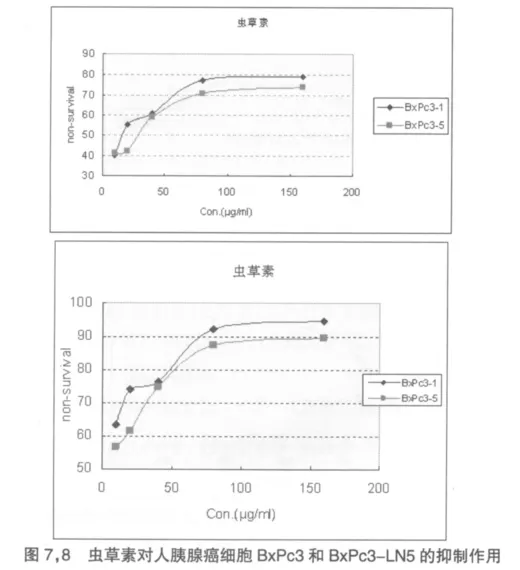
比较虫草素对于两株细胞的作用差别可以发现,无论在24h末或48h末,虫草素对于BxPc3细胞株的抑制作用均要略好于BxPc3-LN5细胞株。见图7,8。可能是因为BxPc3-LN5细胞株属于高转移潜能细胞株,其对于抗肿瘤药物的耐药性要高于原代细胞株。


3 讨论
近年来,尽管胰腺癌分子水平研究取得了显著进步,但5年生存率仍没有显著提高,较晚出现的临床症状、较低的手术切除率、较高的术后复发率以及对放化疗不敏感是造成这一状况的主要原因[10,11]。在胰腺癌的治疗方面,除了传统的手术、放疗与化疗,又出现了基因干扰和靶向治疗,使胰腺癌的防治工作有了突破性进展。同时应用中药进行综合调节治疗胰腺癌也成为近年研究的热点领域,中药复方或单味中药提取的有效成分在抑制肿瘤细胞增殖、侵袭、转移和诱导肿瘤细胞分化,促进凋亡以及逆转肿瘤细胞多药耐药、减毒增效等方面也有其独到的优势。
近年来研究发现,从中药中提取的一些生物碱类物质在肿瘤防治方面具有重要作用,如从紫唐松草和唐松草等的根中分离得到的唐松草碱和厚果唐松次碱对W256有显著的抑制作用,国外已进入临床研究[12]。从山豆根中提取的异喹啉类生物碱(蝙蝠葛碱)和从胡椒果实中分离的主要生物碱(胡椒碱)对CNE-1、CNE-2Z鼻咽癌细胞株的生长增殖均有抑制作用,并呈时间依赖性抑制[13]。
早在20世纪70年代就已发现虫草素具有抗肿瘤作用。目前现有的体内及体外实验认为虫草素抗肿瘤的机制是多方面的,主要是抑制DNA、RNA、蛋白质的合成,降低c-myc基因的mRNA表达,并可增强放疗及某些化疗药物的敏感性;并因其半衰期短,可联合腺苷脱氨酶抑制剂或羟基脲增加疗效;同时其可增强NK细胞对肿瘤细胞的杀伤力,有免疫调节的作用。
虫草素已被证实对艾氏腹水癌、人鼻咽癌KB细胞和人宫颈癌HeLa细胞等皆具有明显的抑制作用[14,15],对KB细胞的最低致毒质量浓度为(10~25)g/mL。Nakamura等[16]报道,虫草素通过激发肿瘤细胞中腺嘌呤核苷A3受体,可以抑制小鼠B16-BL6黑素瘤细胞和Lewis肺癌细胞的生长。但在胰腺癌方面,国内外未见报道。本研究结果显示,虫草素可以抑制胰腺癌BxPC3细胞株及其高转移潜能细胞株BxPC3-LN5的增殖。
根据药物量效反应曲线(dose-response curve),大多数抗癌药物在一定范围内其细胞杀伤作用有浓度依赖性,局部(准确地说是细胞内)药物浓度增加一倍杀灭细胞数可增加10倍左右[17]。本次MTT比色法结果显示,胰腺癌BxPc3、BxPc3-LN5细胞株对虫草素的作用都有较强的敏感性,随着虫草素浓度的增加以及作用时间的延长,细胞增殖抑制率出现明显增加。表明虫草素及其水提物对BxPc3及BxPc3-LN5的细胞毒作用在一定范围内呈剂量和时间依赖关系。目前,国内尚未见应用虫草素进行胰腺癌治疗的实验研究。我们本次实验发现,它具有明显抑制胰腺癌细胞株增殖的作用,显示出良好的对抗胰腺癌细胞效应,但虫草素产生的治疗胰腺癌的生物学效应的机制还有待进一步研究。
[1]李婧,姜汉英.虫草素的体内代谢特点及药理作用[J].国外医学:中医中药分册,2005,27(5):283-285.
[2]蔡友华,刘学铭.虫草素的研究与开发进展[J].中草药,2007,38(8):1269-1272.
[3]Wu Wc,Hsiao JR,Lian YY,et al.The apoptotic effect of cordycepin on human OEC-M1 oral cancer cell line[J].Cancer Chemother Pharmacol,2007,60(1):103-111.
[4]周纪宁,金浩,李永丰,等.抗肿瘤酶制剂L-天冬酰胺酶治疗白血病的研究进展[J].生物医学工程学杂志,2000,17(3):342-345.
[5]Yoshikawa N,Nakamura K,Yamaguchi Y,et al.Cordycepin and Cordyceps sinensis reduce the growth of human promyelocytic leukaemia cells through the Wnt signalling pathway[J].Clin Exp Pharmacol Physiol,2007,34(S1):S61-S63.
[6]田劭丹,李冬云,侯丽,等.冬虫夏草抗肿瘤研究进展[J].实用中医内科杂志,2006,20(1):7-9.
[7]都兴范,李亚杰,王林华,等.北冬虫夏草的研究发展现状[J].辽宁农业科学,2003,4:26-28.
[8]王雅玲,刘竞,刘阳,等.虫草素抗癌机理研究进展[J].安徽农业科学,2008,36(34):15046-15047,15113.
[9]吴庆光,赵珍东,王宗伟.冬虫夏草抗肿瘤作用研究进展[J].中医药导报,2005,11(6):80-82.
[10]Jemal A,Siegel R,Ward E,et al.Cancer statistics,2007[J].CA Cancer J Clin,2007,57(1):43-66.
[11]Pawlik TM,Gleisner AL,Cameron JL,et al.Prognostic relevance of lymph node ratio following pancreaticoduodenectomy for pancreatic cancer[J].Surgery,2007,141(5):610-618.
[12]李映丽,吕居娴,焦文旭,等.抗肿瘤的天然化合物[J].西北药学杂志,1994,9(6):257-260.
[13]管思明.蝙蝠葛碱对心肌电生理和肌浆网Ca2+-ATP酶的效应及其与汉防己甲素比较研究[J].中华心律失常学杂志,1999,3(4):286-289.
[14]何肇晴,李婧,程冬英,等.国产虫草素对HeLa细胞凋亡及细胞周期影响的实验研究[J].中华肿瘤杂志,2009,31(4):258-259.
[15]Thomadaki H,Scorilas A,Tsiapalis CM,et al.The role of cordycepin in cancer treatment via induction or inhibition of apoptosis:implication of polyadenylation in a cell type specific manner[J]. Cancer Chemother Pharmacol,2008,61(2):251-265.
[16]Nakamura K,Yoshikawa N,Yamaguchi Y,et al.Antitumor effect of cordycepin(3-deoxyadenosine)on mouse melanoma and lung carcinoma cells involves adenosine A3 receptor stimulation[J].Anticancer Res,2006,26(1A):43-47.
[17]Yamaue H,Tani M,Onishi H,et al.Locoregional chemotherapy for patients with pancreatic cancer intra-arterial adjuvant chemotherapy after pancreatectomy with portal vein resection[J].Pancreas,2002,25(4):366-372.

