黄鳝IRF-1和IRF-2保守序列的克隆与表达
顾琬雯,许巧情,宋 浪,李昊成,袁汉文 (长江大学动物科学学院,湖北荆州434025)
郝立平(湖北信息工程学校,湖北 荆门448124)
干扰素家族 (interferons,IFNs)是具有一系列多种功能的细胞因子,它们在抵抗病毒、调节细胞生长和调控免疫反应方面起着重要的作用。干扰素调节因子 (Interferon regulatory factors,IRFs)是在研究干扰素转录调控时发现的。迄今为止,在脊椎动物中共发现10种干扰素调节因子,即IRF-1~IRF-10。它们的主要作用是调节干扰素和干扰素诱导基因的表达[1]。此外,IRFs在造血细胞分化、免疫基因的调节中也发挥重要的作用[2],同时IRFs还参与Toll-like信号通路和其他的模式识别受体的免疫反应[3]。
鱼类作为一类非常重要的脊椎动物,对其免疫基因的研究有助于阐明其免疫机理和功能。目前,在鱼类中已经报道了几种IRFs的基因组结构和表达。例如IRF-1在虹鳟 (Oncorhynchusmykiss)[4]、大菱鲆 (Scophthalmusmaximus)[5]、鳜 (Sinipercachuatsi)[6],IRF-2 在虹鳟[4]和 鳜[7],IRF-3 在虹鳟[8],IRF-6在斑马鱼 (Daniorerio)[9],IRF-7在鳜[6]、虹鳟[8]和大西洋鲑 (Salmosalar)[10]中均有报道。而IRF-1和IRF-2在黄鳝 (Monopterusalbus)中尚未见任何报道。黄鳝集约化养殖程度大、种质资源退化、养殖水环境恶化,其病害的发生率愈来愈高,严重制约着黄鳝养殖业的发展,而加强对黄鳝免疫因子的研究可为黄鳝的疾病防治提供理论指导。
1 材料与方法
1.1 材料
受试黄鳝来自长江大学黄鳝养殖基地,体重约100g,在实验室暂养2~3d后用于试验。
1.2 黄鳝RNA的提取及反转录
取新鲜的脾脏、中肾、肠等混合组织共100mg,迅速加入Trizol,冰上放置或冷冻于-80℃中。使用Trizol®Reagents提取黄鳝组织总RNA。然后参照Fermentas公司的RevertAidTMFirst Strand cDNA Synthesis Kit的方法合成cDNA,分装保存于-20℃中。
1.3 黄鳝IRF-1和IRF-2cDNA中间序列的扩增
根据 NCBI上的鳜 (登录号为 AY647431.1)、大黄鱼 (Larimichthyscrocea,登录号为GU175707.2)、斜带石斑鱼 (Epinepheluscoioides,登录号为 GU988700.1)和大西洋鲑 (Salmosalar,登录号为CBL58209.1)IRF-1cDNA序列的保守部分设计简并引物IRF-1-F1和IRF-1-R1,扩增黄鳝IRF-1cDNA的中间序列 (登录号为JN695589)(表1);根据NCBI上的牙鲆 (Paralichthysolivaceus,登录号为JF312911.1)、虹鳟 (登录号为 NM _001124438.1)和斜带石斑鱼 (登录号为FJ828965.1)IRF-2cDNA序列的保守部分设计简并引物IRF-2-F1和IRF-2-R1,扩增黄鳝IRF-2cDNA的中间序列 (登录号为JN695590)(表1)。

表1 扩增IRF-1/IRF-2cDNA序列以及表达所用的引物
1.4 系统进化树的构建
利用NCBI上已有的蛋白序列和黄鳝4种IRFs蛋白序列构建系统进化树,各个物种蛋白序列的登录号见表2。进化树采用MEGA 4.0构建。
1.5 黄鳝不同组织和不同发育阶段IRF-1和IRF-2的表达
1.5.1 RNA的提取
在长江大学黄鳝养殖基地选取3个发育阶段 (雌性、间性和雄性)的黄鳝各3尾,在实验室暂养1周后分别取雌鳝、间性黄鳝、雄鳝的中肾和脾脏组织,迅速加入Trizol,冰上放置,使用Trizol®Reagents提取黄鳝组织总RNA,方法同1.2所述,所得样本作为研究不同发育阶段表达之用。取3尾暂养1周后的雄鳝,分别取其新鲜的性腺、肌肉、血液、皮肤、肠、中肾、脾脏、肝脏 脑各100mg,迅速加入Trizol,冰上放置,使用Trizol®Reagents提取黄鳝组织总RNA,方法也同1.2所述,所得样本作为研究不同组织表达之用。
1.5.2 RNA样品中DNA的处理
取2μl溶于DEPC水的RNA,1μl在紫外分光光度计上测出RNA样品的浓度,1μl进行电泳,根据所测RNA的浓度和电泳结果,取2μl总RNA用进行DNase I处理。反应体系为:RNA 2μg,10×DNase I Buffer 2μl,DNase I(RNase-free,1U/μl,Fermentas)2μl,RNase Inhibitor(40U/μl,Fermentas)1μl,DEPC-treated H2O直至20μl。将反应液短暂离心以混匀,PCR仪上37℃运行30min。然后向离心管加入1μl 25mmol/L EDTA处理65℃,然后立即置于冰上或者-80℃冻存。
1.5.3 cDNA模板的准备
参照Fermentas公司的RevertAidTMFirst Strand cDNA Synthesis Kit的方法合成cDNA,分装保存于-20℃中。
1.5.4 β-actin、IRF-1和IRF-2基因的扩增
利用已测序验证的IRF-1、IRF-2中间序列设计特异引物IRF-1-RT-F2、IRF-1-RT-R2和IRF-2-RT-F2、IRF-2-RT-R2,利用黄鳝β-actin基因 (登录号为AY345056.1)设计引物β-actin F和β-actin R。
分别采用β-actin F/β-actin R、IRF-1-RT-F2/IRF-1-RT-R2和IRF-2-RT-F2/IRF-2-RT-R2引物对上述9个组织或3个不同发育阶段的中肾和脾脏cDNA模板进行扩增。取β-actin PCR产物电泳,根据9个组织或不同发育阶段的中肾和脾脏电泳条带强弱调节PCR扩增后的模板加入体积,直至9个组织或不同发育阶段的中肾和脾脏6个样本的β-actin基因扩增条带亮度基本一致。按照同样体积的模板量进行IRF-1和IRF-2的电泳,揭示黄鳝不同发育阶段或不同组织IRF-1和IRF-2基因的表达情况。β-actin扩增程序为:95℃变性5min;94℃30s,56℃20s,72℃20s,运行25个循环;72℃延伸10min;IRF-1和IRF-2扩增程序均为:94℃ 变性5min;94℃30s,54℃30s,72℃30s,运行35个循环。
2 结果与分析
2.1 黄鳝IRF-1和IRF-2保守序列及分析
已扩增到的IRF-1cDNA长507bp(GenBank登录号:JN695589),编码168aa(图1)。IRF-2cDNA长794bp(GenBank登录号:JN695590),编码264aa(图2)。

图1 黄鳝IRF-1的核酸序列和推断的氨基酸序列 (登录号为JN695589)

图2 黄鳝IRF-2的核酸序列和推断的氨基酸序列 (登录号为JN695590)
利用NCBI上已有的蛋白序列和黄鳝4种IRFs蛋白序列,采用MEGA 4.0构建系统进化树,结果如图3。从图3可以看出,各种脊椎动物的IRF-2聚集在一起,成为一束,黄鳝IRF-2(MaIRF2)与斜带石斑鱼IRF-2(EcIRF2)最为接近;黄鳝IRF-1(MaIRF1)与鳜 (ScIRF1)和大黄鱼 (LcIRF1)最为接近,它们与大西洋鲑 (SsIRF1)和草鱼 (CiIRF1)聚集在一起,形成一大束,但斑马鱼IRF-1(DrIRF1)却与其他鱼类的IRF-1相距较远,而与所有生物的IRF-1和IRF-2聚合在一起,这说明从进化上讲IRF-1和IRF-2亲缘关系较近。
2.2 黄鳝不同发育阶段IRF-1和IRF-2的表达
IRF-1-RT-F2/IRF-1-RT-R2在黄鳝cDNA上扩增的片段大小为507bp,β-actin F/β-actin R扩增的片段长度为397bp(图4A)。从图4A可以看出,黄鳝3个不同的发育阶段即雌性、间性和雄性的中肾和脾脏组织IRF-1的表达量基本一致,无明显的差别。
IRF-2-RT-F2/IRF-2-RT-R2在黄鳝cDNA上扩增的片段大小为577bp,F/β-actin R扩增的片段长度为398bp(图4B)。图4B显示,黄鳝3个不同的发育阶段即雌性、间性和雄性的中肾和脾脏组织IRF-2的表达量基本一致,无明显的差别。
2.3 黄鳝不同组织IRF-1和IRF-2的表达
黄鳝性腺、肌肉、血液、皮肤、肠、中肾、脾脏、肝脏和脑等组织IRF-1和IRF-2的表达情况见图5,其中IRF-1血液、皮肤、肠、中肾和肝脏有明显清晰的条带,说明在这5种组织中表达量较高,其次为性腺、脾脏和脑,而肌肉中表达量很弱,基本看不到条带 (图5A)。中肾的IRF-2条带最清晰,说明IRF-2的表达量最高,其次为肠和脾脏,肝脏、脑、血液、皮肤和性腺IRF-2表达很弱,肌肉中基本看不到明显的扩增条带,说明IRF-2在肌肉中表达量很低 (图5B)。
3 讨论

图3 黄鳝IRF-1和IRF-2与其他脊椎动物IRF-1和IRF-2的进化关系
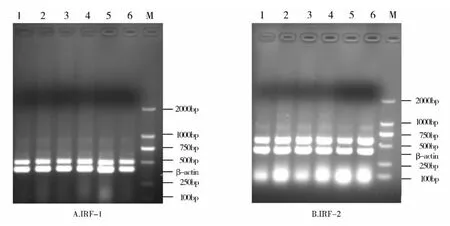
图4 黄鳝不同发育阶段IRF-1(A)和IRF-2(B)的表达
干扰素调节因子是调节干扰素以及干扰素相关基因的转录因子[11]。它们在结构特征上具有保守的序列特征,所有成员前115个氨基酸同源性较高,具有4~6个保守间隔排列的色氨酸,具有螺旋-转角-螺旋的DNA结合结构域 (DNA binding domain,DBD)[3]。IRF-1是发现的第一个能在体外激活I型干扰素的干扰素调节因子,最初研究表明:IRF-1能够结合到IFN-β启动子区域的正向调节区I,对IFN-β的转录起促进作用[12]。但进一步研究表明,在病毒激活的细胞质I型干扰素产生的通路中并不一定要IRF-1的介导[13]。IRF-2通常被认为是一个转录抑制因子,对IRF-1起着拮抗的作用。IRF-2结合干扰素或干扰素诱导基因的ISRE序列的能力是IRF-1的数十倍,从而一直这些基因的表达[14]。

图5 黄鳝不同组织IRF-1(A)和IRF-2(B)的表达
鱼类IRF-1最早是在牙鲆 (Paralichthysolivaceus)发现的[15]。从牙鲆cDNA文库中筛选出一个长1746bp的序列,当时命名为fIRF,fIRF与已报道的鸟和哺乳动物的IRF-1和IRF-2相似性达40%。而且,fIRF的DNA结合域具有IRF家族最典型的5个色氨酸残基。随后,在其他鱼类中开展了大量的研究。利用细胞巨化病毒介导的增强子构建的牙鲆IRF-1重组质粒,在同源细胞系中用转染试验研究牙鲆抗病毒机制,结果表明牙鲆IRF-1通过产生类似于细胞因子的产物来诱导细胞发挥抗病毒作用[16-17]。同时,过量表达的IRF-1能调控IFN以及ISG基因的表达[18]。为了研究IRF-1的抗病毒机理,亚细胞定位揭示鲫IRF-1有2个核定位信号,它们均能促使IRF-1从细胞质转移至细胞核中,这就充分地阐明了鱼类IRF-1在病毒感染前后的迁移规律。此外,还有学者对鱼类IRF-1和IRF-2基因的启动子活性进行了研究。以虹鳟IRF-1A启动子构建的鱼类特异性表达载体pIRF-1A-G,作为DNA疫苗免疫虹鳟后,能在体内成功表达IHNV的G蛋白,使鱼体获得免疫保护反应[19];Collet等[20]将虹鳟IRF-2基因上游启动子克隆到报道基因载体pGL3-basic中,通过转染细胞、荧光素酶活性测定试验证明IRF-2基因上游启动子具有较强的启动子活性,这些都将有助于进一步阐明IRF-1和IRF-2的功能。
IRF-1和IRF-2的表达规律已有许多相关报道。在其他鱼类中,IRF-1和IRF-2广泛地表达于各种组织或器官[5,6,21,22],呈现组成型表达。本研究表明IRF-1和IRF-2在黄鳝3个不同发育阶段表达规律基本一致,而在检测的9种组织中IRF-1血液、皮肤、肠、中肾和肝脏表达量较高,而IRF-2在中肾、肠和脾脏中表达量较高,这与大黄鱼[23]、斜带石斑鱼[21]、鳜[6]的表达规律基本一致,但与牙鲆[15]、虹鳟[4]和红鳍东方鲀 (Fugurubripes)[24]存在一定差异,这可能是不同的鱼类生长的环境不同造成的。此外,IRF-1和IRF-2在诱导后表达量会显著上升。牙鲆在轮状病毒(rotavirus)和迟钝爱得华氏菌 (Edwardsiellatarda)免疫后,IRF-1mRNA表达量均得到上调[15];虹鳟IRF-1用Poly I:C腹腔注射虹鳟后,鳃、头肾、肝脏和脾脏中IRF-1表达量均明显上升[4];Poly I:C能鳜鱼诱导IRF-2的表达[7]。这些说明IRF-1和IRF-2在鱼类抵抗病原菌的防御中起着十分重要的作用。
[1]Mamane Y,Heylbroeck C,Genin P,et al.Interferon regulatory factors:the next generation [J].Gene,1999,237:1-14.
[2]Colonna M.TLR pathways and IFN-regulatory factors:to each its own [J].Eur J Immunol,2007,37:306-309.
[3]Tamura T,Yanai H,Savitsky D,et al.The IRF family transcription factors in immunity and oncogenesis [J].Annu Rev Immunol,2008,26:535-584.
[4]Collet B,Hovens G C,Mazzoni D,et al.Cloning and expression analysis of rainbow troutOncorhynchusmykissinterferon regulatory factor 1and 2(IRF-1and IRF-2)[J].Dev Comp Immunol,2003,27:111-126.
[5]Ordas M C,Abollo E,Costa M M,et al.Molecular cloning and expression analysis of interferon regulatory factor-1(IRF-1)of turbot and sea bream [J].Mol Immunol,2006,43:882-890.
[6]Sun B J,Chang M X,Song Y,et al.Gene structure and transcription of IRF-1and IRF-7in the mandarin fishSinipercachuatsi[J].Vet Immunol Immunopathol,2007,116:26-36.
[7]Sun B,Chang M,Chen D,et al.Gene structure and transcription of IRF-2in the mandarin fishSinipercachuatsiwith the finding of alternative transcripts and microsatellite in the coding region [J].Immunogenetics,2006,58:774-784.
[8]Holland J W,Bird S,Williamson B,et al.Molecular characterization of IRF-3and IRF-7in rainbow trout,Oncorhynchusmykiss:functional analysis and transcriptional modulation [J].Mol Immunol,2008,46:269-285.
[9]Ben J,Jabs E W,Chong S S.Genomic,cDNA and embryonic expression analysis of zebrafish IRF-6,the gene mutated in the human oral clefting disorders Van der Woude and popliteal pterygium syndromes [J].Gene Expr Patterns,2005,5:629-638.
[10]Kileng O,Bergan V,Workenhe S T,et al.Structural and functional studies of an IRF-7-like gene fromAtlanticsalmon[J].Dev Comp Immunol,2009,33:18-27.
[11]Huang B,Qi Z T,Xu Z,et al.Global characterization of interferon regulatory factor(IRF)genes in vertebrates:Glimpse of the diversification in evolution [J].BMC Immunol,2010,11:22.
[12]Escalante C R,Yie J,Thanos D,et al.Structure of IRF-1with bound DNA reveals determinants of interferon regulation [J].Nature,1998,391:103-106.
[13]Matsuyama T,Kimura T,Kitagawa M,et al.Targeted disruption of IRF-1or IRF-2results in abnormal type I IFN gene induction and aberrant lymphocyte development [J].Cell,1993,75:83-97.
[14]Sato M,Taniguchi T,Tanaka N.The interferon system and interferon regulatory factor transcription factors-studies from gene knockout mice [J].Cytokine Growth Factor Rev,2001,12:133-142.
[15]Yabu T,Hirose H,Hirono I,et al.Molecular cloning of a novel interferon regulatory factor in Japanese flounder,Paralichthys olivaceus[J].Mol Mar Biol Biotechnol,1998,7:138-144.
[16]Caipang C M,Hirono I,Aoki T.Induction of antiviral state in fish cells by Japanese flounder,Paralichthysolivaceus,interferon regulatory factor-1 [J].Fish Shellfish Immunol,2005,19:79-91.
[17]Caipang C M,Hirono I,Aoki T.Modulation of the early immune response against viruses by a teleostean interferon regulatory factor-1(IRF-1)[J].Comp Biochem Physiol A Mol Integr Physiol,2009,152:440-446.
[18]史 燕,赵 哲,张义兵,等.鲫鱼干扰素调节因子1功能初步研究 [J].水生生物学报,2008,32(4):509-514.
[19]Alonso M,Johnson M,Simon B,et al.A fish specific expression vector containing the interferon regulatory factor 1A (IRF1A)promoter for genetic immunization of fish [J].Vaccine,2003,21 (15):103-109.
[20]Collet B,McDonald C,Sombes C J.The promoter for the Interferon Regulatory Factor(IRF)-2in the rainbow troutOncorhynchus mykiss:cloning and reporter gene activity [J].Fish Shellfish Immunol,2003b,15:473-477.
[21]Shi Y,Zhu X P,Yin J K,Zhang Q Y,Gui J F.Identification and characterization of interferon regulatory factor-1from orangespotted grouper(Epinepheluscoioides)[J].Molecular Biology Reports,2010,37:1483-1493.
[22]张 跃,白俊杰,李英华,等.牙鲆干扰素调节因子核心区序列的克隆及初步表达 [J].中国水产科学,2001,8(2):10-13.
[23]Yao CL,Kong P,Huang X N,et al.Molecular cloning and expression of IRF1in large yellow croaker,Pseudosciaenacrocea[J].Fish Shellfish Immunol.2010,28 (4):654-660.
[24]Richardson M P,Tay B H,Goh B Y,et al.Molecular cloning and genomic structure of a gene encoding interferon regulatory factor in the pufferfish(Fugurubripes)[J].Mar Biotechnol(NY),2001,3:145-151.

