小反刍兽疫病毒F基因的序列分析
周海宁,尹 才,马 龙,王晶钰
(1.西北农林科技大学动物医学院,陕西杨凌 712100;2.宁夏动物疾病预防控制中心,宁夏银川 750011)
小反刍兽疫(Peste des petits ruminants,PPR)是由小反刍兽疫病毒(Peste des petits ruminants virus,PPRV)引起的一种急性、高度接触性传染病,能够感染山羊、绵羊和野生小反刍兽等动物,以发热、口腔及舌黏膜糜烂、流泪、流鼻液、腹泻和肺炎等症状为主要特征[1]。
PPRV为有囊膜的多形性单股负链RNA病毒,含有15 948个核苷酸。该基因共编码6种结构蛋白和2种非结构蛋白[2]。其中6种结构蛋白依次为N蛋白、M蛋白、P蛋白、L蛋白,还有2种外部蛋白F和H,这两种蛋白可在感染后激起机体保护反应。
PPRV F基因与所有副黏病毒一样,其翻译产物F0蛋白无活性,蛋白裂解后产生的F1和F2才具有活性[3]。研究显示,PPRV-F基因编码的融合蛋白(F蛋白)是决定病毒感染细胞的关键,具有诱导产生细胞溶血素、促进细胞融合以及启动病毒感染细胞等生物学活性。当前,PPR尚无有效治疗方式,主要通过早期诊断和疫苗免疫的方式进行控制。有研究显示,F 蛋白在麻疹病毒属中是主要的保护性免疫原,能够诱导机体产生中和抗体[4]。另有研究报道,不同地区来源PPRV-F基因毒株谱系不同,通过对F基因核苷酸序列进行分析,可以为该病毒在不同地理区域间的传播途径提供线索[5-6]。因此,本研究以宁夏地区采集的疑似PPR的病料为研究对象,提取样品RNA,RT-PCR扩增PPRV-F基因,通过分子鉴定验证该病料是否为PPRV阳性;同时,通过对本研究获得的F基因进行生物信息学分析,阐明宁夏感染的PPRV的谱系以及F蛋白的分子特征,为进一步探索该病毒在不同地理区域间的传播情况,研究该基因的功能,制备亚单位疫苗奠定基础。
1 材料与方法
1.1 材料
1.1.1 病料 本试验所用病料由宁夏动物疾病预防控制中心于2016年采集。该病料来源于宁夏回族自治区银川市西夏区某发病山羊养殖场,根据临床症状及剖检变化,初步判断为小反刍兽疫疑似病例,采集该发病山羊淋巴结、肝、脾脏等组织带回实验室,置-70℃保存。
1.1.2 主要试剂 Trans Script one-step RT-PCR Super MIX购自全式金生物技术有限公司;病毒RNA提取试剂盒购自苏州天隆科技有限公司;核酸分子标准购自北京天根生化科技有限公司。
1.2 方法
1.2.1 PPRV总RNA的提取 取2 mg发病羊组织样本,加入石英砂,用无菌无核酶研钵充分研磨,加入无核酶PBS(pH7.4),制成1∶5~1∶10悬液,液氮反复冻融3次,8 000 r/min离心2 min,取上清液备用。用RNA提取试剂盒提取上清液样品中病毒总RNA,具体步骤参考试剂盒说明书。提取的总RNA测定浓度及纯度,置-80℃保存备用。
1.2.2 引物的设计与合成 根据GenBank中公布的Kurdistan株PPRV-F基因序列(登录号:KF648287),用Primer Premier 5软件设计1对引物,其中上游引物(F-f)为:5′-ATGACACGGGTCGCAATCTTGA-3′;下游引物(F-r)为:5′-CTACAGTGATCTCACGTACGAC-3′。预期扩增的片段大小1 641 bp,引物由英潍捷基(上海)贸易有限公司合成,用dd H2O按10 pmol/μL稀释,置-20℃保存备用。
1.2.3 PPRV-F基因的RT-PCR扩增 以PPRV总RNA为模板,使用TransScript one-step RT-PCR SuperMix进行一步法RT-PCR扩增。反应体系如下:在20 μL的反应体系中加入2×One-Step Reaction Mix 10 μL,TransScript One-Step Enzyme Mix 0.4 μL,10 pmol/μL上、下游引物各0.4 μL,RNA模板2 μL,加灭菌水水补至20 μL。反应条件:45℃反转录20 min;94℃ 5 min;94℃ 30 s,54℃ 40 s,72℃ 90 s,35个循环;72℃终延伸10 min。产物于10 g/L琼脂糖凝胶中电泳,观察和记录结果。将目的条带切胶回收纯化后,送英潍捷基(上海)贸易有限公司进行测序。
1.2.4 PPRV-F基因的核苷酸序列分析 将获得的序列,输入到GenBank数据库中进行同源性比较(http://blast.ncbi.nlm.nih.gov/Blast.cgi),验证获得的病料是否为PPRV阳性样品。
1.2.5 PPRV-F基因进化树分析 从GenBank中下载不同毒株的PPRV-F基因序列,具体如下:China Fu Yang株(登录号:MF443335)、China GD株(登录号:MF443352)、China HeN株(登录号:MF443347)、China SC株(登录号:MF443338)、China Tibet株(登录号:EU364809)、China XJYL株(登录号:KM091959)、Mongolia株(登录号:KY888168)、China ZJ株(登录号:MF443335)、China XJBZ株(登录号:KT633939.1)、China Tibet株(登录号:EU364809.1)、Morocco(登录号:KC609746.1)、Kurdistan(登录号:KF648287.1)、India(登录号:KF752444.1)、Netherlands(登录号:KJ867542.1)、India(登录号:GQ410435.1)、India(登录号:JN632534.1)、Nigeria(登录号:HQ197753.1)、Benin(登录号:KR781450.1)、Ghana(登录号:KJ466104.1)、Nigeria(登录号:EU267274.1)、west Africa(登录号:KP789375.1)、Cote dlvire(登录号:EU267273.1)、Uganda(登录号:KJ867543.1)、Kenya(登录号:KM463083.1)、Oman(登录号:KJ867544.1)、UAE(登录号:KJ867545.1)。用MAGA 5.1构建PPRV-F基因进化树,分析本试验获得的样品与其他地区分离株的亲缘关系。
1.2.6 PPRV-F基因编码氨基酸序列分析及F蛋白结构预测 应用生物信息学方法,通过网络服务器对PPRV-F基因编码的蛋白进行分析,其中包括氨基酸序列分析:SMART(http://smart.embl-heidelberg.de/),ExPASY(http://web.expasy.org/protparam/);信号肽预测:(http://www.cbs.dtu.dk/services/SignalP/);跨膜区预测:(http://www.cbs.dtu.dk/services/TMHMM-2.0/);抗原性预测:(http://imed.med.ucm.es/Tools/antigenic.pl);二级结构预测:Jpred3(http://www.compbio.dundee.ac.uk/www-jpred);三级结构预测:Phyre2(http://www.sbg.bio.ic.ac.uk/phyre2)。
2 结果
2.1 样品PPRV-F基因的RT-PCR扩增
提取本中心获得的疑似PPRV阳性样品RNA,以此为模板,经一步法RT-PCR扩增,获得PPRV-F基因,经10 g/L琼脂糖凝胶电泳分析,片段大小约为1 600 bp,与预期的结果相符,初步证明本次获得的病料为PPRV阳性样品(图1)。
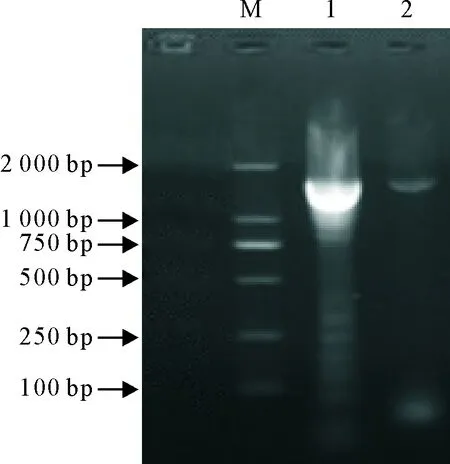
M.DNA标准DL 2 000;1~2.样品RT-PCR扩增产物
M.DNA Marker DL 2 000; 1-2.RT-PCR amplification products of PPRV samples
图1样品PPRV-F基因RT-PCR扩增结果
Fig.1 The results of PPRV-F gene amplification by RT-PCR
2.2 PPRV-F基因核苷酸序列分析
将PCR扩增为阳性的条带经胶回收纯化以后,进行测序。所获得的序列,经测序大小为1 641 bp,将序列输入到NCBI数据库中进行比对,发现与Kurdistan株(登录号:KF648287.1)F基因核苷酸的同源性为97%,进一步证实本实验室获得的病料为PPRV阳性样品。
2.3 不同毒株PPRV-F基因同源性分析
将宁夏获得的PPRV-F基因与GenBank下载的不同毒株的PPRV-F基因进行核苷酸同源性分析。结果显示,宁夏获得的PPRV-F基因与ChinaZJ(MF443335.1)、ChinaSC(MF443338.1)、ChinaHeN(MF443347.1)、ChinaGD(MF443352.1)和ChinaXJYL(KM091959.1)等毒株同源性高达99.6%,与Mongolia株(KY888168.1)同源性高达99.3%,与ChinaXJBZ株(KT633939.1)同源性为98.1%;与我国所用疫苗株Nigeria75/1株(HQ197753.1)同源性仅为92.8%(图2)。

图2 PPRV-F基因核苷酸同源性分析
2.4 不同毒株PPRV-F基因系统进化分析
从GenBank下载不同毒株的PPRV-F基因序列,与本试验获得的PPRV-F基因一起构建系统进化树。结果表明,宁夏获得的PPRV-F基因与中国其他省份分离的8个毒株及印度、蒙古等国报道的7个毒株在同一个分支上,同属谱系Ⅳ(图3)。
2.5 PPRV-F基因编码的氨基酸序列分析及F蛋白结构预测
利用SMART和ExPASY进行在线分析PPRV-F基因编码的氨基酸序列,发现该基因编码546个氨基酸,分子质量为59.2 ku,理论等电点(pI)为8.71;不稳定系数是36.6,小于阈值40,属于稳定蛋白,脂肪系数109.98,总平均疏水指数0.201。SignalP4.0在线预测分析表明,PPRV-F蛋白有信号肽存在,为分泌型蛋白(图4)。TMHMM2.0预测分析表明,F蛋白有跨膜区(图5)。Jpred 3(http://www.compbio.dundee.ac.uk/www-jpred)在线分析发现,PPRV F蛋白的二级结构中α螺旋(H)占43.22%,β折叠(E)占20.5%,无规则卷曲占36.26%(图6)。Phyre2三级结构预测表明,PPRV-F蛋白与其他麻疹病毒属成员融合蛋白结构相似(图7)。
3 讨论
PPR多流行于非洲和亚洲,并且在一些新的地区不断有该病的报道[7],严重威胁养殖业,造成巨大的经济损失。该病于1942年首次在科特迪瓦暴发,目前已扩散到亚洲、非洲的40余个国家。近年来,小反刍兽疫逐渐跨越地理屏障,扩散趋势不断上升,我国周边国家,如阿富汗、印度、尼泊尔等也都有PPR流行的报道[8]。2007年,我国西藏地区发生第一起PPR疫情,2008年-2010年在西藏先后3次发生PPR疫情[9-10]。
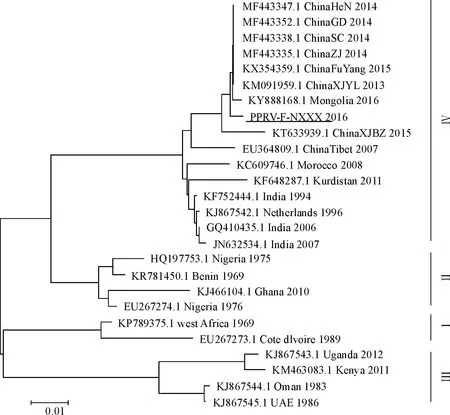
图3 PPRV-F基因的系统进化树
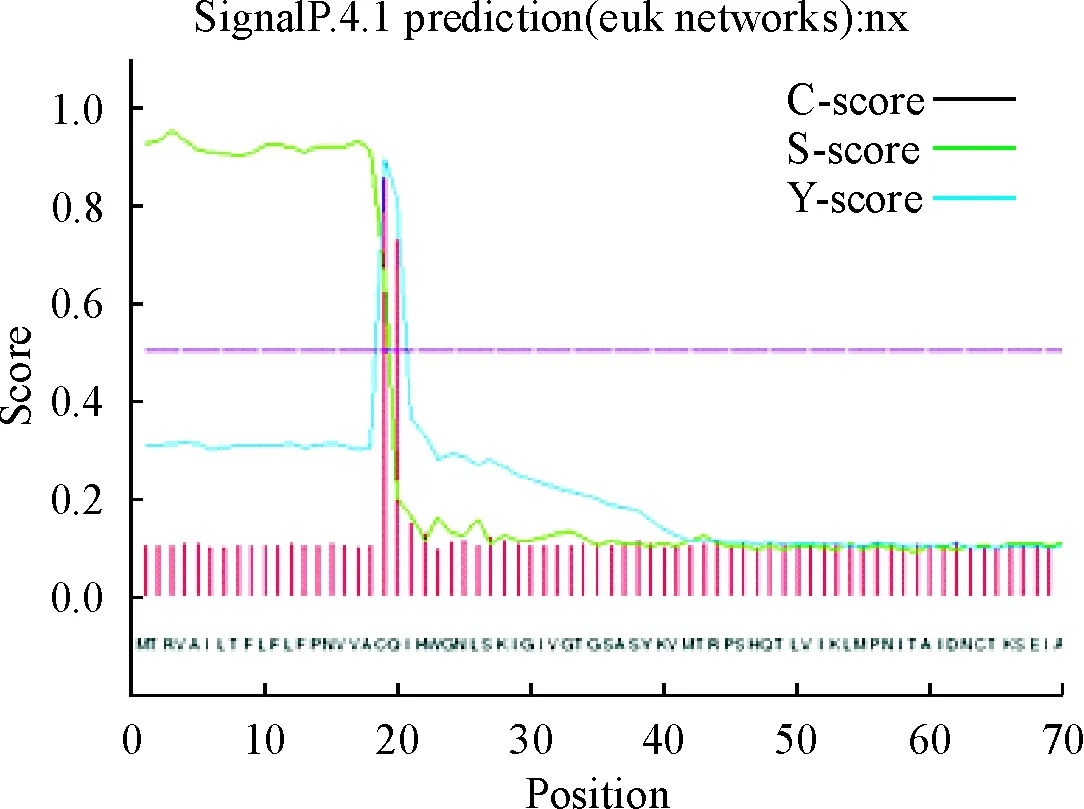
图4 PPRV-F蛋白的信号肽预测结果
从2013年底开始,国内20多个省份先后暴发了小反刍兽疫疫情,给养羊业带来巨大的经济损失[11-13]。2014年,宁夏出现首例PPR疫情[14],2016年再发生一起输入型PPR疫情,在处置该疫情的过程中,通过发病山羊的临床症状及剖检变化初步判定为PPR感染,但仍需通过分子生物学检测进行进一步验证。本中心将发病山羊的病料带回实验室,置-70℃保存备用。本试验以该疑似PPR样品为试验材料,提取样品RNA,经一步法RT-PCR扩增,成功获得PPRV-F基因,大小为1 641 bp,编码546个氨基酸,分子质量大约为59.2ku,这与赵文姬报道的西藏分离株特性相一致[15]。
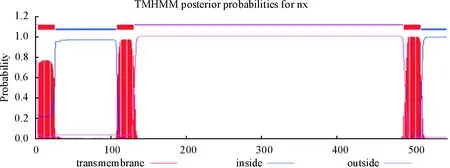
图5 PPRV-F蛋白的跨膜区预测结果

图6 PPRV-F蛋白的二级结构示意图
研究发现,对PPRV-F基因核苷酸序列进行分析,不同地区来源毒株谱系不同。其中Ⅰ系主要来源塞内加尔和尼日利亚的毒株,Ⅱ系为几内亚和科特迪瓦的毒株,Ⅲ系主要包括埃塞俄比亚、也门、苏丹毒株,Ⅳ系均为亚洲毒株[16]。通过对F基因核苷酸序列进行分析,可以为该病毒在不同地理区域间的传播情况提供线索[17-18]。本试验获得的宁夏PPRV-F基因与国内其他省份报道的F基因序列高度同源,并且同属谱系Ⅳ,系统进化树分析显示,该基因与我国其他地区分离到的PPRV毒株及印度、蒙古等国7个毒株在同一个分支上,与之前的报道相符[19-21]。
当前应用在PPR防控计划中的小反刍兽疫疫苗为弱毒苗,免疫效果有效。但是,弱毒苗无法鉴别免疫抗体和野毒感染抗体,这在一定程度上影响了疫病的诊断。在疫病的有效防控和非疫区申报过程中,疫病暴发后的血清学检测是一种重要的手段,为了便于血清学监测,疫苗免疫后的同步检测是关键。因此,尽管现在的弱毒苗可以有效的预防该病,但是为了便于血清学的监测,标记疫苗更有发展前景。PPRV-F蛋白可帮助病毒进入宿主细胞,可促使病毒囊膜和细胞膜融合。一旦病毒结合到宿主细胞的靶位,F蛋白就调节病毒膜和细胞膜的融合性,并允许释放的N蛋白进入细胞浆。在病毒感染过程中,新合成的F蛋白可使细胞间发生融合,具有很好的候选疫苗潜力[19-21]。当前已经有学者通过基因工程手段去除了该基因的信号肽和跨膜区,构建了该基因的原核表达质粒,并获得了表达,表达的蛋白具有良好的免疫原性[22-23],但是并未对该蛋白做进一步的研究,因此下一步拟研究蛋白的生物学功能,为研制基因工程疫苗奠定基础。

