运动联合早期中药治疗对去卵巢骨质疏松大鼠的干预作用
李水生,左建玲,杨新林,张葆欣,王海峰*
(1.西北农林科技大学体育部,陕西杨凌 712100;2.河北北方学院公共体育部,河北张家口 075000;3.西安体育学院,陕西西安 710068)
随着老年化趋势的加剧,骨质疏松症已成为全球范围内的严重健康问题[1]。绝经期骨量逐渐减少,从而诱发绝经后骨质疏松症[2]。值得注意的是,骨质疏松症伴随着持久的疼痛、骨变形、易骨折等[3]。鉴于骨量流失呈渐进性且不可逆的特征,现阶段暂无特效根治方法,需重视早期干预[4]。
运动有利于刺激骨细胞生成[5]。同时,运动增强肌力、提高平衡力,均可有利于降低该症引发的骨折[6]。既往研究均强调了运动在预防绝经后骨质疏松症中的积极作用[7]。另外,中医学强调辨证治疗,从整体上施用毒副作用小的综合调理措施[8],因此从中医药中寻找治疗骨质疏松症的药物意义显著。既往有研究显示中药淫羊藿醇提物、杜仲-牛膝配伍均可显著改善去卵巢大鼠骨质疏松症疗效[9-10],但其作用机制有待进一步探讨。运动联合早期中药治疗骨质疏松症研究不多,本文构建绝经后骨质疏松动物模型,初步探讨运动联合早期中药治疗对骨质疏松症的干预及机制,以期为骨质疏松症的防治提供科学依据。
1 材料与方法
1.1 材料
1.1.1 实验动物 选取40只3个月龄的雌性SD大鼠,体重260 g±6.00 g,实验动物由西安体育学院运动医学实验室提供。所有大鼠均经标准饲料适应性喂养于不锈钢笼内2周,通风无菌,自由饮食饮水。保持相对湿度在60%左右,模拟昼夜明暗交替(12 h/12 h),室温在24℃±2℃内。
1.1.2 主要仪器 大鼠跑台仪(DS),浙江段氏商贸有限公司产品;电子天平仪(JA2003),上海天平仪器技术有限公司产品;双能X射线骨密度测定仪(XR-36),Norland公司产品;紫外分光光度计(HP8453),惠普公司产品;实时定量PCR仪(SLAN),上海宏石医疗科技有限公司产品;高速离心机(Biofuge 28RS),Heraeus公司产品;凝胶成像仪(GEL DOC EZ IMAGER),Bio-rad公司产品。
1.1.3 药物和试剂 骨疏康颗粒,辽宁康辰药业有限公司产品;PCR试剂盒,QIAGEN公司产品;PCR引物,上海生工生物工程技术服务有限公司合成;BCA蛋白浓度测定试剂盒,聚丙烯酰胺凝胶,武汉博士德生物工程有限公司产品;蛋白裂解液,碧云天生物技术有限公司产品;PVDF膜,Millipore公司产品;Western blot抗体,北京中杉金桥生物技术有限公司产品。
1.2 方法
1.2.1 动物分组 采用随机数字表法将40只大鼠随机分为5组,每组各8只,其中假手术组为正常对照,将其他大鼠去卵巢,构建绝经后骨质疏松动物模型,分为去卵巢组、单纯运动组、单纯中药治疗组、运动协同中药治疗组。
1.2.2 去卵巢骨质疏松动物模型构建 称重大鼠,行腹腔内注射麻醉(30 g/L戊巴比妥,50 mg/kg)。消毒后,行背部切口,逐层切开皮肤、骨骼、打开腹腔,定位双侧卵巢,使用钳夹切除,随后结扎、止血并缝合。假手术组手术麻醉及路径同上,不做卵巢切除。术后切口消毒,并腹腔注射青霉素预防感染。
1.2.3 动物干预方案及取样 手术后1周内密切关注大鼠伤口状况并预防感染。手术后第11周,对不同组别实施不同干预方案。假手术组、去卵巢组和单纯运动组蒸馏水灌胃(10 mL/kg),每日1次。单纯中药治疗组和运动协同中药治疗组使用骨疏康(4.8 g/kg)灌胃,每日1次。同时,单纯运动组和运动协同中药治疗组参照Bedford设计的动物运动负荷标准[11],行跑台训练。各组大鼠每月称重1次。
最后一次运动或药物治疗结束24 h内,脱颈处死大鼠。为确认大鼠去卵巢手术成功,剪下大鼠子宫周围脂肪组织,并称重,子宫变细、重量减轻则为去卵巢成功。迅速游离股骨。取左侧股骨远端并剔除周围组织,40 g/L多聚甲醛固定,切片,HE染色;取左侧股骨近端组织置于-80℃冰箱用于PCR检测;右侧股骨组织置于-80℃冰箱用于蛋白提取。
1.2.4 骨密度测定 采用XR-36型双能X射线骨密度测定仪,检测离体股骨组织骨密度(g/cm2)。
1.2.5 实时荧光定量PCR检测 根据试剂盒说明提取大鼠股骨组织的总RNA,提取后的RNA以紫外分光光度计检测各RNA样本的OD260/OD280值,并计算RNA浓度,置-80℃保存备用。逆转录cDNA根据试剂盒说明书操作。采用Primer5.0引物设计软件,设计引物如下(表1),设计引物均由上海生工公司合成。反应体系为20 μL:SYBR PremixExTaq10 μL,Forward Primer 0.8 μL, Reverse Primer 0.8 μL,ROX Reference Dye Ⅱ 0.4 μL,DNA模板 2 μL,ddH2O 6 μL。反应条件为:95℃ 3 min;95℃ 5 s,60℃ 30 s,采集荧光信号,共35个循环。miR-21以GAPDH为内参,取CT值(扩增动力曲线拐点),按2-△△Ct计算目的基因相对表达量。

表1 PCR引物设计
1.2.6 Western blot检测 从液氮中取出组织样本,碾磨成粉,加入蛋白裂解液(1 mL),混匀后静置2 h,随后进行离心处理(12 000 r/min,30 min),吸取上层蛋白提取液。按BCA试剂盒说明书测定蛋白浓度,将提取的蛋白加入上样缓冲液后在95℃煮10 min,每孔上样30 μg,100 g/L聚丙烯酰胺凝胶电泳分离蛋白,电泳电压80 V 转120 V,湿转,转膜电压100mV,时间45 min~70 min,PVDF转膜,50 g/L BSA室温封闭1 h,加入一抗(1∶1 000稀释,购自Abcam公司),4℃过夜。TBST 漂洗,3次/5 min,相应的二抗(1∶3 000稀释)室温孵育 2 h,洗膜,3次/5 min,化学发光试剂显影。β-actin作为内参。Bio-rad Gel Dol EZ 成像仪显影。目的条带采用Image J软件进行灰度值分析。
2 结果
2.1 实验动物体重比较
试验初,大鼠体重无明显差异。治疗结束时,去卵巢组体重最大,体重增长趋势最明显,与假手术组相比差异显著(P<0.05);各治疗组体重增加趋势明显低于去卵巢组(P<0.05);单纯中药治疗组大鼠体重与运动组无显著差异(P>0.05)(表2)。
2.2 各组骨密度变化
运动协同中药治疗组骨密度明显高于去卵巢组、单纯运动组和单纯中药治疗组,但未达到假手术组水平(P<0.05);单纯中药治疗组骨密度水平高于去卵巢组和单纯运动组(P<0.05),但后两组间无显著差异(P>0.05)(表3)。
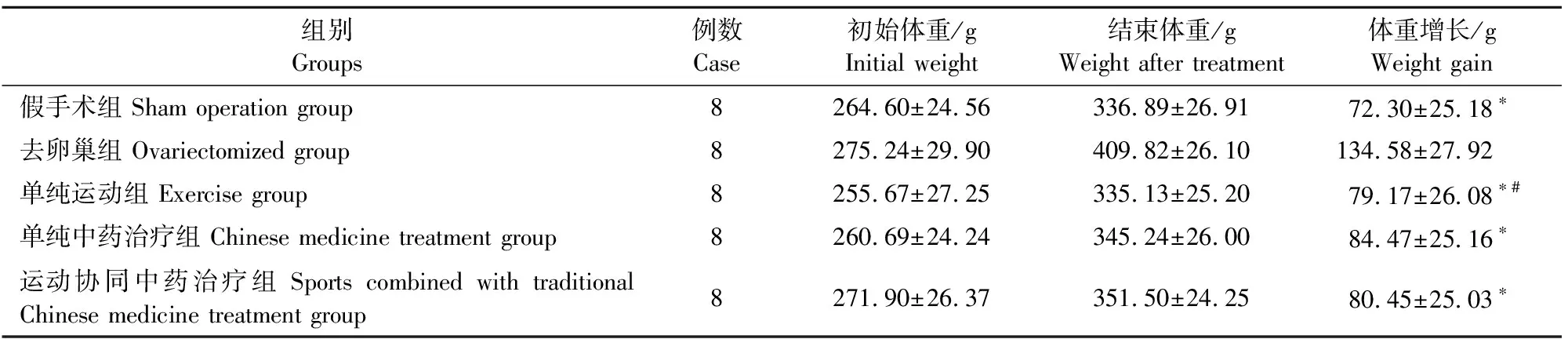
表2 各组大鼠治疗前后体重变化对比
注:*表示与去卵巢组比较,P<0.05;#表示单纯运动组组与单纯中药治疗组比较,P>0.05。
Note:*Compared to ovariectomized group,P<0.05; #Compared to exercise group and Chinese medicine treatment group,P>0.05.

表3 各组大鼠股骨骨密度对比
注:*表示与运动协同中药治疗组比较,P<0.05;#表示单纯中药治疗组比较,P<0.05。
Note:*Compared to sports combined with traditional Chinese medicine treatment group,P<0.05; #Compared to Chinese medicine treatment group,P<0.05.
2.3 各组骨组织HE染色对比
左侧股骨近端组织的HE染色显示去卵巢组骨小梁横径变窄且有断裂现象、间隙增大、排列混乱,同时骨髓腔脂肪细胞明显增多;假手术组、单纯运动组和单纯中药治疗组骨小梁横径较宽且无断裂、排列整齐;运动协同中药治疗组骨小梁横径宽度大于去卵巢组、间隙减小,且骨髓腔细胞较去卵巢组减少(图1),图1中由左往右依次为:假手术组、去卵巢组、单纯运动组、单纯中药治疗组、及运动协同中药治疗组。
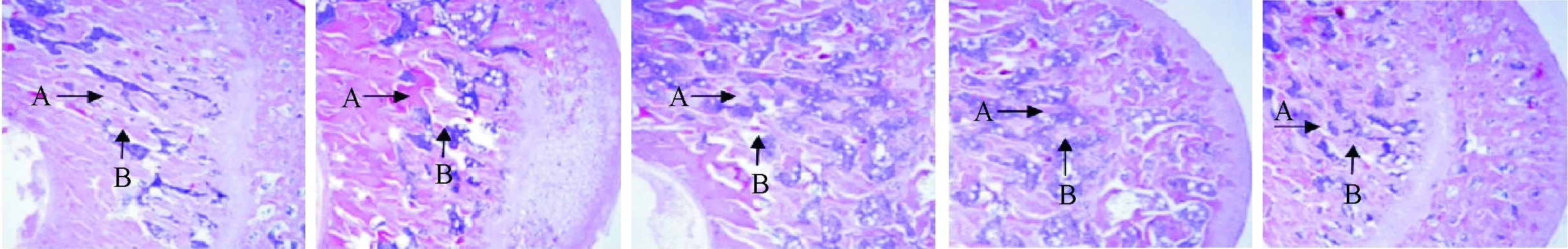
图1 左侧股骨近端组织的HE染色(A骨小梁,B骨髓腔,100×)
2.4 PCR及western blot分别检测Osterix和P-GSK-3β表达水平比较
与假手术组相比,去卵巢组Osterix的mRNA水平明显降低;治疗组水平提升,尤以运动协同中药治疗组明显提高,与去卵巢组相比差异显著(P<0.05);但单纯运动组与单纯中药治疗组相比差异不显著(P>0.05)(表4)。相比假手术组,去卵巢组大鼠P-GSK-3β蛋白表达显著上升;各治疗组P-GSK-3β蛋白表达明显低于去卵巢组,且运动协同中药治疗组水平最低(P<0.05)(图2,表4)。

图2 Western blot检测P-GSK-3β蛋白表达
3 讨论
骨质疏松症常伴有骨密度下降、骨强度减弱、骨折风险增高、慢性疼痛等特征。目前,医学研究领域一直致力于如何实现安全有效的骨质疏松症的早期预防。

表4 PCR及Western blot分别检测Osterix和P-GSK-3β表达水平
注:*表示与去卵巢组比较,P<0.05;#表示单纯中药治疗组比较,P<0.05。
Note:*Compared to the sports combined with ovariectomized group,P<0.05; #Compared to Chinese medicine treatment group,P<0.05.
本研究通过构建大鼠去卵巢骨质疏松症模型,并以假手术操作大鼠为正常对照,以不加任何干预措施的去卵巢组为病理对照,同时另施加跑台运动干预、单纯中药干预以及运动协同中药干预3种干预模式,分析各组大鼠治疗前后体重变化、治疗后骨密度比较、以及Osterix和P-GSK-3β水平变化,以期为临床寻找理想的早期干预骨质疏松症的治疗措施。
手术切除大鼠双侧卵巢是最为广泛应用的构建动物去卵巢骨质疏松症模型的干预措施。本研究选用3月龄性成熟期的雌性大鼠构建去卵巢骨质疏松症模型,且体重变化明显,去卵巢组大鼠体重上升趋势明显,骨密度测量显示去卵巢组骨密度明显下降,同时,骨组织切片亦提示骨小梁数量降低、腔隙增大、排列混乱。以上结果证实去卵巢骨质疏松症模型的成功构建。试验前各组体重无差异,治疗结束体重对比发现,去卵巢组体重最大,体重增长趋势最明显;各治疗组体重增加趋势明显低于去卵巢组;单纯中药治疗组大鼠体重与运动组无差异。提示单纯中药治疗并不能有效控制绝经后的体重增长趋势,运动协同中药治疗组可有效控制去卵巢相关的体重增加问题,进一步提示联合疗法的协同优势。同时,前面已提及骨质疏松症主要特征是骨密度下降、骨强度减弱。对比各组骨密度变化趋势是运动协同中药治疗组骨密度明显高于去卵巢组、单纯运动组和单纯中药治疗组,但未达到假手术组水平;单纯中药治疗组骨密度水平高于去卵巢组和单纯运动组。以上结果提示运动协同中药治疗可协同对抗去卵巢引起的骨量丢失,与既往研究结果相一致[12]。
虽然绝经后骨质疏松症的发病机制尚未明确,研究者普遍认为雌激素分泌下降诱导的骨吸收增加是其主要原因[13]。文献亦证实以淫羊藿为主的益骨中药可有效刺激成骨细胞分化、抑制破骨细胞功能[14-15]。本研究通过PCR和Western blot探究Osterix和P-GSK-3β水平的变化,从而验证不同干预措施的治疗效果。去卵巢组Osterix的mRNA水平明显降低,而运动协同中药治疗组明显提高;但单纯中药治疗和单纯运动疗法与假手术组相比差异不明显。结果说明去卵巢大鼠成骨细胞功能明显受到抑制,导致骨重建的失衡,而运动协同中药治疗有效增加Osterix表达,从而促进骨形成。此外,去卵巢组大鼠P-GSK-3β水平显著上升;各治疗组P-GSK-3β水平明显低于去卵巢组,尤以运动协同中药治疗组水平下降趋势最为明显。提示各疗法均能抑制去卵巢骨质疏松症模型大鼠股骨组织GSK-3β磷酸化,体现在GSK-3β活性的激活,进而抑制Wnt/β-catenin通路。
综上所述,运动联合早期中药治疗可对抗去卵巢引起的大鼠体重增加及骨密度降低,具有协同作用。同时,运动联合早期中药治疗可促进Osterix表达、降低P-GSK-3β水平,从而促进骨形成。总之,本研究通过构建去卵巢骨质疏松症大鼠模型,证实运动联合中药治疗具有协同作用。

