豆粕发酵制备氨基酸的中试初报
曾 炽,王静雅,周志成,陈思洋,娄立起,吴永尧
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.湖南省烟草公司,湖南 长沙 410007)
我国是世界上大豆生产加工大国,年产大豆均超过1 500万t,进口大豆1 000万t以上,年产大豆粕1 600万t以上[1]。大豆粕是以大豆为原料,经浸提法取油后的副产物[2],大豆粕蛋白含量高达40%~47%,利用前景广阔。但是,由于大分子特性与共存抗营养因子会影响大豆粕的利用[3],将其所含蛋白降解成游离氨基酸及小肽是实现豆粕高效利用的重要途径[4-5]。为此,实验室开展了发酵降解豆粕制备氨基酸的系统研究,现将自选菌种进行豆粕发酵的中试研究结果报告如下。
1 材料与方法
1.1 材料
大豆粕为湖南金叶肥料公司提供,菌株为湖南农业大学生物科学技术学院实验室自选菌M1。
1.2 主要仪器
恒温水浴箱,高压灭菌锅,超净工作台,恒温培养箱,HZQ-Q振荡器,中国丽BIOF-2000型5 L发酵罐,中国丽BIOF-6100A SB A型100 L发酵罐,TU-1810紫外可见分光光度计等。
1.3 方法
1.3.1 5 L发酵罐培养条件优化 在实验室前期发酵条件摸索工作的基础上,摸索在5 L发酵罐中发酵降解大豆粕的最佳控制条件[6]。种子液培养基为LB培养基,发酵培养基为3 000mL水、210 g大豆粕、6 g KH2PO4、1.5 g CaCl2,并以培养温度、接种量、搅拌转速及通气量4个因素为正交试验因子,选择4因素3水平的L9(34)正交试验,因素水平设置见表1。

表1 L9(34)正交试验设计
1.3.2 放大中试方法 试验菌种M1为好氧菌,发酵过程为高好氧发酵过程,所以以体积溶氧系数相等为基准,结合单位体积发酵液的搅拌功耗相等,并参考实际工作经验数据进行由5 L试验罐到100
L罐的发酵试验。5 L试验罐直径D=15 cm,2组搅拌叶轮直径Di=6.5 cm,高径比H/D=2,液深H=21 cm,4挡板 W/D=0.1;100 L罐直径 D=40 cm,2组搅拌叶轮直径Di=16 cm,高径比H/D=2,液深H=50 cm,4挡板W/D=0.1。发酵液为牛顿型流体,黏度u=1.78×10-3Pa·s,密度 L=1 050 kg/m3。以 60 L 水、4.2 kg 大豆粕、120 g KH2PO4、30 g CaCl2为发酵培养基,灭菌前使用NaOH调节pH至7.2。依据公式(1)搅拌雷诺准数:Re=ωDi2PL/μ;(2)不通气搅拌功率:P0=2NPω3PLDi5;(3) 通气搅拌功率:Pg=2.25×10-3(P02ωDi3/Q0.08)0.39;(4)空截面气速:vs=VG(π/4)D2;(5)体积溶氧系数:Kd=(2.36+3.3×2)(Pg/VL)0.56vs0.7ω0.7×10-9计算放大后的发酵控制条件[7]。
1.3.3 检测方法 (1)转速、温度、罐压、空气流量、发酵体系pH值等发酵的实时监测数据从控制电脑直接读取。(2)每8 h取样一次进行生化指标检测。还原糖含量测量:3,5-二硝基水杨酸法[8];可溶性蛋白含量测定:考马斯亮蓝G-250法[9];氨基酸含量测定:茚三酮法[9];活菌数测定:平皿培养单菌落计数法[10];蛋白酶活力测定:folin酚法[11];粗蛋白含量测定:凯式定氮法[12]。
2 结果与分析
2.1 发酵控制参数
正交试验以发酵后发酵液中氨基态氮含量为参考依据,得到发酵罐培养控制条件中影响菌种M1发酵降解大豆粕制备氨基酸的4个因素的影响程度为:通气量>接种量>温度>搅拌速度(表2)。
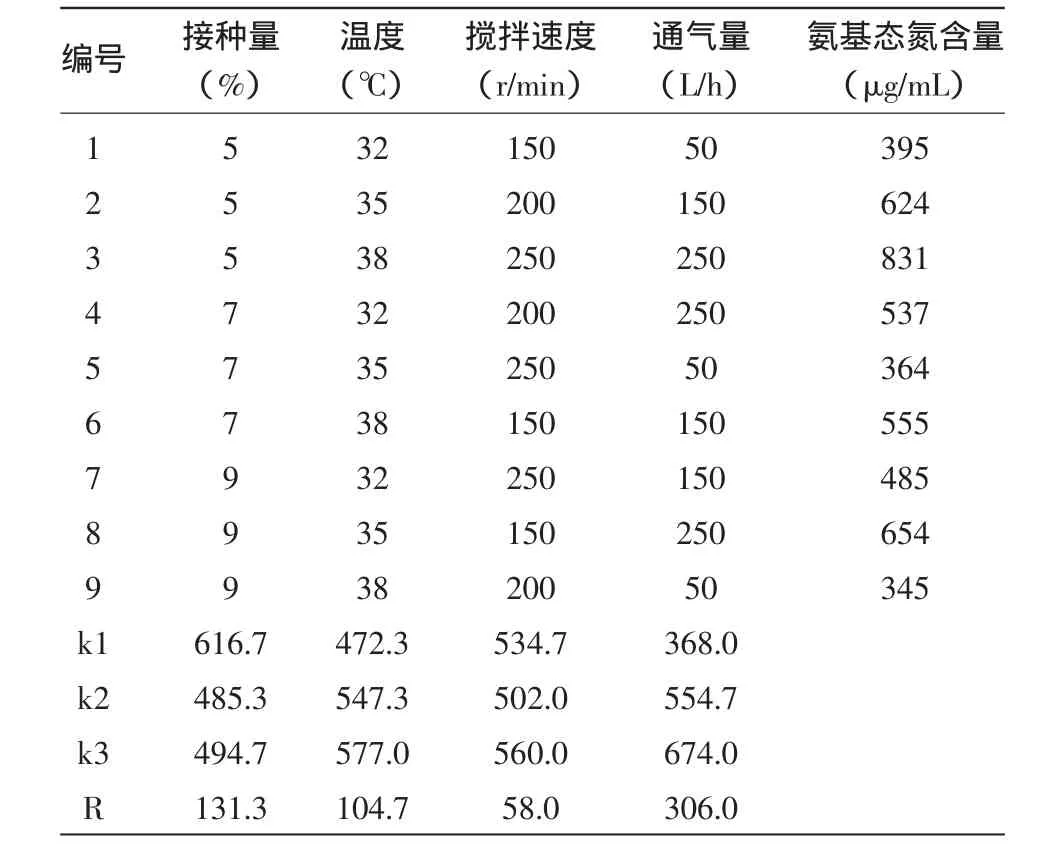
表2 正交试验方案和结果
根据正交试验结果,以发酵液中氨基态氮浓度最高为目标,得到实验室自筛菌M1在5 L试验罐中发酵降解大豆粕的最佳条件组合为:通气量250 L/h,接种量5%,温度38℃,搅拌速度250 r/min。在此种试验条件下,发酵液中氨基态氮的最高含量可以达到831μg/mL。由试验可知,随着通气量的上升,产物含量呈现上升趋势,由于试验条件所限,通气量250 L/h已经是在不产生发酵逃液前提下的最高值。再发酵放大时,由于试验条件的改变,可以尝试在保持KLa(计算时取体积溶氧系数Kd)基本不变的基础上提高通气量,考察产物含量变化。
2.2 100 L中试罐放大试验
在5 L发酵罐正交试验结果的基础上,根据
1.3.2 中放大公式计算,并结合实际工作中积累的经验,以实现高效降解大豆粕中蛋白质生产氨基酸和小分子肽为目标,确定100 L发酵罐中试的控制条件为:通气量60 L/min,接种量1%,温度38℃,搅拌速度150 r/min。
2.2.1 发酵过程中发酵情况的监测和控制 由发酵罐电脑系统实时对发酵情况进行在线监测和控制,能够保证转速、温度和通气条件稳定在设定值。发酵罐内部压力通过调整尾气出口阀门进行调节,在实际发酵中,由于菌种代谢产生大量气体,发酵罐内部出现泡沫,气压增加。通过调整尾气出口阀门,内部气压可保持在1.45×105Pa左右,保证内压大于外压,避免空气中杂菌污染发酵,也能避免罐内压力增加过快导致发酵液从尾气出口逃出。pH的高低对菌种生长和产物的合成影响明显,但在发酵过程中,无需人为地对发酵体系pH进行调节,菌种M1在代谢过程中本身具有一定的调节周围pH的能力,建成最适pH的环境。实际发酵过程中,pH值从灭菌后的6.7逐渐升高到发酵结束时的7.9,所以只需在发酵培养基配置时将pH调至7.2,即可实现发酵的顺利进行。
2.2.2 发酵过程中生化指标的变化 为了适应工业生产,降低生产成本,发酵培养基中除加必要的无机盐外,碳源和氮源物质均由大豆粕降解提供,不另添加其他物质。发酵体系中,降解豆粕中多糖类物质产生的还原糖为菌种生长产酶提供碳源,多糖的降解和还原糖的利用基本实现平衡,基本满足菌种生长产酶。随着发酵的进行,体系中还原糖的含量呈现缓慢降低的趋势(图1);大豆粕中的蛋白质随着菌种的生长,被逐渐降解利用,发酵液中可溶性蛋白的含量快速提高,发酵进行至30 h左右,发酵液中的可溶性蛋白含量达到顶峰,之后,由于大豆粕中粗蛋白被降解殆尽,可溶性蛋白被菌种降解,其含量急速下降;而发酵液中氨基态氮含量的变化情况滞后于可溶性蛋白含量变化,于可溶性蛋白含量达到顶峰后15 h左右,氨基态氮含量达到顶峰,为1 051μg/mL,之后由于发酵底物消耗殆尽,菌种自身生长需要消耗,氨基态氮含量出现缓慢降低情况。3类物质随发酵时间的变化情况表明,发酵体系中可溶性蛋白含量与氨基酸产率密切相关。

图1 还原糖、可溶性蛋白、氨基态氮的含量随发酵时间的变化
蛋白酶活性和生物量随发酵时间的变化见图2:菌株M1生长从16 h开始进入对数增长期,24 h时达到最高点,之后进入稳定期,并逐渐衰亡;而酶活力随着发酵的进行持续缓慢增长,24 h后增长速度迅速提高,40 h后酶活力达到最高点,之后趋于稳定,并呈现缓慢下降趋势。由于蛋白酶活力的变化趋势明显滞后于菌种的生长,在菌株进入稳定期后酶活力才进入快速增长阶段,可以推测蛋白酶的分泌是在菌株达到稳定期以后才开始的。

图2 蛋白酶活性和生物量随发酵时间的变化
2.3 大豆粕粗蛋白降解效果比较
分别取发酵前后的大豆粕烘干后用凯式定氮法测定了其中的粗蛋白含量。5 L发酵罐中利用优化条件发酵的大豆粕中粗蛋白的含量由41.57%下降到10.90%,降解率约为73.80%;100 L放大发酵的大豆粕中粗蛋白的含量由41.57%下降到4.75%,降解率约为88.57%。由此可见,相比5 L试验罐,放大罐中发酵的大豆粕粗蛋白降解率更高,降解效果更好。同时也说明随着发酵规模的逐渐放大,大豆粕的降解效果仍然有提升的空间。
3 结语
(1)实验室筛选的针对降解大豆粕生产氨基酸的菌种M1,在5 L发酵罐中的最佳发酵条件为装液量3 L,通气量250 L/h,接种量5%,温度38℃,搅拌速度250 r/min条件下,发酵液中氨基态氮含量达到831μg/mL,降解大豆粕中蛋白质的效果较好。
(2)由5 L试验罐到100 L罐的发酵放大试验,发酵液中氨基态氮含量最高时达到1 051μg/mL,大豆粕中粗蛋白的降解率由73.80%提升到88.57%,表明100 L罐发酵效果更佳,放大方法可行。
综上所述,菌种M1能够适用于工业条件下降解大豆粕产氨基酸的生产,菌种M1为高耗氧菌,工业生产条件可由实验室基础按照体积溶氧系数相等为基准,结合单位体积发酵液的搅拌功率相等,并根据具体生产条件结合工作经验数据调整的放大方法进行放大生产。
[1] 宋国安.大豆资源的开发利用(一)[J].山东食品科技,2004,6(11):4-6.
[2]肖 玲,边四辈.浸出油厂制油工艺对大豆粕品质影响分析[J].饲料工业,2000,21(3):9-10.
[3] 闫贵龙,张建云.改善大豆饼(粕)品质的途径[J].中国饲料,1996,(17):18-20.
[4] 姚小飞,石 慧.大豆多肽的功能特性及其开发应用进展[J].中国食物与营养,2009,(7):44-46.
[5] 吴民熙,王静雅,詹逸舒,等.不同菌种对3种油脂下脚料降解情况的初步研究[J].湖南农业科学,2010,(4):107-109.
[6]颜焱娜.一株芽孢杆菌M1降解不同饼粕粗蛋白比较及扩繁研究[D].长沙:湖南农业大学生物科学技术学院,2010.
[7] 梁世中.生物工程设备[M].北京:中国轻工业出版社,2006.
[8] 3,5-二硝基水杨酸比色法测定还原糖和总糖.[EB/OL].http://www.docin.com/p-50425246.html
[9] 杨虹琦.生物化学与分子生物学实验技术[M].长沙:湖南农业大学理学院生物化学教研室,2005.
[10]黄秀梨.微生物学实验指导[M].北京:高等教育出版社,1999.
[11]姜锡瑞.酶制剂应用手册[M].北京:中国轻工业出版社,1999.292-297.
[12]丘 鑫.烟草专用饼肥粗蛋白高效降解研究[D].长沙:湖南农业大学,2005.

