中药复方板蓝根颗粒抗柯萨奇B4病毒作用的实验研究
刘 钊,赵 鹏,杨占秋
(1中南民族大学药学院,武汉430074;2武汉大学医学院医学病毒学研究所,武汉430071)
柯萨奇病毒(Coxsackie virus)属小核糖核酸科肠道病毒属[1],病原体柯萨奇病毒据其生物学特点分为A和B两类,A组病毒有24个血清型,即A1-A24;B组病毒有6个血清型即B1-B6.柯萨奇病毒可引起脑膜炎和轻度麻痹、胸膜痛、肋间痛、呼吸性疾病、结膜炎以及手足口综合征[2,3].近几年,国内外研究学者研究发现Ⅰ型糖尿病的发病与病毒感染有很大关系,柯萨奇病毒尤其是柯萨奇 B4病毒(CVB4)在Ⅰ型糖尿病中起重要作用[4,5].最近研究发现,CVB4的非结构蛋白P2C与人胰岛素表面的谷氨酸脱羧酶(GAD)具有同源序列,且CVB4无论在体内还是在体外均可侵犯人胰岛B细胞,导致其合成胰岛素功能受损[6].
目前在临床上缺乏有效的抗CVB4特异性的治疗药物和预防方法,且西药普遍存在价格昂贵、副作用大、疗效质疑等缺点.板蓝根是十字花科植物菘蓝Isatis indigotica Fort的干燥根,是公认的有较好的抗病毒效果的中药之一,具有清热解毒、凉血利咽之功效.《本草纲目》记载:板蓝根主治“时口疮,热病发斑,热毒下痢,喉痹、丹毒……”.传统医药和现代药理研究表明,板蓝根的抗病毒活性肯定,对流感病毒的防治效果更佳[7].此外它对肝炎病毒(HBV及HAV)、甲型流感病毒、乙型流感病毒、腮腺炎病毒、乙型脑炎病毒、肾病出液病毒(HFRSV)、单疱病毒(HSV-2)、柯萨奇病毒(CVB3)均有明显的防治作用.本文研究了中药复方板蓝根颗粒体外抗CVB4的作用机理,拟为开发和利用其广谱抗病毒活性提供一定的理论依据和实验基础.
1 实验
1.1 原料与试剂
1.1.1 药物
复方板蓝根颗粒由太极集团重庆中药二厂有限公司生产,国药准字Z50020623,配制成终浓度为80 mg/mL,使用前于 0.04 ~0.06 MPa下灭菌 15 min,冷却后密封置于4℃冰箱中冷藏备用.
1.1.2 细胞
Hep-2(鼻咽癌)细胞为武汉大学医学院医学病毒研究所保存.细胞生长液为含10%新生牛血清的DMEM,细胞维持液为含2%新生牛血清的DMEM,常规加入青霉素100 U/mL、链霉素100 U/mL.
1.1.3 病毒
CVB4于-80℃武汉大学医学院医学病毒学研究所保存,实验前复苏.病毒在Hep-2细胞中活化增殖后,采用Reed-Muench微量法滴定其滴度为10-4.713 TCID50/mL,实验用100 TCID50/mL.
1.1.4 试剂
DMEM为GIBCO公司生产和 MTT(3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐)为Hyclone公司产品.MTT以不含血清的MEM培养基配制成5 g/L溶液,过滤除菌后置4℃冰箱保存备用.二甲基亚砜(DMSO)由上海菲达有限公司提供.新生小牛血清购自三利公司.
1.1.5 主要仪器
Forma Scientific超净工作台,美国制造.TGL-16C型高速台式离心机,上海安亨科学仪器厂生产.OLYMPUS IMT-413型倒置显微镜,日本制造.DG3022-A型酶联免疫检测仪,第四军医大学、国营华东电子管厂联合研制.
1.2 实验方法
1.2.1 药物对细胞毒性的测定
用胰酶将生长良好的Hep-2细胞分散成单个细胞悬液,按1×106个/mL浓度分种于96孔板,每孔0.1 mL.置37 ℃,5%CO2培养箱中培养.24 h后弃培养液上清,换含不同浓度的含药维持液,每孔200 μL.药物的终浓度分别为 125、250、500、1000、2000、4000、640、800、1600 μg/mL.每种浓度重复 4孔,实验同时设正常细胞对照、病毒对照.继续培养72 h后,以MTT(四甲基偶氮唑盐法)法(如1.2.2)检测细胞存活率.并根据细胞存活率,找出药物对细胞的最大无毒浓度范围.
1.2.2 细胞活性的测定(MTT染色法)
根据Mosmann建立的MTT法测定细胞活性.弃培养上清液,每孔加5 mg/mL MTT的不含血清的DMEM 50μL,37℃,5%CO2孵育4~6 h,黄色的MTT被活细胞的线粒体脱氢酶还原成蓝色的甲簪结晶,小心吸出 MTT,PBS洗3次,每孔加50μL DMSO终止反应,振荡混匀,在15 min内甲簪结晶被溶解,在波长570 nm下测定吸光度OD值.OD值与活细胞的数量呈正相关.
1.2.3 药物对CVB4生物合成的抑制作用的测定
于已长成单层的Hep-2细胞96孔板上,每孔接种50μL的100 TCID50的CVB4病毒液,于37℃吸附90 min,弃病毒上清液.根据细胞毒性实验的结果,在药物无毒浓度范围内,加入不同浓度的含药维持液每孔 0.2 mL,药物浓度分别为 100、200、400、800、1600μg/mL;同时设正常细胞对照、病毒对照、阳性药物病毒唑对照.每日观察细胞病变效应(CPE),约在病毒对照CPE为 +++~++++时弃培养液上清液,用MTT法检测病毒抑制率,并计算药物对CVB4的病毒抑制率.
1.2.4 药物抗病毒吸附实验
分别将不同浓度的板蓝根加至Hep-2单层细胞孔中,于 37℃作用 6 h,弃上清液,再加 100 TCID50/mL滴度的CVB4100μL/孔,于37℃吸附90min后,弃上清液,加细胞维持液,37℃、5%CO2培养,逐日观察细胞病变.实验同时设正常细胞对照、病毒对照.
1.2.5 药物直接灭活病毒实验
将100 TCID50/mL滴度的CVB4与不同浓度的板蓝根4℃作用6 h.反应体系为200μL,含100μL的100 TCID50/mL滴度的CVB4和100μL的药物,并保证药物的终浓度与药效学实验相同.然后将混合液接种于单层Hep-2细胞中,孵育1.5 h后,换用2%DMEM培养液维持细胞生长,37℃、5%CO2培养,逐日观察CPE.实验同时设正常细胞对照、病毒对照.
1.2.6 计算公式和分析方法
CPE记录方法:“-”表示无CPE;“+”表示有CPE,且“+”、“++”、“+++”、“++++”依次表示25%、50%、75%、100%的细胞出现CPE.

(1)结合细胞毒性实验和药物抗病毒实验的结果,用统计软件SPSS11.5的Probit回归法计算药物半数毒性浓度TC50和半数有效浓度IC50,得到药物治疗指数(Treatment Index,TI=TC50/IC50).采用治疗指数作为评价指标衡量各药物对病毒抑制的效力.
(2)采用直线相关分析,观察中药板蓝根不同剂量与细胞存活率、病毒抑制率等之间是否存在直线关系,并求出直线回归方程和相关系数.
2 结果与讨论
2.1 药物毒性的效果
中药板蓝根和病毒唑的不同浓度对细胞的毒性
图1 正常Hep-2细胞Fig.1 Normal Hep-2 cell
由表2可知,在100~1600μg/mL浓度范围内,随药物浓度增加,其抗病毒活性增强,病毒抑制率升高.经直线回归分析,药物浓度与病毒抑制率间有直线关系,P<0.01.其直线方程和相关系数分别为:y=14.155+0.023x,r=0.883.药物浓度 > 1600实验结果见表1.通过光镜观察,板蓝根对Hep-2细胞毒性作用表现为:细胞变小,粘连,破碎,脱落,胞浆内颗粒增加,折光性增强.
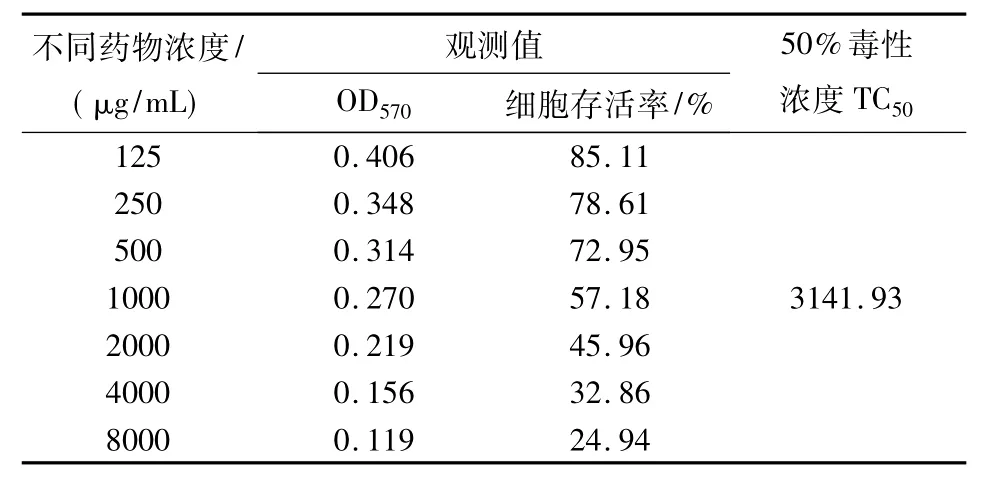
表1 复方板蓝根颗粒对Hep-2细胞的毒性作用Tab.1 Cytotoxity of the isatis root granula prescription to Hep-2 cells
由表1可知,复方板蓝根颗粒的TC50>3000 μg/mL,说明其安全系数大.药物在1000~2000μg/mL范围内细胞存活率约达50%,从而确定该范围药物浓度为抗病毒实验的最高允许浓度;当细胞经较高浓度的药物作用后,死亡细胞数增加,细胞存活率降低.经直线回归分析,药物浓度与细胞存活率之间存在直线关系,P<0.01.病毒唑和板蓝根的直线方程和相关系数分别为:y=73.119-0.007x,r= -0.887.经计算,板蓝根对Hep-2细胞的TC50为 3141.93 μg/mL.
2.2 药物抗病毒生物合成的效果
给药后24~48 h内,镜下观察细胞病变,发现病毒对照孔出现明显的CPE,表现为细胞皱缩、变圆、脱落、碎裂,胞浆内颗粒增多,折光性增强(见图1和图2).试验孔与病毒对照孔有明显的差别,试验孔存活细胞多于病毒对照孔,用MTT法按公式计算板蓝根对CVB4的抑制率,结果见表2.μg/mL时,对CVB4细胞病变抑制程度高于50%,表现较强的抗病毒活性,说明复方板蓝根颗粒能明显抑制CVB4在Hep-2细胞内的生物合成.

图2 Hep-2细胞感染CVB4所致CPEFig.2 Cytopathic effect of Hep-2 cell infected by CVB4
2.3 药物抗病毒吸附的效果
给药后24~48 h内,镜下观察细胞病变,发现病毒对照孔出现明显的CPE,而各给药的不同浓度的试验孔与病毒对照孔均有明显多于病毒对照孔的存活细胞,用MTT法按公式计算板蓝根对CVB4的抑制率,结果见表3.
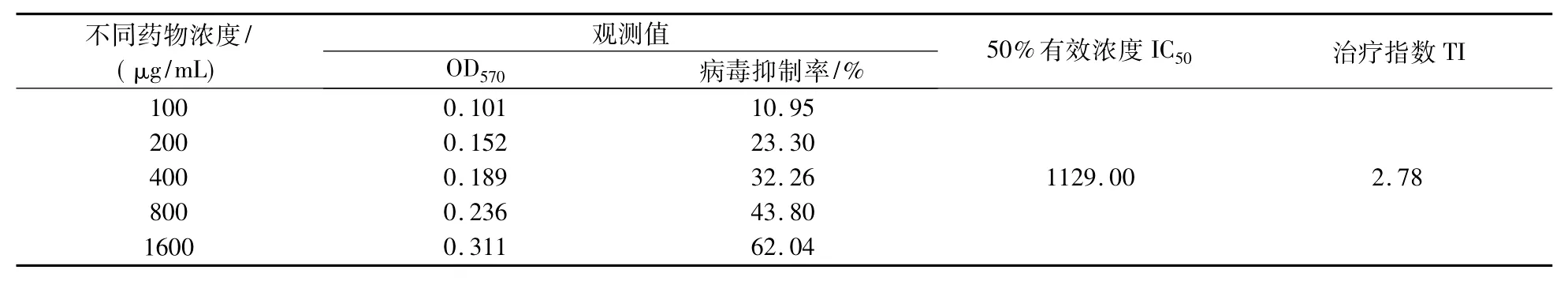
表2 复方板蓝根颗粒的抗CVB4生物合成作用Tab.2 Anti-CVB4 biological synthesis's effect of the Isatis Root granula prescription in vitro
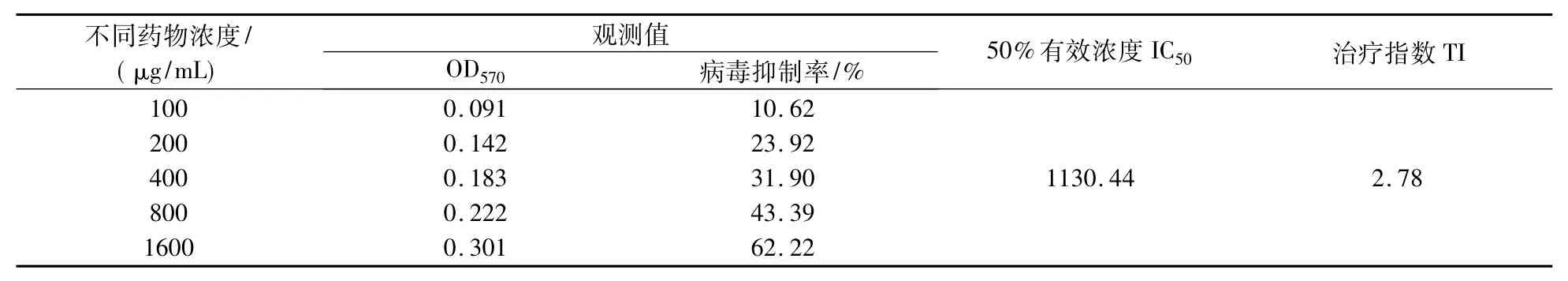
表3 复方板蓝根颗粒的抗CVB4吸附细胞作用Tab.3 Anti-CVB4's adsorption to Hep-2 cells of the Isatis Root granula prescription in vitro
由表3可知,在100~1600μg/mL浓度范围内,随药物浓度增加,其抗病毒活性增强,病毒抑制率升高.经直线回归分析,药物浓度与病毒抑制率间有直线关系,P<0.01.其直线方程和相关系数分别为:y=14.155+0.023x,r=0.966.药物浓度 > 1600 μg/mL时,对 CVB4细胞病变抑制程度可达近50%,表现较强的抗病毒活性,说明复方板蓝根颗粒能明显阻止病毒吸附细胞,从而预防CVB4对Hep-2细胞的感染.经方差分析,药物抗病毒生物合成与抗病毒吸附的 IC50相比,F=7.153,P=0.056,P>0.05,无明显差别.两者的治疗指数 TI值均为2.78,无差别.说明板蓝根在抗CVB4吸附细胞和在细胞内的生物合成上同效.
2.4 药物直接灭活病毒的效果
按实验方法将药物与病毒混合后再作用于细胞,逐日观察细胞病变.发现板蓝根不同浓度组均出现典型CVB4感染所致的CPE,且与病毒对照孔无显著区别,说明板蓝根不能直接杀灭CVB4.
3 结论
中药复方板蓝根颗粒具有体外抗CVB4的作用,其作用是通过阻止CVB4的吸附作用和抑制CVB4在Hep-2细胞内生物合成而发挥,其对CVB4无直接灭活作用.
[1]Pallansch M A,Roos R P.Enteroviruses:polioviruses,coxsackieviruses,echoviruses,and newer enteroviruses[M]//Knipe D M,Howley P M.Fields Virology,Volume 1.5th Edition.Philadelphia:LippincottWilliams& Wilkins,2007:839-893.
[2]Ramsingh A I.CVB-induced pancreatitis and alterations in gene expression[J].Curr Top Microbiol Immunol,2008,323:241-258.
[3]Chapman N M,Kim K S.Persistent coxsackievirus infection:enterovirus persistence in chronic myocarditis and dilated cardiomyopathy[J].Curr Top Microbiol Immunol,2008,323:275-292.
[4]Richardson S J,Willcox A,Bone A J,et al.The prevalence of enteroviral capsid protein vp1 immunostaining in pancreatic islets in human type 1 diabetes[J].Diabetologia,2009,52:1143-1151.
[5]Dotta F,Censini S,van Halteren A G,et al.Coxsackie B4virus infection ofβcells and natural killer cell insulitis in recent-onset type 1 diabetic patients[J].Proc Natl Acad Sci USA,2007,104(12):5115-5120.
[6]Akatsuka H,Yano Y,Gabazza E C,et al.A case of fulminant type 1 diabetes with coxsackie B4virus infection diagnosed by elevated serum levels of neutralizing antibody[J].Diabetes Res Clin Pract,2009,84(3):e50-e52.
[7]Mak N K,Leung C Y,Wei X Y,et al.Inhibition of RANTES expression by indirubin in influenza virus infected human bronchial epithelial cells[J].Biochemical Pharmacology,2004,67:167-174.

