重组人髓鞘少突胶质细胞糖蛋白的表达、纯化及免疫原性*
夏君慧, 翁益云, 李 佳, 张 旭
(温州医学院附属第一医院神经内科,浙江温州325000)
髓鞘少突胶质细胞糖蛋白(myelin oligodendrocyte glycoprotein,MOG)为少突胶质细胞膜结合糖蛋白,是中枢神经髓鞘的重要组成部分,研究显示抗MOG抗体在多发性硬化(multiple sclerosis,MS)的病理过程中起着非常重要的作用,由MOG诱导的实验性自身免疫性脑脊髓炎(experimental autoimmune encephalomyelitis,EAE)是目前国际上公认的MS动物模型[1]。目前国内所使用的MOG多为人工合成的MOG肽段。MOG细胞外Ig样结构域(extracellular immunoglobulin domain of MOG,MOGIgd)含有多个抗原表位,具有很强的免疫原性[2-5],此研究旨在将编码 MOG1-100(包括 MOGIgd)的基因克隆到硫氧还蛋白(thioredoxin,TrxA)融合表达载体pET32a(+)中,在BL21(DE3)trxB-宿主菌中得到目的蛋白表达,并探讨表达产物MOGIgd-TrxA融合蛋白能否作为免疫原诱导EAE动物。
材料和方法
1 材料
1.1 菌种和质粒 大肠杆菌DH5α华山医院神经病研究所樊永峰博士惠赠;表达载体pET32a(+)(Novagen产品)由复旦大学医学院分子生物室孙兴会博士惠赠;宿主菌BL21(DE3)trxB-(Novagen产品)为复旦大学生命科学院葛晓春老师惠赠。
1.2 引物 上游引物 P1:5'-GCAGAATTCGGGCAGTTCAGAGTGATAGGA-3’,含EcoRI酶切位点;下游引物P2:5'- ACATCTCGAGTCGGAAGAAGCAGGTGAAAC - 3’,含XhoI酶切位点。由上海生工合成。
1.3 主要试剂及设备 Trizol试剂盒、RT-PCR试剂盒(TaKaRa);Xho I、EcoRI限制性内切酶和T4 DNA连接酶、质粒抽提试剂盒及DNA纯化试剂盒(上海博彩生物有限公司);细胞培养用胰化蛋白胨及酵母提取物(Gibco-BRL);异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactopyranoside,IPTG)及咪唑(上海普飞生物技术有限公司);Ni-NAT His.Bind Resins(Novagen产品);丙烯酰胺、N,N'- 亚甲双丙烯酰胺、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、过硫酸胺及 N,N,N',N'- 四甲基乙二胺(tetramethyl ethylene diamine,TEMED)(Sigma),乙二胺四乙酸(ethylene diamine tetraacetie,EDTA);羊毛脂、液体石蜡、结核杆菌(H37Rv)及百日咳毒素(pertussis toxin,PT,Sigma)。高速匀浆机(上海标本模具厂),台式低温冷冻离心机(Beckman),空气浴振荡器(哈尔滨东明医疗仪器厂),垂直电泳仪(Bio-Rad)。
1.4 动物 体重18-20 g、8-10周龄雌性 C57BL/6小鼠(上海斯莱克实验动物有限责任公司);体重180-200 g白色豚鼠(温州医学院实验动物中心),雌雄不拘。
2 方法
2.1 表达载体pET32a-MOGIgd的构建和鉴定 RT-PCR、酶切、连接及转化采用常规方法;采用试剂盒抽提质粒。应用限制性内切酶Eco RI及Xho I对重组质粒进行初步鉴定,再送上海申能博彩生物技术有限公司测序。
2.2 MOGIgd-TrxA融合蛋白与TrxA蛋白的表达及鉴定将筛选所得的重组质粒pET32a-MOGIgd及pET32a(+)转化大肠杆菌BL21-trxB-,分别涂LB/(50 mg/L氨苄青霉素、15 mg/L卡那霉素)琼脂板上,37℃培养12-16 h。挑阳性菌落分别接种3 mL双抗生素培养液试管中,培养过夜。各取1 mL菌液加入100 mL的双抗生素培养液中,37℃、250 r/min振荡至A600≈0.8,加入1 mol/L IPTG于30℃、250 r/min振荡5 h,收集菌体。部分菌体予渗透休克处理,离心后取上清及沉淀;部分菌体经超声粉碎、裂解液处理,离心后取上清及沉淀。行SDS-PAGE以确定是否有目的蛋白表达,目的蛋白以可溶性形式表达或以包涵体形式表达。
2.3 MOGIgd-TrxA融合蛋白与TrxA蛋白纯化 扩大体积诱导BL21-trxB-/pET32a- MOGIgd菌及 BL21-trxB-/pET32a(+)菌表达。上一步实验证实MOGIgd-TrxA融合蛋白以包涵体形式表达,故通过分离包涵体粗提MOGIgd-TrxA融合蛋白,BL21-trxB-/pET32a-MOGIgd发酵液离心后弃上清,沉淀用 TE缓冲液(10 mmol/L Tris,1 mmol/L EDTA,pH 8.0)悬浮,超声粉碎菌体15 s×6次,每次间隔20 s,裂解菌液离心后弃上清,沉淀即包涵体用0.9%生理盐水洗涤1次。包涵体经金属螯合亲和层析柱进一步纯化,上述包涵体加入结合缓冲液(8 mol/L urea;0.1 mol/L NaH2PO4;0.01 mol/L Tris-HCl,pH 8.0)打匀,离心留上清;取 Ni- NAT His.Bind Resins,注入层析柱,结合缓冲液平衡后自然沉淀,接核酸蛋白检测仪,取波长280 nm;加样,反复打匀后自然沉淀,打开下阀门,出现第1峰直至恢复至基线,洗涤缓冲液(8 mol/L urea;0.1 mol/L NaH2PO4;0.01 mol/L Tris - HCl,pH 6.3)冲洗,洗脱液(8 mol/L urea;0.1 mol/L NaH2PO4;0.01 mol/L Tris-HCl,pH 4.5)洗脱,收集流出峰。TrxA蛋白以可溶性形式表达,通过渗透休克粗提TrxA蛋白,加入结合缓冲液(50 mmol/L NaH2PO4,pH 8.0;0.3 mol/L NaCl;10 mmol/L 咪唑,pH 8.0)上层析柱,洗涤缓冲液(50 mmol/L NaH2PO4,pH 8.0;0.3 mol/L NaCl;20 mmol/L 咪唑,pH 8.0)洗涤,洗脱液(50 mmol/L NaH2PO4,pH 8.0;0.3 mol/L NaCl;250 mmol/L咪唑,pH 8.0)洗脱,收集流出峰。
2.4 抗原制备及模型制作 将获得的MOGIgd-TrxA融合蛋白、TrxA蛋白和生理盐水分别与完全福氏佐剂(complete Freund's adjuvant,CFA)等体积混匀,制成油包水型乳剂。C57BL/6小鼠随机分为3组,MOGIgd-TrxA组(MOG组)、硫氧还蛋白组(TrxA组)及正常对照组(NC组),12只/组,以相应抗原乳剂免疫小鼠制作EAE模型,采用Kono标准5分法[6]对小鼠进行临床功能评分。详细过程见李佳等[7]所述。
2.5 病理学观察 高峰期处死小鼠,取出脑、脊髓组织后制作石蜡切片,厚度为6 μm,同一部位同时切取2张切片,分别行苏木素-伊红(hematoxylin-eosin,HE)染色及髓鞘Luxol fast blue染色。
结 果
1 MOGIgd蛋白cDNA克隆、融合表达及纯化
1.1 表达载体 pET32a-MOGIgd的构建及鉴定 人脑总RNA进行RT-PCR,将322 bp目的基因片段回收后,利用引物上所带Xho I和EcoR I酶切位点将基因片段切出连入载体pET32a(+)中。双酶切后显示1条303 bp片段,见图1。进一步送上海博彩生物有限公司测序,结果显示与编码MOG1-100的碱基序列完全一致,表明MOGIgdcDNA已正确克隆到pET32a(+)载体中。
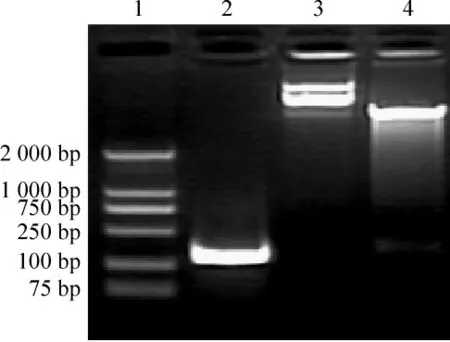
Figure 1.Restriction analysis of pET32a - MOGIgd.1:DNA marker;2:MOGIgdcDNA;3:pET32a-MOGIgd;4:pET32a-MOGIgddigested with XhoⅠand EcoR Ⅰ图1 pET32a-MOGIgd的酶切鉴定
1.2 MOGIgd-TrxA融合蛋白与TrxA蛋白的表达及鉴定携有重组表达载体pET32a-MOGIgd和pET32a(+)的大肠杆菌BL21-trxB-经IPTG诱导5 h后,菌体裂解物进行SDSPAGE分析。结果显示MOGIgd-TrxA融合蛋白位于约32 kD处,经灰度扫描分析显示表达量占菌体总蛋白的42%左右,并以包涵体形式存在;而无插入的pET32a(+)表达约21 kD的单体蛋白TrxA,经渗透休克释放于上清液中,见图2。

Figure 2.Expression of MOGIgd-TrxA fusion protein and TrxA protein in BL21(DE)trxB-.1:protein marker;2,3:pET32a-MOGIgdbacteria before induction and after 5- hour induction,respectively;4,5:supernatant and pellet fractions from induced pET-MOGIgdbacteria after sonication,respectively;6,7:pET - 32a(+)bacteria before induction and after 5-hour induction,respectively;8,9:supernatant and sediment from induced pET -32a(+)bacteria after osmotic shock,respectively.图2 MOGIgd-TrxA融合蛋白和TrxA单体蛋白在BL21(DE)trxB-菌中的表达
1.3 MOGIgd-TrxA融合蛋白与TrxA蛋白纯化 经金属螯合亲和层析纯化后MOGIgd-TrxA与TrxA蛋白的纯度达95%左右,见图3。
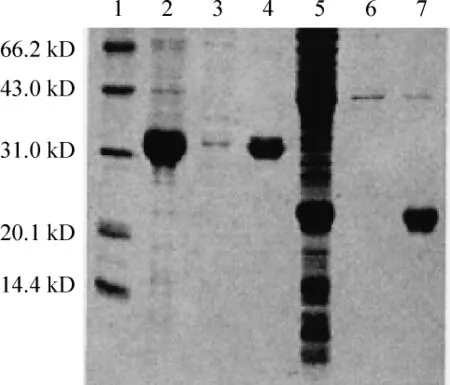
Figure 3.Purification of MOGIgd-TrxA fusion protein and TrxA protein.1:protein marker;2:pET32a-MOGIgdinclusion body;3:flow through;4:purified MOGIgd-TrxA;5:supernatant of induced pET32a(+)bacteria after osmotic shock;6:flow through;7:purified TrxA protein.图3 MOGIgd-TrxA融合蛋白与TrxA蛋白纯化
2 MOGIgd-TrxA融合蛋白诱导EAE模型
2.1 临床症状及神经功能评分 发病小鼠多表现为尾部张力下降,后肢麻痹,弓背,全身震颤,体重下降(部分小鼠体重下降不明显)。MOG组小鼠发病率为75%(9/12),于免疫后第(12.14±2.04)d发病,症状达峰时间为发病后(4.43±1.13)d,高峰期神经功能评分为(2.64±0.48),随着观察期的延长,小鼠的病程呈慢性非缓解型,症状稍有波动。TrxA组和NC组小鼠无发病。
2.2 病理检测 HE染色发现,MOG组存在炎症浸润,炎症病灶主要累及脊髓实质、灰白质交界处、侧脑室周围及大脑皮髓质交界处以至深部白质等部位,受累部位表现为以单核细胞为主的炎症细胞浸润。髓鞘Luxol fast blue染色可见白质疏松,颜色淡染,局部斑片状髓鞘脱失,主要累及侧脑室旁、脑干、小脑等部位,见图4。TrxA组和正常对照组均无上述表现。

Figure 4.Confluent demyelination near the lateral ventricle of MOG group(Luxol fast blue staining,×400).图4 MOG组侧脑室旁脱髓鞘病灶
讨 论
MS是原发性中枢神经系统炎性脱髓鞘疾病,临床表现为慢性复发性或慢性进展性病程,病理表现为炎性细胞浸润及髓鞘脱失。EAE是MS的经典动物模型,MOG主动免疫可诱导出慢性复发性EAE,伴有广泛的髓鞘脱失,与MS非常相似[1]。MOG最先由Linington等[8]于1984年用小鼠单抗8-18C5发现并命名,为特异性表达在中枢神经系统少突胶质细胞的膜结合蛋白,位于髓鞘结构的最外层。成熟的MOG由218个氨基酸组成,其胞外段含1个免疫球蛋白样可变结构域,具有多个T细胞和B细胞表位,有很强的免疫原性。MOG具有高度疏水性,且含量极微,仅占人类中枢神经系统髓鞘蛋白的0.05%-0.10%,所以从组织中纯化到足够量的MOG极为困难。目前主要通过人工合成的方法获得MOG肽段,运用最多的为MOG35-55,但合成肽段技术要求高,价格昂贵。本研究用分子克隆技术将MOG胞外段包括MOGIgd在内的第1-100位氨基酸的cDNA克隆到表达载体pET32a(+)中,在BL21(DE3)trxB-宿主菌中实现了融合表达,表达量占总菌体蛋白的42%左右。此法具有产量高、纯化方便的优势。
国外学者曾以多种原核表达系统表达MOG的胞外段,产物均形成包涵体[9,10]。我们所要表达的 MOGIgd预测分子量仅11 kD左右,等电点为9.14,含有1个二硫键。选择TrxA作为融合表达系统,是由于TrxA参与细胞内一些蛋白质的二硫键形成,可以帮助蛋白质正常折叠,从而产生有活性的可溶蛋白质,同时避免细胞膜内蛋白酶的降解。另外,多种TrxA融合蛋白质可以通过渗透休克从大肠杆菌中定量地释放出来,可用作初步纯化融合蛋白的有效手段[11]。pET32a(+)表达载体运用了经过改造的BL21(DE3)trxB-宿主菌,该菌内的TrxA还原酶被突变,更有利于二硫键的形成。令人遗憾的是,虽然采用改变温度、细胞密度及诱导剂的浓度等措施,但最终MOGIgd-TrxA融合蛋白仍以包涵体的形式表达,这可能与MOGIgd本身的化学结构有关。本研究通过超声破菌等处理获得包涵体,对MOGIgd-TrxA融合蛋白进行初步纯化。由于pET32a(+)载体在TrxA与目的蛋白之间插入组氨酸标签,此标签可与金属离子螯合,通过金属螯合亲和层析柱进一步纯化,获得纯度为95%左右的目的蛋白。
我们曾利用获得的MOGIgd-TrxA融合蛋白为包被抗原,成功检测MS患者血清和脑脊液中抗MOG抗体,证实其具有抗原性[12]。本研究证实MOGIgd-TrxA融合蛋白具有免疫原性,将其主动免疫C57BL/6小鼠,实验动物EAE的成模率为75%,呈慢性非缓解病程,病灶多发,累及脊髓、大脑半球、小脑及脑干,病理表现为以单核细胞为主的炎症细胞浸润及髓鞘脱失。TrxA组小鼠不管临床还是病理上均无类似表现,证明TrxA无免疫原性。
综上所述,本研究成功建立人MOGIgd的TrxA融合表达系统,通过较为简便的方法获得高产量、高纯度的MOGIgd-TrxA融合蛋白,MOGIgd融合蛋白具有免疫原性,可作为免疫原诱导EAE动物模型。
[1]Johns TG,Kerlero de Rosbo N,Menon KK,et al.Myelin oligodendrocyte glycoprotein induces a demyelinating encephalomyelitis resembling multiple sclerosis[J].J Immunol,1995,154(10):5536 -5541.
[2]Gardinier MV,Amiguet P,Linington C,et al.Myelin/oligodendrocyte glycoprotein is a unique member of the immunoglobulin superfamily[J].J Neurosci Res,1992,33(1):177-187.
[3]Ichikawa M,Johns TG,Adelmann M,et al.Antibody response in Lewis rats injected with myelin oligodendrocyte glycoprotein derived peptides[J].Int Immunol,1996,8(11):1667-1674.
[4]Ichikawa M,Johns TG,Liu J,et al.Analysis of the fine B cells pecificity during the chronic/relapsing course of a multiple sclerosis-like disease in Lewis rats injected with the encephalitogenic myelin oligodendrocyte glycoprotein peptide 35 - 55[J].J Immunol,1996,157(2):919 -926.
[5]Kerlero de Rosbo N,Mendel I,Ben-Nun A.Chronic relapsing experimental autoimmune encephalomyelitis with a delayed onset and an atypical clinical course,induced in PL/J mice by myelin oligodendrocyte glycoprotein(MOG)-derived peptide:preliminary analysis of MOG T cell epitopes[J].Eur J Immunol,1995,25(4):985 - 993.
[6]Kono DH,Urban JL,Horvath SJ,et al.Two minor determinants of myelin basic protein induce experimental allergic encephalomyelitis in SJL/J mice[J].J Exp Med,1988,168(1):213 -227.
[7]李 佳,王婷婷,杨得奖,等.MOG诱导小鼠实验性自身免疫性脑脊髓炎及其对CD4+CD25+调节性T细胞的影响[J].中国病理生理杂志,2009,25(8):1543-1547.
[8]Linnington C,Webb M,Woodhams PL.A novel myelinassociated glycoprotein defined by a mouse monoclonal antibody[J].J Neuroimmunol,1984,6(6):387 -396.
[9]Bettadapura J,Menon KK,Moritz S,et al.Expression,purification,and encephalitogenicity of recombinant human myelin oligodendrocyte glycoprotein[J].J Neurochem,1998,70(4):1593 -1599.
[10]Reindl M,Linington C,Brehm U,et al.Antibodies against the myelin oligodendrocyte glycoprotein and the myelin basic protein in multiple sclerosis and other neurological diseases:a comparative study[J].Brain,1999,122(Pt 11):2047-2056.
[11]颜子颖,王海林 译.精编分子生物学实验指导[M].第1 版.北京:科学出版社,1998.652 -657.
[12]夏君慧,张 旭.髓鞘少突胶质细胞糖蛋白抗体在多发性硬化中的意义[J].中国神经免疫学和神经病学杂志,2008,15(6):397 -399,412.

