阿霉素预处理的小鼠红白血病细胞降低红白血病细胞的成瘤性
杨理婷, 吴秉毅△, 苏嘉霖, 郭坤元
(南方医科大学珠江医院1血液科,2内分泌科,广东 广州510282)
细胞死亡分为凋亡、自体吞噬、坏死、有丝分裂失败和胀亡[1],以凋亡和坏死较为常见。最近的研究表明:凋亡又可根据凋亡细胞表面能否表达引起机体免疫攻击的蛋白分子分为生理性死亡和免疫原性死亡[2]。
化疗是抗肿瘤的常规治疗方法之一,以往认为其主要作用机制是通过诱导肿瘤细胞发生凋亡达到清除肿瘤的目的。最近有研究[3-5]发现,蒽环类化疗药物在诱导肿瘤细胞发生凋亡的同时,通过促进凋亡中的肿瘤细胞表面发生标志物的暴露、释放物质到胞外、介导微环境等改变等多种机制增强凋亡中肿瘤细胞的免疫原性。如促进细胞膜上钙网蛋白(calreticulin,CRT)、热休克蛋白(heat shock proteins,HSPs)、MHC I类分子等表达,促进其释放免疫刺激物[如分泌高迁移率族蛋白B1(high mobility group box protein 1,HMGB-1)、核酸及其代谢产物等]以及改变肿瘤微环境等[6,7]。这些凋亡细胞能被机体免疫细胞,特别是被树突状细胞(dentritic cells,DCs)所摄取,诱发机体免疫系统对肿瘤细胞的攻击[8]。肿瘤细胞的这类能被免疫系统识别并攻击的凋亡称为肿瘤细胞免疫原性死亡(immunogentic cell death)[9,10]。这些免疫效应可能对化疗疗效有其独特的作用,通过研究化疗中肿瘤细胞的免疫原性死亡机制可进一步探索肿瘤传统化疗有机结合免疫治疗的策略,还可能指导化疗疗效的预后评估。
目前,化疗药物诱导血液肿瘤细胞发生免疫原性死亡的研究甚少,尤其是建立小鼠模型方面尚无相关报道。我们在前期工作中已成功将小鼠红白血病(mouse erythroleukemia,MEL)细胞成功种植于具有正常免疫功能的昆明(Kunming,KM)小鼠体内,构建了适合本实验研究的小鼠红白血病模型。在此基础上,选取了蒽环类化疗药物阿霉素(adriamycin,ADM)作用于MEL细胞,参考Obeid等[11]实验方法,进行小鼠体内实验,观察小鼠荷瘤情况的变化,探讨ADM是否可能诱导MEL细胞发生免疫原性死亡从而降低活性MEL细胞在KM小鼠体内的成瘤性。
材料和方法
1 材料
1.1 主要试剂 RPMI-1640培养基、胎牛血清均购于Hyclone;青-链霉素双抗购于吉诺生物技术有限公司;盐酸多柔比星注射液购于深圳万乐药业有限公司,规格为10 mg/支,批号为0903E1;Hoechst染色试剂盒购于碧云天公司;细胞凋亡检测试剂盒购于南京凯基生物公司;甲醛、瑞氏染料购于广州化学试剂公司。
1.2 细胞和动物 清洁级雄性KM小鼠,4-6周龄,18-20 g,30只(购自南方医科大学动物实验中心,动物合格证号为0067799。饲养于中山大学实验动物中心层流室,符合SPF要求,所用的水、饲料及垫料均经高压消毒处理,每隔2-3 d换1次垫料。实验过程中对动物的处置符合动物伦理学标准。小鼠MEL购自北京协和细胞资源中心。
2 方法
2.1 MEL细胞的体外培养 MEL细胞采用含10%胎牛血清、1×105U/L青霉素、100 mg链霉素的RPMI-1640完全培养液,在37℃含5%CO2、饱和湿度的培养箱中培养,每2-3 d全量换液,挑选对数生长期细胞进行实验。
2.2 ADM目标浓度的确定 取对数生长期的MEL细胞接种于6孔板(1×106/well),990 μL/well细胞悬液。ADM 10 mg,使用灭菌注射用水配成母液,浓度为3 200 mg/L,-20℃避光保存。实验需要时取出ADM母液,使用灭菌注射用水倍比稀释成4个浓度梯度的工作液(100 mg/L、200 mg/L、400 mg/L和800 mg/L),各取 10 μL 加入每孔 990 μL 细胞悬液中,使 ADM 终浓度为 1 mg/L、2 mg/L、4 mg/L和8 mg/L。每个浓度重复6孔。共孵育24 h后收集每孔细胞于1.5 mL EP管中行下列2项操作。
①Hoechst 33258染色检测MEL细胞的凋亡 离心收集1.5mL EP管中的1×106个细胞,PBS洗涤2次,加入1 mL Hoechst染色固定液,4℃固定细胞10 min。离心去除固定液,用PBS洗涤2次,离心后留50 μL PBS重悬细胞并制备细胞涂片,自然晾干。滴加100 μL Hoechst 33258染色液,室温避光染色10 min,水冲洗晾干,滴1滴抗荧光淬灭封片液于载玻片上,盖上玻片。避光条件下以350 nm波长激发,荧光显微镜下观察。实验重复3次。通过此法可以估计不同浓度的ADM使MEL细胞发生凋亡的粗略比例。
②流式细胞术检测MEL细胞的凋亡 离心收集1.5 mL EP管中的1 ×106个细胞,PBS洗涤2次,然后重悬细胞于200 μL结合缓冲液,再加入5 μL Annexin V-FITC和5 μL DAPI,混匀,避光室温反应15 min。PBS洗涤2次,去除多余荧光染料,流式细胞术(flow cytometry,FCM)检测MEL细胞的凋亡(激发波长488 nm)。根据 Obeid等[11,12]报道,确定 DAPI-/Annexin V+与 DAPI+/Annexin V+比例之和为70%左右的ADM目标浓度。实验重复3次,每次均设阴性对照。
2.3 红白血病小鼠模型的建立 收集对数生长期MEL细胞于离心管,1 000 r/min离心5 min,去上清,加PBS洗3次,PBS重悬调整细胞密度为5×109/L。雄性KM小鼠经固定器固定后,络和碘、乙醇常规消毒尾部皮肤,经尾静脉接种1×106个(0.2 mL)MEL细胞,络和碘消毒针口,压迫止血,云南白药覆盖创面。(1)外周血(peripheral blood,PB)观察:小鼠濒死或80 d时断尾取外周血,1∶50倍稀释于1%冰醋酸溶液,计算白细胞数目,留取外周血涂片行瑞氏-吉姆萨染色,在光镜下观察细胞形态并计数有核细胞百分率。(2)骨髓(bone marrow,BM)片观察:濒死小鼠颈椎脱臼法处死后立即进行骨髓原始细胞百分率的检测。骨髓涂片制作方法:去掉小鼠大腿皮肤和肌肉,暴露其股骨及两端关节,从股骨两端关节头处取下股骨,剪断股骨两端,用抽满空气的1 mL注射器插入骨髓腔,挤压空气冲出骨髓液滴于洁净的玻片中间,迅速涂片使其均匀铺开,晾干固定,行瑞氏-吉姆萨染色。于光学显微镜下计数500个有核细胞,对细胞进行分类计数。(3)组织病理学检查:待小鼠濒死时,颈椎脱臼法将其处死,立即取小鼠的肝、脾、骨髓,经4%甲醛固定脱水、透明、浸蜡、包埋,制成石蜡切片,HE染色后在光镜下观察,确定小鼠的死亡原因。
2.4 实验分组 30只雄性KM小鼠随机分为小鼠红白血病模型组(模型组)、ADM治疗组(ADM组)、空白对照组(对照组),10只/组。模型组:尾静脉注射无菌PBS,200 μL/只。8 d后收集对数生长期的MEL细胞,无菌 PBS洗涤3次,1 000 r/min离心5 min,PBS重悬,调整细胞密度至5×1012/L,行尾静脉注射MEL细胞1×106/只(200 μL)。ADM 组:目标浓度的ADM(通过流式细胞术确定为4 mg/L)与MEL细胞于培养瓶中共孵育24 h,离心收集,调整细胞密度至9×106/只(200 μL),行尾静脉注射。8 d后与A组处理相同。对照组:不做任何人为干预。每隔1-2 d观察小鼠,小鼠濒死时或存活至第80 d时检测小鼠外周血白细胞(white blood cell,WBC)数目及体重,记录小鼠患病情况和生存时间。
3 统计学处理
采用SPSS 13.0软件分析,计量资料采用均数±标准差(±s)表示,生存时间采用Kaplan-Meier法进行生存分析,其余多组均数的比较采用 Oneway ANOVA检验。

Figure 1.Morphological nucleus changes of MEL cells after ADM treatment.A:MEL cells(phase-contrast microscope,×100);B:MEL cells treated with 4 mg/L ADM for 24 h(phase-contrast microscope,×100);C:MEL cells(Hoechst 33258 staining,×400);D:MEL cells treated with 4 mg/L ADM for 24 h(Hoechst 33258 staining,×400).图1 4 mg/L ADM作用24 h后MEL细胞和细胞核的形态改变
结 果
1 ADM可在体外诱导MEL细胞发生凋亡
1.1 ADM对MEL细胞形态的影响 光学倒置显微镜下观察:MEL细胞呈圆形,大小较均一,折光性好,透亮,边缘清楚,见图1A。用4 mg/L ADM处理24 h后,MEL细胞生长状态变差,部分细胞出现皱缩,胞体变小,细胞碎片增多,折光性减弱,胞质中出现空泡,见图1B。Hoechst 33258染色后荧光显微镜下显示:MEL细胞核呈圆形,大小比较一致,荧光强度比较均一,见图1C。与之相比,经4 mg/L ADM处理24 h后的MEL细胞有部分出现细胞核浓缩,可见凋亡小体,见图1D。
1.2 ADM目标浓度的确定 细胞凋亡结果为DAPI-/Annexin V+与 DAPI+/Annexin V+比例之和为70%左右时的ADM浓度为4 mg/L。其中1次流式细胞仪检测结果见图2。
2 通过尾静脉输注MEL细胞给KM小鼠可导致小鼠红白血病
结合白细胞数目、细胞形态学和病理组织学等综合评定模型建立是否成功。小鼠濒死时外周血白细胞计数明显升高。濒死小鼠外周血涂片幼稚红细胞占3% -6%,以中、晚幼红细胞为主,可见原始和早幼红细胞。骨髓涂片示有核细胞增生明显活跃,红系及粒系增生明显;幼红细胞≥50%,以原始和早幼红细胞为主,可见双核。骨髓非红系有核细胞(non-erythroid cells,NEC)中原始细胞≥30%,原始粒细胞呈圆形,染色质细致,核仁明显,胞质少。符合急性红白血病的诊断标准[13,14]。发病小鼠外观及外周血、骨髓涂片见图3。KM小鼠接种MEL细胞后100%发病,发病小鼠肝、脾明显肿大。取发病小鼠肝、脾、骨髓行病理学检查,镜下见肝、脾正常组织结构破坏,有弥漫性白血病细胞浸润;高剂量组在心脏、肾脏组织中都能发现肿瘤细胞浸润;血管内有瘤细胞淤滞。组织中肿瘤细胞形态(图4)较培养瓶中的MEL细胞(图3A)有所改变。骨髓中白血病细胞浸润,原始及幼稚红细胞、粒细胞比例明显增加。肝、脾、骨髓病理结果见图4。

Figure 2.FCM result of MEL cells treated with ADM for 24 h.图24 mg/L ADM作用于MEL细胞24 h后流式细胞术结果
3 用ADM诱导的具有70%凋亡率的MEL细胞预先处理KM小鼠,可降低活性MEL细胞在KM小鼠体内的成瘤性,延长红白血病KM小鼠的生存期
观察至80 d时,模型组小鼠全部病死,濒死小鼠出现纳差、懒动、消瘦、蜷缩等现象;ADM组仍有1只小鼠存活;对照组小鼠全都存活。模型组和ADM组小鼠濒死或第80 d时外周血WBC数目、体重和生存时间较对照组分别升高、降低和缩短。但是,ADM组小鼠较模型组小鼠外周血WBC数目降低(P<0.01),体重增加(P <0.01),生存时间延长(P <0.01),见表1、图5。
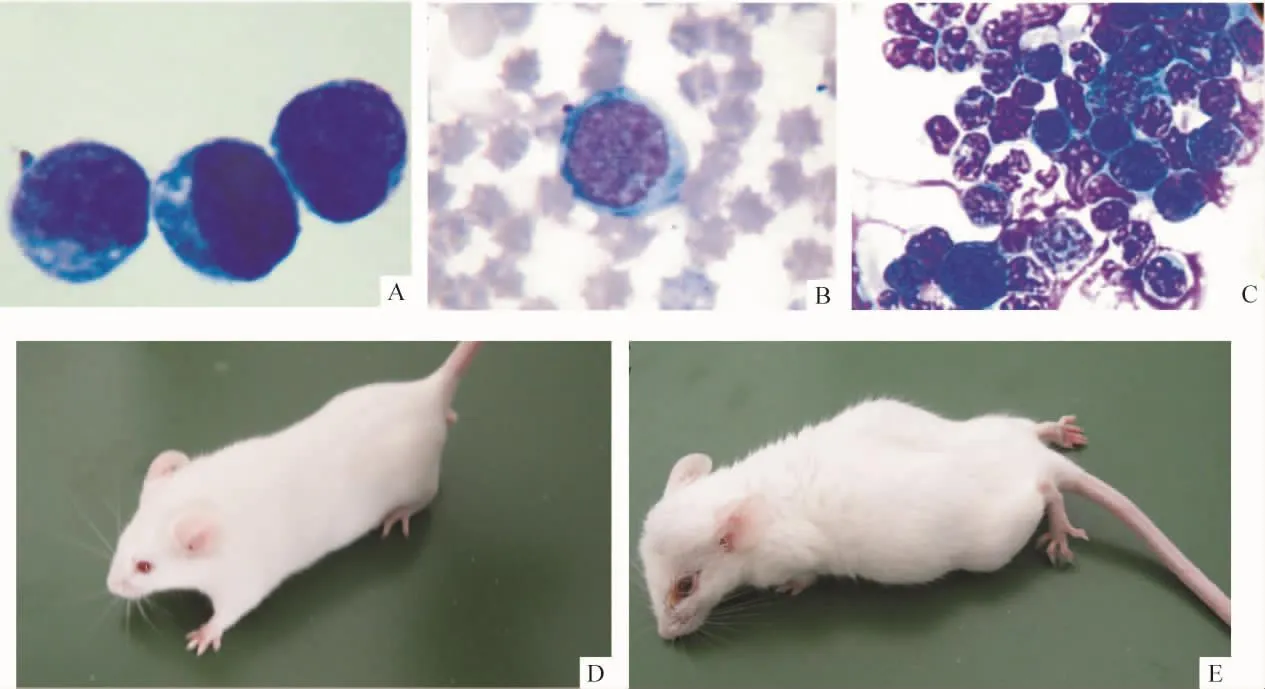
Figure 3.Leukemia cells in peripheral blood(PB)and bone marrow(BM)of mice on the brink of death(Wright-Giemsa staining).A:the smears of MEL cells from culture bottle(×1 000);B:the smears of erythroid progenitor cells from PB(×1 000);C:the smears of leukemia cells from BM(×400);D:normal KM mice(general camera);E:KM mice on the brink of death(general camera).图3 濒死小鼠外周血、骨髓涂片中白血病细胞
讨 论
根据文献[15-18]报道的MEL细胞遗传学背景及生物特性,我们建立了MEL细胞输注KM小鼠的红白血病模型。本研究表明,通过尾静脉途径给予KM小鼠输注1×106个MEL细胞后,其濒死时外周血白细胞升高,外周血及骨髓涂片中幼稚红细胞、幼稚粒细胞比例增加,肝、脾、骨髓病理学检查发现肿瘤细胞弥漫浸润,全身呈恶病质状态,与人红白血病的病理生理相似。
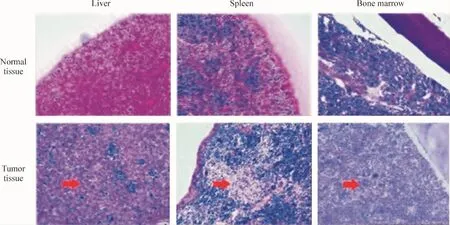
Figure 4.The histopathological examination of organs in erythroleukemic mice(HE staining,×100).Tumor cell invasion was oberved in the liver,spleen and bone marrow of mice in model group(indicated by red arrows)图4 小鼠组织病理检查结果
表1 各组KM小鼠外周血白细胞数目、体重和生存时间Table 1.The WBC count in PB,weight and survival time of the experimental KM mice(±s.n=10)

表1 各组KM小鼠外周血白细胞数目、体重和生存时间Table 1.The WBC count in PB,weight and survival time of the experimental KM mice(±s.n=10)
**P <0.01 vs ADM group.
Group WBC count in PB on the brink of death(×109/L)Weight on the brink of death(g)Survival time(d)MEL model 16.06±3.38** 28.42±4.33** 28.00±8.43**ADM 11.02±2.69 40.24±3.22 56.00±12.68 Control 5.81±0.88** 45.91±2.14** 80.00±0.00**
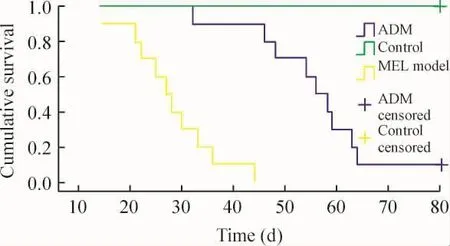
Figure 5.The survival curves of MEL model group,ADM group and control group in Kaplan -Meier analysis.图5 不同处理组的生存曲线
实验观察到4 mg/L ADM作用于MEL细胞24 h后,流式细胞术检测DAPI-/Annexin V+与DAPI+/Annexin V+比例之和约为70%,说明其诱导MEL细胞发生早期和晚期凋亡的比例大约为70%。根据Obeid等[11]报道,处于此凋亡比例范围中的濒死肿瘤细胞(dying cells)可以发生免疫原性死亡,而且剩下约30%未发生凋亡的肿瘤细胞也不会致瘤,可能与这部分没有凋亡的细胞已经程序化定位有关,它们不久后即将死亡。小鼠体内瘤负荷的减少被认为是濒死肿瘤细胞(dying cells)诱导抗肿瘤免疫反应的一个重要指标[11]。然而评估小鼠瘤负荷状态,在实体瘤方面可以很直观地通过观察小鼠皮下瘤的直径大小、重量、消长的变化来衡量;在恶性血液系统疾病方面则可以通过小鼠外周血白细胞数目、体重、生存时间的变化来评估。
本实验研究中,与小鼠红白血病模型组相比较,阿霉素诱导治疗组小鼠在外周血白细胞水平、体重、生存时间3个指标上均反映其体内瘤负荷水平明显降低;可以说明通过4 mg/L ADM处理24 h后的濒死MEL细胞发生了免疫原性死亡,诱导了抗肿瘤免疫应答。但是,与空白对照组相比较,说明其仍处于疾病状态,体内仍存在一定的瘤负荷水平,可能难以达到临床意义上的完全缓解。
濒死肿瘤细胞发生免疫原性死亡的机制主要与其细胞膜上CRT的外翻有关[11]。以往研究认为,细胞凋亡早期出现细胞膜内侧磷脂酰丝氨酸(phosphatidylserine,PS)外翻到细胞膜外侧,促进吞噬细胞(主要是巨噬细胞),而非DCs对其识别和吞噬,同时巨噬细胞释放炎症抑制因子抑制免疫反应,这时的凋亡是非免疫原性的。近期有研究[11,12]报道,肿瘤细胞在蒽环类化疗药物的作用下,其内质网中的钙网蛋白(endo-calreticulin,endo-CRT)被诱导转移至细胞外膜上(凋亡几分钟至数小时之间),早于PS外翻(凋亡12 h后)。细胞外膜上的CRT通过相应受体介导DCs成熟,对其识别和吞噬,并将肿瘤抗原递呈给CD4+、CD8+T细胞,从而发挥抗肿瘤免疫,此时的凋亡具有免疫原性。CRT转移至细胞膜外的机制目前尚未完全明确,可能与肿瘤细胞内质网中真核细胞起始因子(eukaryotic initiation factor-2a,eIF-2a)磷酸化及caspase的激活有一定关系。
Obeid 等[12,19]应用蒽环类化疗药物(阿霉素、去甲柔红霉素、米托蒽醌)及 γ-放疗处理 CT26、MCA205瘤细胞,使瘤细胞达到70%凋亡率,发生免疫原性死亡,细胞膜高表达CRT。用中和抗体阻断CRT,或siRNA技术下调CRT的表达,都能显著抑制蒽环类药物处理的肿瘤细胞被DCs识别,而重组CRT蛋白能够逆转此作用。用DNA损伤类化疗药物如依托泊苷和丝裂霉素C诱导的凋亡肿瘤细胞不能有效诱导肿瘤免疫原性死亡。张峻岭等[20]使用米托蒽醌提高黑色素瘤B16细胞膜上CRT的表达,且提高黑色素瘤组织中DCs和T细胞数量,从而抑制黑色素瘤生长。
蒽环类化疗药物阿霉素诱导小鼠MEL细胞发生免疫原性死亡,为临床白血病化疗方案的选择提供了新的理论依据和策略。可以把传统化疗与免疫生物治疗更有机地结合在一起;为微小残留白血病的治疗提供了新的思路。这些都将有待于对其主要机制CRT的进一步研究,CRT有望成为一个新的化疗预后评估指标。本次实验初步探索了蒽环类化疗药物是否可以诱导恶性血液系统肿瘤细胞发生免疫原性死亡,了解到经过4 mg/L ADM处理24 h后的MEL细胞可能发生免疫原性死亡,从而诱导KM小鼠产生抗MEL细胞免疫应答,降低活性MEL细胞在KM小鼠体内的成瘤性,降低体内瘤负荷水平。
[1]曹 旭,褚晓凡.细胞胀亡的研究进展[J].中国病理生理杂志,2009,25(12):2473 - 2477.
[2]张峻岭,李卫泊,李冬斌,等.肿瘤细胞免疫原性死亡中特征性表达抗原在抗瘤免疫应答中的作用[J].免疫学杂志,2010,26(8):730-734.
[3]Zitvogel L,Apetoh L,Ghiringhelli F,et al.The anticancer immune response:indispensable for therapeutic success?[J].J Clin Invest,2008,118(6):1991 -2001.
[4]Neninger E,Verdecia BG,Crombet T,et al.Combining an EGF-based cancer vaccine with chemotherapy in advanced nonsmall cell lung cancer[J].J Immunother,2009,32(1):92-99.
[5]Kepp O,Tesniere A,Schlemmer F,et al.Immunogenic cell death modalities and their impact on cancer treatment[J].Apoptosis,2009,14(4):364-375.
[6]Calderwood SK,Mambula SS,Gray PJ Jr,et al.Extracellular heat shock proteins in cell signaling[J].FEBS Lett,2007,581(19):3689-3694.
[7]Dumitriu IE,Bianchi ME,Bacci M,et al.The secretion of HMGB1 is required for the migration of maturing dendritic cells[J].J Leukoc Biol,2007,81(1):84 -91.
[8]Obeid M,Panaretakis T,Joza N,et al.Calreticulin exposure is required for the immunogenicity of gamma-irradiation and UVC light- induced apoptosis[J].Cell Death Differ,2007,14(10):1848 -1850.
[9]Kepp O,Tesniere A,Zitvogel L,et al.The immunogenicity of tumor cell death[J].Curr Opin Oncol,2009,21(1):71-76.
[10]Brusa D,Garetto S,Chiorino G,et al.Post- apoptotic tumors are more palatable to dendritic cells and enhance their antigen cross - presentation activity[J].Vaccine,2008,26(50):6422-6432.
[11]Obeid M,Tesniere A,Panaretakis T,et al.Ecto-calreticulin in immunogenic chemotherapy[J].Immunol Rev,2007,220(1):22-34.
[12]Obeid M,Tesniere A,Ghiringhelli F,et al.Calreticulin exposure dictates the immunogenicity of cancer cell death[J].Nat Med,2007,13(1):54-61.
[13]陈 森.红白血病诊治及预后的进展[J].国外医学:输血及血液学分册,2002,25(4):315-318.
[14]曾 蓉,陈 燕.急性红白血病的生物学特征与临床疗效研究[J].中国实验血液学杂志,2007,15(3):466-469.
[15]Friend C.Cell-free transmission in adult Swiss mice of a disease having the character of a leukemia[J].J Exp Med,1957,105(4):307-318.
[16]Singer D,Cooper M,Maniatis GM,et al.Erythropoietic differentiation in colonies of cells transformed by Friend virus[J].Proc Natl Acad Sci USA,1974,71(7):2668 -2670.
[17]Rovera G,Bonaiuto J.The phenotypes of variant clones of Friend mouse erythroleukemic cells resistant to dimethyl sulfoxide[J].Cancer Res,1976,36(11 Pt 1):4057 -4061.
[18]Friend C,Scher W,Holland JG,et al.Hemoglobin synthesis in murine virus-induced leukemic cells in vitro:stimulation of erythroid differentiation by dimethyl sulfoxide[J].Proc Natl Acad Sci USA,1971,68(2):378-382.
[19]Obeid M,Panaretakis T,Tesniere A,et al.Leveraging the immune system during chemotherapy:moving calreticulin to the cell surface converts apoptotic death from“silent”to immunogenic[J].Cancer Res,2007,67(17):7941-7944.
[20]张峻岭,李卫泊,谢绍建,等,米托蒽醌通过诱导钙网蛋白的表达抑制黑素瘤的生长[J].中国肿瘤生物治疗杂志,2010,17(1):19-24.

