cPKCγ-HSP60信号通路参与小鼠脑低氧预适应*
蒋淑君, 张 楠, 李俊发
(1滨州医学院生理学教研室,山东烟台264003;2首都医科大学神经生物学系,北京100069)
脑中风等缺血性脑血管疾病已经和冠心病、恶性肿瘤等一并列为当今世界上严重威胁人类健康的三大杀手,尤其在我国,急性脑血管疾病的发病率及死亡率明显高于冠心病。据统计,2007年我国有600万人罹患中风,其中45%为脑缺血所致[1]。脑低氧预适应(hypoxic preconditioning,HPC)是一种内源性保护机制,即短暂、亚致死性的重复性低氧刺激可引起组织或器官对继发严重缺氧/缺血的耐受。其形成机制的研究,尤其是对参与HPC形成的细胞信号转导通路的研究,可为临床治疗脑缺血/低氧损伤开辟新思路。我们以往研究发现,常规型蛋白激酶Cγ(conventional protein kinase,Cγ,cPKCγ)的激活参与了脑HPC的发生发展过程[2]。同时我们也发现,HPC可能通过增加大脑中动脉阻塞(middle cerebral artery occlusion,MCAO)小鼠皮层组织内cPKCγ等的膜转位水平,对缺血损伤起抑制作用[3]。然而究竟哪些蛋白可能与cPKCγ相互作用并参与该过程,至今仍不清楚。本研究拟利用小鼠整体HPC模型及蛋白质组学技术进一步鉴定HPC小鼠脑皮层组织内与cPKCγ相互作用的蛋白,并探讨与cPKCγ相互作用的热休克蛋白60(heat-shock protein 60,HSP60)表达水平在HPC及脑缺血过程中的变化。
材料和方法
1 材料
免疫沉淀试剂盒(Sigma-Aldrich),蛋白酶抑制剂(亮肽酶素、抑肽酶、胃酶抑素A、糜蛋白酶抑制素)、磷酸酶抑制剂(KF、冈田酸、Na2P2O7、原矾酸钠)、脂氧胆酸钠、DTT、NP -40、EDTA、EGTA 等试剂(Sigma Aldrich);兔源性cPKCγ多克隆抗体(Santa Cruz),兔源性热休克蛋白(HSP)60抗体(Cell Signalling Technology),辣根过氧化物酶标记的山羊抗兔抗体、山羊抗小鼠抗体和ECL反应底物(Chemicon);Gel Doc凝胶成像分析系统(Bio-Rad);BCA蛋白定量试剂盒(Pierce);11cm IPG预制干胶条(pH 3-10,线性,GE Healthcare);银染试剂盒(Amersham);Kodak BioMaxMR X-光胶片(Kodak)。
2 方法
2.1 动物及模型制备 健康BALB/c小鼠(雄性,体质量18-22 g,8-10周,SPF级,医学实验动物质量合格证书,许可证编号SCXK-(军)2009-004,首都医科大学动物部。按文献方法[4],首先制备常氧(normoxia,Norm)和HPC组小鼠。低氧暴露结束后,室温恢复1 h,再进行MCAO缺血(ischemia,I)模型制备[5],实验动物分为Norm组、HPC组、常氧假手术组(Norm+sham)、常氧缺血组(Norm+I)、HPC假手术组(HPC+sham)和HPC缺血组(HPC+I),每组 n=6。
2.2 胞浆和膜相关蛋白的提取 参照文献[6]进行,将冻存Norm组和HPC组小鼠皮层组织按10 mL/g的比例加入裂解液A[mmol/L:Tris-HCl 50(pH 7.5),EGTA 2,EDTA 2,DTT 2,Na4P2O75,KF 50,冈田酸5×10-5,高肽酶素、抑肽酶、胃酶抑素 A、糜蛋白酶抑制素各 5 mg/L],匀浆、超声破碎,4℃、30 000×g离心30 min,取上清液作为胞浆成分(cytosolic)保存;沉淀物再加入相同体积的裂解液B(匀浆液A+0.5%NP-40),并进一步超声破碎,在4℃、30 000×g离心30 min,取上清液作为膜相关蛋白成分(particulate)。
2.3 免疫沉淀 取相应的蛋白质组分1 mg,加入2 μgⅠ抗,室温下置于摇床数小时,再加入protein GSepharose 4℃过夜。12 000×g离心1 min,弃去上清,沉淀用缓冲液洗数次,最后加入thiourea buffer(用于双向电泳)处理沉淀5 min,离心弃去沉淀,所得上清即为免疫沉淀产物。
2.4 双向电泳、银染及凝胶图像分析 第一向等电聚焦电泳(isoelectric focusing,IEF)采用固相化11cm IPG预制干胶条(pH 3-10,线性),再水化同时上样。聚焦程序如下:30 V 12 h,step;200 V 1 h,step;500 V 1 h,step;1 000 V 1 h,step;8 000 V 1 h,gradient;8 000 V 3 h,step。IEF后IPG胶条从电泳槽中取出,分别在平衡液A和平衡液B中平衡15 min后转入预先灌制好的SDS-PAGE胶上进行第二向电泳,每面胶电流为15 mA,待溴酚蓝前沿至阳极约5 mm时停止电泳。固定电泳后的凝胶,按敏化、银染、显色和终止步骤依次进行凝胶的银染显色。应用Image Master 2D Platinum软件对凝胶进行分析。
2.5 胶内酶切和质谱鉴定 按文献[7]进行蛋白点的胶内酶解及 MALDI-TOF-MS(prOTOF 2000,PerkinElmer)检测,获得数据应用NCBInr和Swissprot数据库进行蛋白鉴定。
2.6 蛋白样品制备、SDS-PAGE和Western blotting参照文献[8],抽提 Norm+sham 组 、Norm+I组、HPC+sham组和HPC+I组皮层缺血核心区、半影区和对侧皮层组织的全细胞蛋白组分,BCA法蛋白定量,-20℃保存备用。分别取50 μg各组蛋白样品进行蛋白电泳(10%SDS PAGE,4℃,20-30 mA)和转膜(PVDF膜,400 mA,3 h)。用cPKCγ抗体、HSP 60抗体和β-actin(内参照)抗体进行杂交。所得结果用Gel Doc凝胶成像系统扫描后分析。
3 统计学处理
实验数据处理和检验应用Quantity One分析软件进行半定量分析,并以均数±标准差(±s)表示。应用SPSS软件,首先进行单因素方差分析(One-way ANOVA),然后进行Bonferroni检验。
结 果
1 HPC小鼠脑皮层膜相关成分中与cPKCγ相互作用差异表达蛋白HSP60的鉴定
采用相同上样量的Norm组和HPC组小鼠皮层与cPKCγ相互作用蛋白进行双向电泳,获得了较满意的电泳图谱,见图1。应用双向电泳图谱专业分析软件Image Master 2D Platinum对Norm组和HPC组小鼠皮层蛋白双向电泳图谱进行了比较分析,结合质谱鉴定我们发现,与常氧组比较,HPC小鼠脑皮层膜相关成分中,与cPKCγ相互作用的HSP60在膜相关成分中升高了(1.34 ±0.19)倍,n=3,见图2。

Figure 1.Representative 2D mapping of cPKCγ-interacted proteins in particulate fraction of cortex in normoxic(Norm)and hypoxic preconditioning(HPC)mice.Differentially expressed proteins were highlighted by arrows in silver- stained 2D PAGE gels.In particular,from 1 to 15,they were transitional endoplasmic reticulum ATPase,aconitate hydratase,heat- shock protein 70,heat-shock protein 60,synapsin,pyruvate kinase,ATP synthase,creatine kinase,phosphoglycerate kinase,purinerich element-binding protein A,fructose-bisphosphate aldolase A,guanine nucleotide-binding protein,14-3-3 protein gamma and ubiquitin carboxyl- terminal hydrolase L1,respectively.图1 小鼠脑组织膜相关成分中与cPKCγ相互作用蛋白的典型双向电泳图

Figure 2. Protein expression of cPKCγ - interacted HSP60.Magnified pictures of 2-DE images showed an increase in HSP60 protein expression level in particulate fraction of cerebral cortex of HPC mice.图2 与cPKC γ相互作用的HSP60蛋白表达
2 免疫共沉淀验证差异表达的HSP60与cPKCγ相互作用情况
利用免疫沉淀发现,cPKCγ在膜相关蛋白成分中与HSP60存在相互作用。同时,在膜相关蛋白成分中利用HSP60的抗体也能沉淀出cPKCγ,见图3。
3 低氧预适应对MCAO小鼠皮层组织HSP60表达量的影响
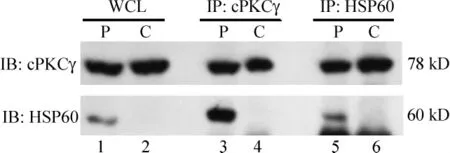
Figure 3.The interaction between HSP60 and cPKCγ.cPKCγ was immunoprecipitated with HSP60 antibody in particulate and cytosolic fraction in HPC mice.WCL:whole-cell lysate;P:particulate;C:cytosolic.图3 HSP60和cPKCγ的免疫共沉淀结果
在MCAO诱导的缺血模型中,与Norm+sham组小鼠相比,Norm+I组及HPC+I组小鼠皮层缺血核心区HSP60表达水平明显升高(P<0.05,n=6);与Norm+sham组小鼠相比,Norm+I组及HPC+I组小鼠皮层半影区HSP60表达水平升高(P<0.05,n=6)。HPC+I组小鼠皮层缺血核心区HSP60表达水平低于Norm+I组(P <0.05,n=6),而 HPC+I组小鼠皮层半影区与Norm+I组小鼠皮层半影区相比,HSP60表达水平有降低,但差异无显著,见图4。

Figure 4.Protein expression levels of HSP60 in ischemic cortex of MCAO mice.A:Western blotting results;B:quantitative analysis.S:sham;Ic:ischemic core;P:penumbra;C:contralateral area of occluded hemisphere.±s.n=6.*P<0.05 vs sham group;#P<0.05 vs Ic in Norm+I group.图4 脑缺血/预适应小鼠皮层组织HSP60蛋白表达
讨 论
HPC是机体的一种内源性保护机制,即亚致死性低氧刺激可激发组织器官产生对继发严重缺血/低氧性损伤的耐受。目前为止,人们已利用多种脑缺血模型证实了其保护作用。然而,HPC脑保护作用的确切机制仍不清楚。很多研究表明,腺苷及其受体和低氧诱导因子(hypoxia-inducible factor,HIF)等均参与了HPC的脑保护作用,并且在这些机制中均有PKC家族的参与。cPKCγ是PKC家族中最特殊和重要的亚型之一,其在组织中的分布局限于中枢神经系统,对于突触的形成以及可塑性的调节都具有极其重要的作用。许多研究表明,cPKCγ在脑I/HPC方面同样发挥重要作用。PKCs激活后可以发生移位,即从胞浆转移到胞膜、细胞骨架结构或细胞核内,称为膜转位。我们在小鼠整体HPC模型中也发现了cPKCγ的膜转位激活[6],cPKCγ的激活可能参与了HPC减轻小鼠大脑中动脉阻塞所致脑缺血性损伤[3]。为了进一步揭示参与 HPC的cPKCγ信号网络,本研究利用蛋白质组学技术及整体HPC小鼠模型,发现低氧预适应可致小鼠皮层组织膜相关成分中与cPKCγ相互作用的多种蛋白的表达量发生明显变化,如HSP60、ATP synthase、creatine kinase、phosphoglycerate kinase 、14 -3 - 3 protein gamma、HSP70等,提示这些蛋白可能均参与了cPKCγ介导的脑低氧预适应形成。在新生心肌细胞PKC参与HSP介导的应激损伤保护作用[9],在缺血预适应的肝脏,HSP表达受依赖PKC的P44/42信号通路调节[10]。我们通过双向电泳和质谱分析鉴定及免疫共沉淀证实,低氧预适应时在小鼠皮层膜相关成分中cPKCγ与HSP60存在相互作用。
HSP60家族属于热应激蛋白,热应激蛋白存在于所有的原核与真核生物中,在细胞内起“分子伴侣”的作用,可协助多肽或蛋白质的正确转位、折叠和装配,具有维持蛋白稳定、促进细胞生存等功能,在细胞生长、发育、分化、基因转录等方面发挥重要作用[11]。正常状态下HSP60主要以稳定状态存在于线粒体基质中,胞质内含量较少,在机体处于应激状态时可过表达或异位表达。因此,HSP60也被认为是反映线粒体应激和损伤程度的指标。近来的研究表明,低氧/缺血损伤可致新生大鼠脑皮质缺血区周围组织内HSP60蛋白量增高[12]。脑缺血损伤可使神经元内未折叠蛋白毒性堆积并导致神经细胞死亡,脑缺血所致的未折叠蛋白毒性堆积及线粒体应激可能引起HSP60 mRNA和蛋白表达水平增加[13]。本研究结果显示,在MCAO诱导的缺血模型中,小鼠皮层缺血核心区及半影区HSP60表达水平较假手术组均明显升高,而低氧预适应后缺血核心区HSP60表达水平降低,提示神经细胞在缺血/低氧状态下未折叠蛋白毒性堆积及线粒体应激致HSP60表达增高,低氧预适应可能通过调节HSP60蛋白表达,起到一定的脑保护作用。
本研究借助蛋白质组学与整体HPC小鼠模型证实,cPKCγ可能通过HSP60参与脑低氧预适应的形成。进一步通过HPC结合MCAO小鼠模型发现,在脑缺血缺氧损伤时HSP60蛋白表达水平明显升高,低氧预适应后HSP60蛋白表达有所降低。以上结果揭示cPKCγ-HSP60信号通路参与脑低氧预适应过程,cPKCγ可能通过调节与其相互作用蛋白HSP60在低氧/缺血损伤和预适应中发挥着重要作用。然而,其相互作用机制及在脑缺血/低氧损伤中如何发挥作用等均有待进一步研究。
[1]Liu M,Wu B,Wang WZ,et al.Stroke in China:epidemiology,prevention,and management strategies[J].Lancet Neurol,2007,6(5):456 - 464.
[2]Niu C,Li J,Cui X,et al.Changes in cPKC isoform -specific membrane translocation and protein expression in the brain of hypoxic preconditioned mice[J].Neurosci Lett,2005,384(1-2):1 - 6.
[3]杨巍巍,江 君,卜祥宁,等.蛋白激酶CβⅡ和γ参与低氧预适应降低脑中动脉阻塞所致鼠脑缺血性损伤[J].基础医学与临床2009,29(2):129 -134.
[4]Li J,Niu C,Han S,et al.Identification of protein kinase C isoforms involved in cerebral hypoxic preconditioning of mice[J].Brain Res,2005,1060(1-2):62 -72.
[5]蒋淑君,张 楠,卜祥宁,等.P38MAPK磷酸化增高参与HPC降低MCAO所致小鼠缺血性脑损伤[J].基础医学与临床,2009,29(7):691 -696.
[6]张 楠,韩 松,李俊发.低氧预适应鼠脑海马组织内与cPKCγ相互作用的 ERK1/2磷酸化水平降低[J].基础医学与临床,2008,28(3):209 -212.
[7]Zhou Y,Bhatia I,Cai Z,et al.Proteomic analysis of neonatal mouse brain:evidence for hypoxia and ischemia induced dephosphorylation of collapsin response mediator proteins[J].J Proteome Res,2008,7(6):2507 - 2515.
[8]Wexler EJ,Peters EE,Gonzales A,et al.An objective procedure for ischemic area evaluation of the stroke intraluminal thread model in the mouse and rat[J].J Neurosci Methods,2002,113(1):51 - 58.
[9]Coaxum SD,Martin JL,Mestril R.Overexpression of heat shock proteins differentially modulates protein kinase C expression in rat neonatal cardiomyocytes[J].Cell Stress Chaperones,2003,8(4):297 -302.
[10]Gao Y,Shan YQ,Pan MX,et al.PKC -dependent activation of P44/42 MAPKs and HSP70 during hepatocyte ischemic preconditioning [J]. World J Gastroenterol,2004,10(7):1019 - 1027.
[11]龚兴国,于 红.热休克蛋白60研究进展[J].中国病理生理杂志,2004,20(11):2151 -2154.
[12]Wei Y,Signore AP,Iwai M,et al.Rapidly increased neuronal mitochondrial biogenesis after hypoxic-ischemic brain injury[J].Stroke,2008,39(11):3057 - 3063.
[13]Sung JH,Cho EH,Min W,et al.Identification of proteins regulated by estradiol in focal cerebral ischemic injury-a proteomics approach[J].Neurosci Lett,2010,477(2):66 -71.

