缺氧后处理中CYP2J3/EETs系统对心肌凋亡的影响*
赵艳芝, 张冬梅, 于刚刚, 曾翔俊, 王红霞, 芦玲巧, 张立克, 王岩梅△
(1首都医科大学燕京医学院生理与病理生理教研室,北京101300;2首都医科大学基础医学院病理生理教研室,北京100069)
随着抗缺血/再灌注损伤(ischemic/reperfusion,I/R)心肌自身保护研究的不断深入,近年来提出了缺血后处理(ischemic postconditioning,IPo)的概念[1]。大量研究证实缺血后处理具有缩小心肌梗死范围[2]、减轻内皮功能损伤、抗再灌注心律失常、改善心肌代谢及收缩和舒张功能、减轻超微结构的破坏等心肌保护作用[3],减轻细胞凋亡[4]。缺血后处理对心脏再灌注的干预发生在缺血后,比缺血预处理(ischemic preconditioning,IPc)有明显的临床应用优势,故后处理越来越受到医学界的广泛关注。但后处理通过怎样的机制减轻缺血/再灌注损伤?通过哪种细胞信号转导方式发挥保护作用?尚不明了。通过在体及离体实验我室前期工作已证明缺血后处理与细胞色素P450表氧化酶2J3/环氧二十碳三烯酸系统(cytochrome P450 2J3/epoxyeicosatrienoic acids,CYP2J3/EETs)上调密切相关[2,5]。鉴于 11,12 -EET具有抑制内皮细胞凋亡作用[6],IPo是否通过上调CYP2J3/EETs系统,进而抑制心肌细胞凋亡而保护心肌?值得探讨。本工作通过观察干预内源性CYP2J3/EETs系统对缺氧后处理(hypoxia postconditioning,HPost)心肌细胞凋亡蛋白的影响,了解缺氧后处理上调CYP2J3/EETs系统后发挥心脏保护的可能作用途径。
材料和方法
1 材料
1.1 主要试剂 胰蛋白酶(Hyclone)、胶原酶Ⅰ、Ⅱ(Sigma)、丝裂霉素 C(Roche)、DMEM(Hyclone);环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)纯品及空白对照(Sigma)、无水乙腈(Fisher Scientifid)、甲酸(Sigma-Aldrich Chemic GmbH,Riedstr)、N,N -diisopropylethy lamine(Sigam)、固相提取柱(Waster Corporation);caspase-3活性检测试剂盒(Roche)、Bradford蛋白浓度测定试剂盒(碧云天试剂公司)、caspase-3抗体(Santa Cruz)、Western blotting发光试剂盒(Pierce);DMSO(Sigma);细胞色素P450表氧化酶抑制剂6-(2-炔丙基氧苯基)己酸[6-(2-propargyloxyphenyl)hexanoic acid,PPOH](Sigma);pcDNA3.12-CYP2J3质粒由本实验室构建。
1.2 主要仪器 超速低温离心机(Sigma)、细胞培养箱(Revco)、酶标仪(Labsystems)、低温冰箱(Sanyo)。
1.3 动物 Wistar乳鼠(12-24 h)由首都医科大学动物部提供。
2 方法
2.1 心肌细胞原代培养及缺氧/复氧(H/R)模型复制 取Wistar乳鼠(12-24 h)心脏做原代心肌细胞培养[7]。碘酒及乙醇消毒乳鼠胸腹部,开胸取其心脏的心室部分放入含PBS的烧杯内冲洗2次,洗净血液后剪碎心脏成1 mm×1 mm ×1 mm,各加5 mL 1.25 g/L胰酶、1 g/L胶原酶Ⅰ、0.5 g/L胶原酶Ⅱ,37℃水浴消化(加转子)4 min,首次消化液去掉,后5次消化液收集,按1∶1混合20%小牛血清的DMEM完全培养基(含青-链霉素100 mg/L)终止消化。用80目筛网过滤1次,配平后1 000 r/min离心10 min弃去上清,加完全培养基至24 mL,吹打均匀,放入1个培养瓶中,加入丝裂霉素C(2 kg/L)抑制成纤维细胞增殖,20 min、37℃培养,差速贴壁去掉成纤维细胞。免疫组化方法α-action染色鉴定心肌细胞。
将细胞放入自制的缺氧罐内,通入混合气体(O22%,CO25%,N293%)3 h后再将细胞取出,放入37℃、5%CO2培养箱中复氧2 h。
2.2 实验分组 (1)对照组(control):细胞用含20%小牛血清的DMEM培养基培养72 h,不经任何处理,继续培养5 h;(2)缺氧/复氧组(H/R):按上述方法进行缺氧复氧处理;(3)缺氧后处理组(HPost):心肌细胞缺氧3 h后,采用缺氧罐内5 min、复氧5 min重复3次的方法进行后处理,再继续复氧85 min;(4)空质粒组:按照 2 μg pcDNA3.12 质粒/1×105个细胞进行脂质体转染,转染24 h后处理同HPost组;(5)CYP2J3 转染组:按照 2 μg pcDNA3.12-CYP2J3质粒/1×105个细胞进行脂质体转染,转染24 h后处理同HPost组;(6)DMSO溶剂组:按照3 μL DMSO/L培养液进行抑制,加入DMSO 24 h后处理同HPost组;(7)PPOH组:按照3μL PPOH/L培养液进行抑制,24 h后处理同HPost组。
3 观察指标
3.1 MTT法检测细胞活力[8]取96孔培养板中各组细胞,每孔加入20 μL MTT溶液(5 g/L)继续培养4 h,终止培养,小心弃去培养液,每孔加DMSO 150 μL,微量振荡器上震摇10 min,使结晶物充分溶解,酶标仪490 nm下测定各孔吸光度值(A)。
3.2 高效液相色谱法(high-performance liquid chromatography,HPLC)检测心肌细胞培养液中11,12-EET浓度[9]对心肌组织进行处理和衍生后上机检测样品,流动相:A相0.5%甲酸水溶液,B相0.5%甲酸乙腈溶液,流速1 mL/min,层析条件:前40 min B相浓度由50%增至65%,其后80 min B相浓度由65%增至100%,最后以B相100%维持20 min。
3.3 心肌细胞caspase-3蛋白含量 提取细胞蛋白,按BCA蛋白定量试剂盒说明书定量蛋白,采用Western blotting方法测定各组细胞caspase-3蛋白表达变化。
3.4 心肌细胞caspase-3蛋白活性测定 提取心肌细胞蛋白,按Bradford蛋白浓度测定试剂盒(碧云天试剂公司)说明书定量蛋白,采用caspase-3蛋白活性检测试剂盒按照说明书测定caspase-3蛋白活性。
4 统计学处理
结 果
1 原代心肌细胞培养及鉴定
原代培养的乳鼠心肌细胞在光镜下呈棱型或多角形伸展,中间较厚,逐渐形成细胞簇或细胞单层,可自然搏动,频率约为50次/min;用抗肌动蛋白αactin的单克隆抗体鉴定心肌细胞呈阳性,阳性率达95%,胞浆呈淡棕色,清晰可见心肌细胞肌丝结构,见图 1、2。
2 MTT法检测细胞活力
H/R组心肌细胞活力明显低于control组(P<0.01),HPost组心肌细胞活力高于 H/R组(P<0.01),PPOH组心肌细胞活力明显低于 HPost组(P<0.01),CYP2J3组心肌细胞活力明显高于HPost组(P<0.01)。PPOH组与DMSO组之间差异显著(P<0.05),CYP2J3组与空质粒组之间也有显著差异(P <0.01),见图3。

Figure 1.Cultured neonatal rat cardiac myocytes(×200).图1 培养的乳鼠心肌细胞

Figure 2.Identification of cultured neonatal rat cardiac myocytes with immunohistochemical staining using antibody to α-actin(×200).图2 乳鼠心肌细胞鉴定
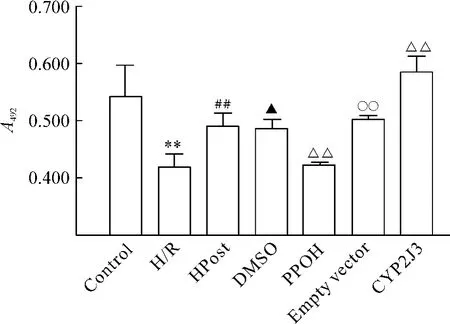
Figure 3.The effects of CYP2J3/EETs system on livability of cardiac myocytes.Control:without any treatment;H/R:3 h hypoxia+2 h reoxygenation;HPost:3 h hypoxia+3 cycles of hypoxia(5 min)/reoxygenation(5 min);DMSO:after 24 h of DMSO treatment+HPost as above;PPOH:after 24 h of PPOH treatment+HPost as above;empty vector:transfected with empty vector 24 h later+HPost as above;CYP2J3:transfected with CYP2J3 vector 24 h later+HPost as above.±s.n=6.**P<0.01 vs control group;##P<0.01 vs H/R group;△△P <0.01 vs HPost group;▲P<0.05 vs PPOH group;○○P <0.01 vs CYP2J3 group.图3 CYP2J3/EET系统对心肌细胞活力的影响
3 大鼠心肌细胞培养液中11,12-EET浓度的变化
采用HPLC检测心肌细胞培养液中11,12-EET浓度,结果发现H/R组心肌细胞培养液中11,12-EET浓度低于对照组(P<0.01),HPost组心肌细胞培养液中11,12-EET浓度明显高于H/R组(P<0.01),PPOH抑制剂组明显低于 HPost组(P<0.01),CYP2J3转染组明显高于 HPost组(P<0.01)。PPOH组与DMSO组之间有显著差异(P<0.01),CYP2J3组与空质粒组之间也有显著差异(P<0.01),见图4。
4 心肌细胞caspase-3蛋白含量的变化
H/R组心肌细胞内caspase-3蛋白的表达比对照组高(P<0.05),HPost组心肌细胞内caspase-3蛋白的表达明显低于H/R组(P<0.01),CYP2J3转染组蛋白的表达明显低于 HPost组(P<0.01),PPOH组蛋白的表达高于 HPost组(P<0.01)。PPOH组于 DMSO组之间差异显著(P<0.01),CYP2J3组与空质粒组之间也有显著差异(P<0.05),见图 5。
5 心肌细胞caspase-3蛋白活性
H/R组心肌细胞内caspase-3蛋白活性比对照组高(P<0.01),HPost组心肌细胞内caspase-3蛋白活性明显低于H/R组(P<0.01),空质粒组活性明显高于HPost组(P<0.01),CYP2J3转染组活性明显低于空质粒组(P<0.01),PPOH组活性高于HPost组(P<0.01)。PPOH组于DMSO组之间差异显著(P <0.01),见图6。

Figure 4.The alterations of 11,12 - EET concentration in cardiomyocyte culture medium.Control:without any treatment;H/R:3 h hypoxia+2 h reoxygenation;HPost:3 h hypoxia+3 cycles of hypoxia(5 min)/reoxygenation(5 min);DMSO:after 24 h of DMSO treatment+HPost as above;PPOH:after 24 h of PPOH treatment+HPost as above;Empty vector:transfected with empty vector 24 h later+HPost as above;CYP2J3:transfected with CYP2J3 vector 24 h later+HPost as above.±s.n=6.**P<0.01 vs control group;##P <0.01 vs H/R group;△△P <0.01 vs HPost group;▲▲P <0.01 vs PPOH group;○○P <0.01 vs CYP2J3 group.图4 心肌细胞培养液中11,12-EET浓度的变化

Figure 5.The expression of caspase-3 protein in cardiomyocytes.The caspase-3 protein levels were normalized to β - actin.Control:without any treatment;H/R:3 h hypoxia+2 h reoxygenation;HPost:3 h hypoxia+3 cycles of hypoxia(5 min)/reoxygenation(5 min);DMSO:after 24 h of DMSO treatment+HPost as above;PPOH:after 24 h of PPOH treatment+HPost as above;empty vector:transfected with empty vector 24 h later+ HPost as above;with CYP2J3:transfected CYP2J3 vector 24 h later+HPost as above.±s.n=3.*P<0.05 vs control group;##P <0.01 vs H/R group;△△P <0.01 vs HPost group;▲P <0.05 vs PPOH group;○P <0.05 vs CYP2J3 group.图5 心肌细胞caspase-3蛋白表达的变化
讨 论
Zhao等[1]提出缺血后处理的概念后,研究已证实缺血后处理(IPo)有着与缺血预处理相似的心脏保护作用,包括减少心肌梗死面积[2]、减少再灌注心律失常的发生等。但是缺血后处理的保护作用机制尚不清楚。近年来,内源性保护物质在缺血后处理中的作用引起关注。我室前期工作证实,CYP2J3/EETs系统上调可能是缺血后处理独特的保护机制之一[2]。
CYP2J3作为细胞色素P450表氧化酶(cytochrome P450 epoxygenase)的一个亚型,主要存在于大鼠的肝脏和心脏中。EETs是花生四烯酸经CYP450表氧化酶代谢的产物,包括5,6 -EET、8,9 - EET、11,12 - EET、14,15 - EET[10]。近年来CYP2J3/EETs系统对心血管系统的调控作用引起关注。我室前期通过在体及离体实验证明,缺血后处理增加心脏CYP2J3表达及11,12-EET水平,可能是拮抗心脏再灌注损伤的信号转导途径之一[2、5]。IPo导致的 CYP2J3/EET 系统上调参与心肌保护的机制尚不清楚。鉴于IPo抑制心肌细胞凋亡,且EETs也可抑制细胞凋亡[6],IPo是否通过上调CYP2J3/EETs系统,进而抑制心肌细胞凋亡而保护心肌的问题值得探讨。

Figure 6.The alterations of caspase-3 activity in cardiomyocytes.Control:without any treatment;H/R:3 h hypoxia+2 h reoxygenation;HPost:3 h hypoxia+3 cycles of hypoxia(5 min)/reoxygenation(5 min);DMSO:after 24 h of DMSO treatment+HPost as above;PPOH:after 24 h of PPOH treatment+HPost as above;empty vector:transfected with empty vector 24 h later+HPost as above;CYP2J3:transfected with CYP2J3 vector 24 h later+HPost as above.±s.n=6.*P<0.05 vs control group;##P<0.01 vs H/R group;△△P <0.01 vs HPost group;▲▲P <0.01 vs empty vector group;○○P < 0.01 vs PPOH group.图6 心肌细胞内caspase-3蛋白活性的变化
PPOH是细胞色素P450表氧化酶的特异抑制剂[11],因为它含有的苯环基团可以和表氧化酶紧密结合,除了这个苯环以外PPOH化学结构含有末端乙炔基团,正是这个基团可以导致表氧化酶自杀式的抑制[12],实验证明PPOH末端的乙炔基团不仅可以使细胞色素P450表氧化酶血红素基团烷化,也可以使表氧化酶的表达下降[11]。这些特点使PPOH能抑制CYP2J的表达及活性,成为CYP2J的特异抑制剂。心肌中CYP450亚型主要是2J2(CYP2J2,人心脏为主)和2J3(CYP2J3,大鼠心脏为主)。所以本实验选择PPOH作为CYP2J3的抑制剂来干预CYP2J3/EET系统。
本实验观察到H/R组心肌细胞存活率低于对照组(P<0.01),提示缺氧/复氧可导致心肌细胞损伤,HPost组心肌细胞存活率低于缺氧/复氧组(P<0.01),提示HPost组可以拮抗缺氧/复氧损伤,而对缺血心肌起保护作用,与他人实验结果一致[1,2,5]。我们对其机制进行研究,发现 H/R 组心肌细胞培养液中11,12-EET浓度比CON组下降(P<0.01),而缺氧后处理组11,12-EET浓度高于缺氧/复氧组(P<0.01),在细胞水平上证明缺氧后处理有可能通过内源性11,12-EET的上调而对心肌有保护作用,这与本室在体及离体实验结果一致[2,5]。进而我们对心肌细胞进行 CYP2J3外源基因转染,结果提示基因转染组细胞存活率高于HPost组(P<0.01),同时11,12 - EET浓度也高于HPost组(P<0.01),提示转染的 CYP2J3基因进行表达,通过分解花生四烯酸,使11,12-EET浓度增加,从而保护心肌细胞。综上所述提示缺氧后处理有可能是通过提高内源性CYP2J3的表达,进而分解花生四烯酸,提高11,12-EET浓度,从而对心肌起保护作用。
在PPOH抑制剂组心肌细胞存活率和11,12-EET浓度相比缺氧后处理组明显降低(P<0.01),提示心肌细胞内源性CYP2J3被抑制后,导致11,12-EET浓度下降,减弱了EET对心肌的保护作用。从反面进一步证明了缺血后处理组有可能是通过提高内源性CYP2J3的表达,进而提高11,12-EET浓度而对心肌起保护作用。
研究认为,心肌细胞凋亡是多种因素引起的心肌细胞死亡的主要机制[13]。Caspases蛋白的激活是心肌细胞凋亡的一个关键现象[14]。其中caspase-3是细胞凋亡蛋白酶级联反应的必经之路,是哺乳动物细胞凋亡中的关键蛋白酶,也是细胞凋亡的主要效应因子和最重要的执行者[15-17]。心肌缺血/再灌注促进凋亡蛋白caspase-3激活,导致的心肌细胞凋亡可能是缺血/再灌损伤的早期病理改变[18,19]。鉴于 IPo 抑制心肌细胞凋亡[1],且 EETs也可抑制细胞凋亡[6],IPo是否通过上调CYP2J3/EETs系统,进而抑制心肌细胞凋亡而保护缺血/再灌心肌?本实验中H/R组caspase-3蛋白表达(P<0.05)及活性(P<0.01)均高于对照组,细胞存活率低于对照组(P<0.01),表明缺氧/复氧损伤可导致细胞凋亡,与其它实验室的实验结果一致[20]。HPost组 caspase-3蛋白表达及活性均低于H/R组(P<0.01),提示缺氧后处理可以拮抗缺氧/复氧损伤导致的caspase-3蛋白表达增加而抑制细胞凋亡。CYP2J3转染组caspase-3蛋白表达及活性均低于H/R组(P<0.01),且转染CYP2J3组心肌细胞存活率也高于H/R组(P<0.01),表明CYP2J3高表达可能通过降低caspase-3蛋白表达、降低caspase-3蛋白活性来抑制细胞凋亡,从而对心肌细胞起保护作用。PPOH抑制剂组caspase-3蛋白表达及活性均高于HPost(P<0.01),从反向进一步证明了心肌细胞内源性CYP2J3被抑制后,减弱了 CYP2J3/EET系统对caspase-3蛋白表达及活性的抑制,促进了心肌细胞的凋亡。
综上所述,缺氧后处理有可能通过上调CYP2J3/EETs系统,来降低caspase-3蛋白的表达及其活性从而抑制心肌细胞凋亡,达到心肌细胞保护作用。鉴于细胞凋亡分线粒体途径和死亡受体途径2条途径,IPo导致的CYP2J3/EET系统上调究竟通过哪条途径来抑制细胞凋亡从而发挥心肌保护作用,值得进一步探讨。
[1]Zhao ZQ,Corvera JS,Halkos ME,et al.Inhibition of myocardial injury by ischemic postconditioning during reperfusion:comparison with ischemic preconditioning[J].Am J Physiol Heart Circ Physiol,2003,285(2):H579-H588.
[2]于刚刚,芦玲巧,曾翔俊,等.缺血后处理对在体大鼠缺血-再灌注心肌细胞色素P450表氧化酶2J3/环氧二十碳三烯酸系统的影响[J].中国微循环,2009,13(4):231-235.
[3]Hausenloy DJ,Yellon DM.New directions for protecting the heart against ischemia-reperfusion injury:targeting the reperfusion injury salvage kinase(RISK)-pathway[J].Cardiovasc Res,2004,61(3):448 - 460.
[4]张国明,王 禹,李天德,等.应激激活化蛋白激酶在大鼠缺血后适应中的变化及其对细胞凋亡影响的研究[J].浙江大学学报(医学版),2009,38(6):611 -619.
[5]马立权,王红霞,油红捷,等.缺血后处置缓解离体大鼠心肌缺血/再灌注损伤[J].基础医学与临床,2007,27(3):259-262.
[6]Dhanasekaran A,Gruenloh SK,Buonaccorsi JN,et al.Multiple antiapoptotic targets of the PI3K/Akt survival pathway are activated by epoxyeicosatrienoic acids to protect cardiomyocytes from hypoxia/anoxia[J].Am J Physiol Heart Circ Physiol,2008,294(2):H724 -H735.
[7]郭 军,鲍翠玉,林国生,等.新生大鼠心肌细胞培养方法的改进[J].血管康复医学杂志,2006,15(6):538-540.
[8]Mosmann T.Rapid colorimetric assay for cellular growth and survival:application to proliferation and cytotoxicity assays[J].J Immunol Method,1983,65(1 -2):55 -63.
[9]Yue H,Strauss KI,Borenstein MR,et al.Determination of bioactive eicosanoids in brain tissue by a sensitive reversed phase liquid chromatographic method with fluorescence detection[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,803(2):267 -277.
[10]Wu S,Chen W,Murphy E,et al.Molecular cloning,expression,and functional significance of a cytochrome P450 highly expressed in rat heart myocytes[J].J Biol Chem,1997,272(19):12551 -12559.
[11]Zhou Y,Chang HH,Du J,et al.Renal epoxyeicosatrienoic acid synthesis during pregnancy[J].Am J Physiol Renal Physiol,2005,288(1):F221 - F226.
[12]Ortiz de Montellano PR,Reich NO.Specific inactivation of hepatic fatty acid hydroxylases by acetylenic fatty acids[J].J Biol Chem,1984,259(7):4136 -4141.
[13]Kim KS,Yoon ST,Li J,et al.Disc degeneration in the rabbit:a biochemical and radiological comparison between four disc injury models[J].Spine,2005,30(1):33 -37.
[14]Sakai D,Mocbida J,Yamamoto Y,et al.Transplantation of mesenchymal stem cells embedded in Atelocollagen gel to the intervertebral disc:a potential therapeutic model for disc degeneration [J].Biomaterials,2003,24(20):3531- 3541.
[15]Haunstetter A,Izumo S.Toward antiapoptosis as a new treatment modality[J].Circ Res,2000,86(4):371-376.
[16]贾明旺,黄文杰.Caspase-3基因沉默对肺炎链球菌感染的肺泡上皮细胞凋亡的影响[J].中国病理生理杂志,2010,26(1):132 -136.
[17]曹长姝,沈伟哉,李药兰,等.臭灵丹中黄酮类化合物对人喉癌细胞Hep-2凋亡的影响及机制[J].中国病理生理杂志,2010,26(7):1362 -1365.
[18]He A,Wang JA,Gui C,et al.Changes of mitochondrial pathway in hypoxia/reoxygenation induced cardiomyocytes apoptosis[J].Folia Histochem Cytobiol,2007,45(4):397-400.
[19]Thuerauf DJ,Marcinko M,Gude N,et al.Activation of the unfolded protein response in infarcted mouse heart and hypoxic cultured cardiac myocytes[J].Circ Res,2006,99(3):275-282.
[20]林 萍,任卫东,刘长宏,等.犬急性缺血再灌注左室局部功能与心肌细胞凋亡[J].中华高血压杂志,2006,14(9):739-742.

