转染GML基因提高肺癌A549细胞对顺铂杀伤的敏感性
隋东江,李伟生,王蓉美,陈燕侠,王肇源,李凤芝,李洪霞
(1.空军总医院干部病房东楼3区,北京 100142;2.吉林大学中日联谊医院中心研究室,吉林 长春 130033)
转染GML基因提高肺癌A549细胞对顺铂杀伤的敏感性
隋东江1,李伟生1,王蓉美1,陈燕侠1,王肇源1,李凤芝1,李洪霞2*
(1.空军总医院干部病房东楼3区,北京 100142;2.吉林大学中日联谊医院中心研究室,吉林 长春 130033)
目的 探讨转染GML基因对顺铂杀伤肺癌A549细胞敏感性的影响。方法 应用脂质体将GML基因稳定转染入肺癌A549细胞。应用RT-PCR测定GML基因的表达。应用MTT法测定GML基因对于A549生长的影响,以及不同浓度顺铂对细胞的杀伤率,以此计算出顺铂杀伤细胞的IC50。结果 RT-PCR结果显示,在GML基因转染的A549细胞有GML基因的表达,而在转染对照质粒以及正常A549细胞未见GML基因的表达。转染GML基因的A549细胞生长数目明显低于未转染组。顺铂对于转染GML基因的A549细胞杀伤效率明显高于未转染组,转染GML基因细胞与为未转染基因细胞相比其IC50降低4倍。结论 转染GML基因可以显著提高肺癌A549细胞对顺铂的敏感性。
GML基因;A549细胞;顺铂;化疗敏感性
顺铂是迄今为止治疗肺癌最有效的化学药物之一,但其治疗的疗效仍维持在20%~30%。因此如何提高化疗药物的治疗效果是肺癌治疗过程中急需解决的问题。近几年的一些研究表明肿瘤细胞的某些基因的表达可以影响顺铂对肿瘤治疗的敏感性,因此通过提高或减少这些基因的表达可以有效提高肿瘤针对顺铂治疗的敏感性[1-5]。
GML(glycosylphosphatidylinositol-anchoredmoleculelikeproteingene)蛋白是由p53分子诱导表达的一种糖基化磷脂酰肌醇(GPI)锚定分子样蛋白,参与细胞周期与细胞凋亡的0控[6],NaamuraY等在体外对非小细胞肺癌患者的肿瘤细胞进行化疗药物的体外敏感性实验中发现,高表达GML基因的肿瘤细胞具有对顺铂较高的敏感性。这说明了GML基因的高表达可能提高肺癌细胞对于顺铂的敏感性[7]。因此本研究拟将GML基因转导入肺癌A549细胞内,观察导入的GML基因是否可以提高肺癌细胞对顺铂杀伤的敏感性,从而进一步明确GML基因在顺铂治疗肺癌中的作用,为提高顺铂治疗肺癌效果提供新的方案。
1 资料与方法
1.1 一般资料
人肺腺癌A549细胞株购自中国科学院上海生命科学院细胞所,胎牛血清购自杭州四季青,高糖DMEM培养基、G418均购自Gibco公司,质粒pcDNA3.1(+),以及pcDNA3.1(+)-GML由本科室保存与构建,转染试剂LipfectinAmina2000购自invitrogen公司,细胞RNA提取试剂盒与RT-PCR试剂盒均购自北京天根公司,MTT购自sigma公司,化疗药物顺铂购自齐鲁制药,设计的引物由上海生工合成。
1.2 方法
1.2.1 细胞培养与GML基因细胞稳定转染将人肺腺癌A549细胞株接种于10%FCS的DMEM培养液中(添加青链酶素的终浓度为100 U/mL),置37℃,5%CO2的培养箱内培养。用0.25%胰蛋白酶消化对数生长期肿瘤细胞,吹打成单细胞悬液,以1×104/孔接种于24孔培养板,待细胞长至孔板的70%~80%时应用Lipfectinamine2000分别进行质粒pcDNA3.1(+)与pcDNA3.1(+)-GML的转染。转染48 h后按1:3传代,用筛选培养基培养(400 ug/mL G418),每3~4 d换液1次,直至出现成团生长的转染细胞集落。挑选单个集落,接种于6孔板中,培养至第10代开始,G418浓度降半量维持,至第15-20代建立稳定转染的细胞株。其中转染pcDNA3.1(+)质粒的A549细胞记作A549-vector,转染pcDNA3.1(+)-GML质粒的A549细胞记作A549-GML,而未转染质粒的A549细胞记作A549。
1.2.2 RT-PCR测定GML基因的表达依据引物设计的原则,参照人β-actin基因cDNA序列设计一对引物,上游引物为5’CTCCATCCTGGCCTCGCTGT3’;下游引物:5’GCTGTCACCTTCACCGTTCC3’,PCR产物长度为268bp。参照人GML基因的cDNA序列(NM_002066)设计一对引物,上游引物为5’ATGC GCGCTCAGTGGACTTACAG3’;下游引物为:5’CCAGCCTCACAGTTCCTTCT3’PCR产物长度为358bp.应用细胞RNA提取试剂盒分别提取A549、A549-vector,A549-GML细胞的总RNA,应用逆转录试剂盒进行逆转录,生成各组细胞的cDNA,以各组细胞的cDNA为模板,应用设计的合成的β-actin与GML基因引物进行PCR。应用琼脂糖凝胶电泳观察PCR结果。
1.2.3 化疗药物作用培养细胞分别将处于对数生长期的A549、A549-vector、A549-GML细胞以5×103/孔接种于96孔板中,常规培养24 h后细胞进行换液。将作用细胞的化疗药物顺铂按照血药峰值浓度(ppc)进行配置,其保存浓度为血药峰值浓度的200倍,顺铂血药峰值浓度为3.6 ug/mL,药物作用细胞的浓度为ppc浓度的200%,100%,50%,25%,12.5%以及6.25%。每种药物浓度做3个平行孔。同时设定各组细胞的未加药孔为对照孔。
1.2.4 细胞存活检测以及药物敏感性判定应用MTT法测定不同时间细胞的A549、A549-vector、A549-GML细胞增殖。应用MTT法测定顺铂作用三种细胞48 h后的细胞存活。根据测定的OD值计算化疗药物对细胞的杀伤率。计算公式为:细胞的杀伤率=(对照孔OD值-实验孔OD值)/对照孔OD值。应用细胞的杀伤率与对应的药物浓度建立曲线方程,计算出化疗药物针对该细胞的IC50即使半数细胞死亡的药物浓度。
1.3 统计学分析
所有数据应用SPSS 10.0软件进行统计分析,计量资料采用“”表示,多组均数间的比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 实验结果
2.1 GML基因在A549细胞内的表达
提取A549.、A549-vector与A549-GML细胞的RNA,应用RT-PCR分别测定GML基因在三组细胞的mRNA表达水平。凝胶电泳结果显示:在268bp处,三组细胞都有电泳条带,说明三组细胞都有人β-actin基因mRNA的表达。在358bp处在A549-GML细胞组可见明显的DNA条带,而A549与A549-vector细胞组未见DNA条带,说明只有GML基因转染的A549细胞内才有GML基因的表达。上述结果表明GML基因已被成功转染入A549细胞(图1)。
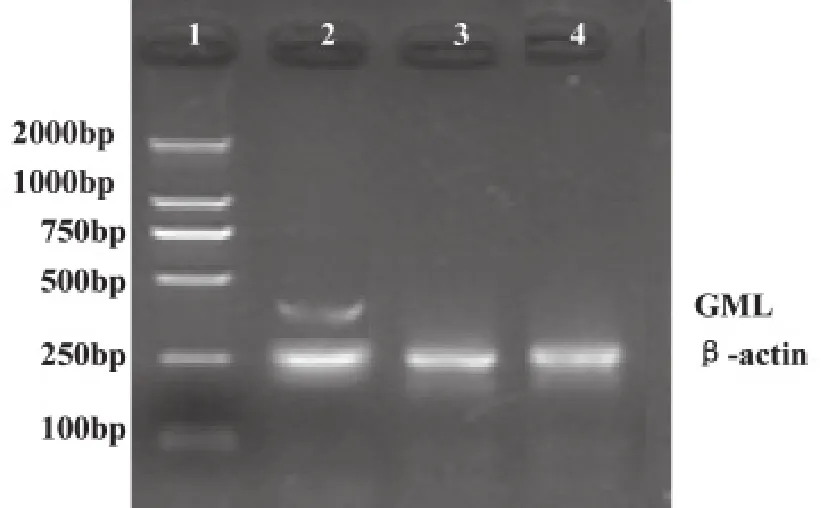
图1 RT-PCR检测GML基因mRNA表达的琼脂糖凝胶电泳结果
2.2 GML基因对A549细胞生长的影响
应用MTT法测定不同时间内三组细胞的生长情况。结果显示三组细胞随着时间的延长,细胞数目多有所增加,但在第4天,A549-GML细胞其细胞数目增多的水平明显低于其他两组细胞,说明GML基因可以抑制A549细胞的生长(图2)。
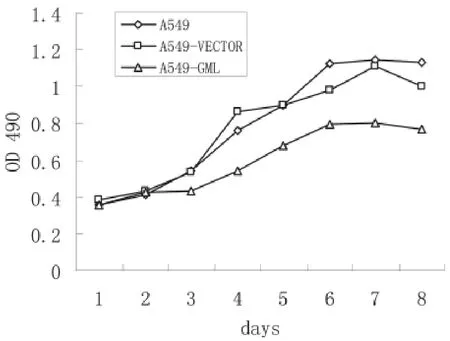
图2 三组A549细胞的生长曲线
2.3 顺铂对三组细胞杀伤结果
应用MTT法测定顺铂对于三组A549细胞的杀伤功能。结果显示随着药物浓度的下降,对细胞的杀伤率也逐渐下降,其中A549-GML组下降幅度低于其他两组。顺铂对于三组细胞杀伤的IC50分别为:A549细胞为41.1(%ppc),A549-VECTOR细胞为40.3(%ppc),A549-GML为11.5(%ppc)。上述结果说明转染GML基因明显提高了A549细胞对于顺铂的敏感性(图3)。
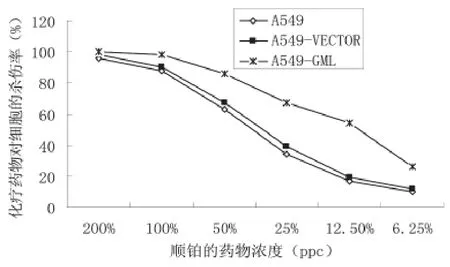
图3 顺铂对三组细胞的杀伤率曲线
3 讨论
肺癌是严重威胁人类健康与生命的恶性肿瘤,在非小细胞肺癌治疗仍以手术治疗为主,而术后的化学治疗作为重要辅助手段。顺铂是进行非小细胞肺癌化疗的主要药物之一。但单纯药物的应用效果仍然有限。因此通过多种治疗手段的联合应用以期提高肺癌治疗的效果。
GML基因是一种糖基化磷脂酰肌醇(GPI)锚定分子样蛋白,其表达受到P53基因的调控。几个研究表明,该基因的表达与肿瘤细胞针对某些化疗药物的敏感性有关。TakashiTokino等在对GML基因生物活性研究的过程中发现该基因与食管癌化疗药物的敏感性相关,将GML基因转染入喉癌细胞株后,明显提高了喉癌细胞对紫杉醇的敏感性[8-9]。HashimotoY等研究认为GML基因在肠癌细胞系的高表达与肿瘤细胞对化疗药物丝裂霉素与氟尿嘧啶的敏感性相关[10]。NakamuraY等在体外对非小细胞肺癌患者的肿瘤细胞进行化疗药物的体外敏感性实验中发现,肿瘤细胞高表达GML基因的患者对顺铂具有的敏感性[7]。在这些研究的基础上,本实验将GML基因转染肺癌细胞株A549细胞,探讨了GML基因的高表达是否能够提高肺癌细胞对顺铂的敏感性。
本实验结果表明转染GML基因明显降低了A549细胞的生长的速度,说明GML本身可以抑制A549细胞的生长,其抑制的机制需要进一步研究。转染GML基因的A549细胞与未转染的GML基因的A549细胞相比,显著提高了对顺铂杀伤的敏感性。其IC50减少了将近4倍。通过本研究进一步证实了GML基因的表达与非小细胞肺癌对于顺铂化疗的敏感性具有密切关系。检测该基因在肺癌组织内的表达情况,可以作为判定肺癌针对顺铂化疗的敏感性指标之一。同时可将GML基因治疗与化疗相结合,提高肺癌治疗效果。
[1]Lai SL,Perng RP,Hwang J,et al.p53 gene status modulates the chemosensitivity of non-small cell lung cancer cells[J].J Biomed Sci,2000,7(1):64-70.
[2]Nishi M,Abe Y,Fujimori S,et al.The modifier subunit of glutamate cysteine ligase relates to c isplatin resistance in human small cell lung cancer xenografts in vivo[J].Oncol Rep,2005,14(2):421-424.
[3]Nakagawa T,Inoue Y,Kodama H,et al.Expression of coppertransporting P-type adenosine triphosphatase (ATP7B) correlates with cisplatin resistance in human non-small cell lung cancer xenografts[J].Oncol Rep,2008,20(2):265-270.
[4]Deng WG,Wu G,Ueda K,et al.Enhancement of antitumor activity of cisplatin in human lung cancer cells by tumor suppressor FUS1[J].Cancer Gene Ther,2008,15(1):29-39.
[5]Andriani F,Perego P,Carenini N,et al.Increased sensitivity to cisplatin in non-small cell lung cancer cell lines after FHIT gene transfer[J].Neoplasia,2006,8(1):9-17.
[6]Ueda K,Miyoshi Y,Tokino T,et al.Induction of apoptosis in T98G glioblastoma cells by transfection of GML,a p53 target gene[J].Oncol Res,1999,11(3):125-132.
[7]Higashiyama M,Miyoshi Y,Kodama K,et al.p53-regulated GML gene expression in no-small cell lung cancer.a promising relationship to cisplatin chemosensitivity[J].Eur J Cancer,2000,36(4):489-495.
[8]Furuhata T,Tokino T,Urano T,et al.Isolation of a novel GPI-anchored gene specifically regulated by p53;correlation between its expression and anti-cancer drug sensitivity[J].Oncogene,1996,13(9):1 965-1 970.
[9]Kimura Y,Furuhata T,Shiratsuchi T,et al.GML sensitizes cancer cells to Taxol by induction of apoptosis[J].Oncogene,1997,5(11):1 369-1 374.
[10]Hashimoto Y,Ueda K,Minami K,et al.The potential clinical value of GML and the p53 gene as a predictor of chemosensitivity for colorectal cancer[J].Int J Clin Oncol,2001,6(2):90-96.
Transfer of GML Gene Increase the Chemosensitivity of Cisplatin to A549 Cell In Vitro
SUI Dong-jiang,LI Wei-sheng,WANG Rong-mei,CHEN Yan-xia,WANG Zhao-yuan,LI Feng-zhi,LI Hong-xia
(Air Force General Hospital,PLA,BeiJing 100142,China)
Objective To investigate the effect of GML gene on the chemosensitivity of cisplatin to A549 cell In vitro.Methods The GML gene was transfected stably into A549 cells by lipofectamin.The GML gene mRNA levels at A549 cell were measured by reverse transcription polymerase chain reaction (RT-PCR).The effect of GML gene on cell growth and In vitro cytotoxicity of cisplatin at various concentrations were analyzed with MTT.IC50 of cisplatin that defined as the drug concentration required to produced 50% inhibition of cell growth was calculated for judging the chemosensitivity of drug to A549 cell.Results The RT-PCR result showed increased obviously of GML gene mRNA levels in A549 cells with transfected GML gene when compared with A549 cells without transfected GML gene.The MTT results show GML gene transfered A549 cells exhibited marked declines in proliferation when compared to the parental A549 cells.IC50 of cisplatin is also decreased four times for GML transfection A549 cells compared A549 cells.Conclusion GML gene can increase the chemosensitivity of cisplatin to A549 cells.
GML gene;A549 cells;Cisplatin;Chemosensitivity
R734.2
A
10.3969/j.issn.1674-070X.2011.04.007.019.03
2010-12-08
隋东江(1975-),男,长春人,主治医师,主要从事老年呼吸病研究。
*李洪霞(1972-),女,长春人,副主任医师,主要从事肿瘤分子机理研究。
马宏宇)

