9-顺式维甲酸协同 -干扰素下调神经母细胞瘤细胞MYCN和MDR1基因mRNA表达的实验研究*
孙福涛 王 兴 张文同
(1. 临沂市人民医院儿外科,山东 临沂 276003;2.临沭人民医院外科,山东 临沂 276003;3.山东大学齐鲁医院儿外科, 山东 济南 250012)
NB的诱导分化治疗是目前国内外肿瘤研究的热点问题,我们以往的实验证实[1],9-cis RA联合g-IFN在诱导NB细胞分化、生长抑制、凋亡和死亡方面具有明显的协同作用,但其作用的分子生物学机制未被阐明。我们经过进一步实验,旨在通过测定9-cis RA联合γ-IFN在体外诱导NB细胞分化过程中MYCN和MDR1基因mRNA表达方面的变化并对其进行相关性分析,试图在基因水平探讨其联合作用的机理。
1 材料和方法
1.1实验材料和试剂
1.1.1人NB SK-N-SH细胞系细胞购于中国医学科学院细胞资源中心。
1.1.29-cis RA(购自美国Sigma试剂公司)和g-IFN(上海克隆生物高技术有限公司生产)分别用二甲基亚砜和去离子水溶解,避光储存于-20℃条件下。FQ-PCR试剂盒由宝生物工程(大连)有限公司生产。
1.2实验方法
1.2.1细胞培养
将NB细胞置于37℃、5%CO2的CO2培养箱中用含10%胎牛血清的高糖DMEM培养液孵育培养,根据细胞增生速度约3d换液1次,当细胞覆盖瓶底面积80%以上时做传代处理。实验时用处于对数生长期的细胞,台盼兰拒染率在95%以上。
1.2.2实验分组和细胞收集
取对数生长期的SK-N-SH细胞,常规接种,培养24h后随机分为A(对照组,用不加任何药物的高糖DMEM细胞培养液培养)、B组(用含1?mol/L浓度的9-cis RA培养液培养)、C组(用含50 IU/mL浓度的g-IFN培养液培养)和D组(用含1mol/L 9-cis RA+50 IU/mlL g-IFN浓度的细胞培养液培养),于处理后第5d收集细胞进行实验检测。
1.2.3引物的设计合成
人MYCN和MDR1基因PCR扩增引物采用Primer Premier 5.0软件设计,以看家基因β-actin(不同样品间表达量基本恒定)作为内参照。各基因引物由上海生工生物科技有限公司合成,其序列及扩增片段长度见表1。
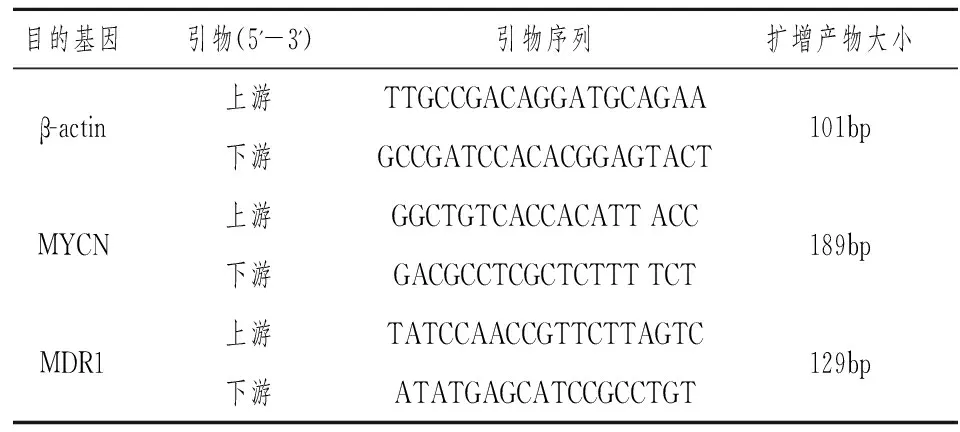
表1 引物序列及扩增片段长度
1.2.4细胞总RNA的提取
实验所用物品的去RNase处理,用Trizol试剂(美国Gibco公司)严格按照说明书提取总RNA,并用紫外分光光度计测定其波长260 nm时的吸光度值,计算RNA 浓度。
1.2.5逆转录反应合成cDNA
向经DEPC处理过的0.5ml Eppendorf管中加入表2所示试剂:

表2 逆转录反应体系
快速离心混匀;370C 1h,950C 10min灭活M-MLV;快速离心使蒸汽沉于管底。
1.2.6MYCN和MDR1基因mRNA表达的检测
1.2.6.1按表3组份配制PCR反应液

表3 PCR反应液的组份
1.2.6.2进行FQ-PCR 反应
PCR反应毛细管轻轻离心后放入Light Cycler Real Time 扩增仪(德国Roche Diagnostics公司产品)中,用两步法PCR扩增标准程序进行FQ-PCR 反应:①预变性:95℃ 10s 20℃/s 1 循环。②PCR反应:95℃ 5s 20℃/s;60℃ 20s 20℃/s;40循环。③融解曲线分析:95℃ 0s 20℃/s;65℃ 15s 20℃/s;95℃ 0s 0.1℃/s。
1.2.7实验结果分析
反应结束后确认FQ-RT-PCR 的扩增曲线和融解曲线,用Ct值相对定量表示样本基因的数量。先选用β-actin的数量作内参进行标准化,再比较处理前后样品基因数量的标准化值。各组分别取不同培养瓶内收集的细胞重复实验5次,最终比较其均值。
1.2.8统计学方法

2 结 果
2.1扩增曲线和溶解曲线分析
MYCN和MDR1基因的扩增曲线显示四组样品的Ct值在正常范围18~30之间,表明实验结果数据准确可靠。熔解曲线显示四组样品的荧光强度在变化拐点(熔点,Tm)处各可清晰地看到了一个单一的峰,分别是在 89.5°C 和88°C左右,这个峰对应着扩增产物的熔解温度,表明扩增产物为目的产物。荧光强度随温度变化的负一次倒数图中没有出现杂峰,也未出现主峰的异常增宽,表明实验中未出现污染、引物二聚体和假阳性现象。
2.2MYCN 和MDR1基因mRNA的相对含量测定
我们使用β-actin作为内参,以样品待测基因得值除以此样品内参得值,最终得到的比值为样品的待测基因相对含量。校正后各组MYCN 和MDR1基因mRNA的相对含量结果见表4。

表4 校正后各组MYCN 和MDR1基因mRNA的相对含量
注:*:与A组相比,P<0.01;△与D组相比,P<0.01
各组细胞经不同处理后,A组与B、C、D三组比较MYCN和MDR1基因mRNA表达的相对含量均有明显下降(P<0.01),其中尤以D组(9-cis RA+g-IFN联合用药组)降低最为显著,又优于B、C两组(P<0.01)。
2.3MYCN和MDR1基因mRNA表达的相关性分析
对各组细胞MYCN和MDR1基因mRNA表达的相对系数进行Pearson直线相关分析,结果见表5。
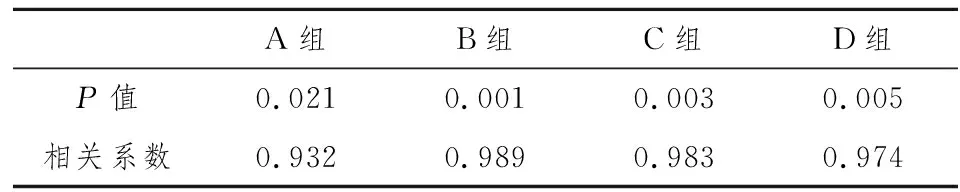
表5 各组细胞MYCN和MDR1基因mRNA表达的相关系数
MYCN基因与MDR1基因mRNA表达的相关分析显示均P<0.05,有统计学意义;相关系数为0.932~0.989,两者呈明显的正相关关系。
3 讨 论
NB是来源于节后交感神经系统的胚胎性恶性肿瘤,其发病率为1/10万,在小儿恶性肿瘤中居第三位,占所有小儿恶性肿瘤病死率的15%。目前研究认为该病的发生、发展乃至预后是一个多种癌基因参与的复杂过程[2]。通过对这些相关癌基因或其他分子生物学标记物的研究,不仅能使我们对NB的发病机制有进一步的了解,而且将有助于我们更好地判断NB的临床预后和提出新的治疗方案。
MYCN基因是从NB的细胞中分离出的神经外胚层专一的原癌基因,其作用是缩短细胞生长周期,促进细胞增殖,抑制细胞分化、凋亡。在NB的发生过程中,MYCN癌基因的扩增是激活癌基因的主要方式。癌基因的大量复制,必然会导致其表达产物的异常增多,从而激活那些与细胞增殖有关的基因,产生细胞增殖效应,这可能是MYCN癌基因在NB中异常表达及引起细胞增殖的主要原因[3]。近年来人们对NB细胞系统及瘤组织MYCN基因进行检测,结果显示MYCN基因扩增是NB迅速发展和预后不良的可靠指标,其激活、表达与NB细胞恶性增殖、不分化、早期浸润、转移的恶性生物学行为及肿瘤的分期和预后直接相关,有MYCN扩增者预后差,且扩增倍数越高则预后越差[4]。MYCN基因扩增是肿瘤本身所固有的,不受外界因素干扰,其基因扩增为目前大家公认的NB分子生物学指标,能排除人为因素,更独立、更明确的提示预后[5]。而临床分期会受就诊时间、诊断水平等因素干扰,影响其提示预后的准确性,因而MYCN基因常作为疾病评估和疗效观察的分子生物学指标[6]。通过研究它和NB发病的关系,可帮助了解NB发病机制,可结合MYCN扩增和其他预后因素对NB预后做出正确评估[7]。
肿瘤细胞对化疗药物产生的MDR(多要耐药)是化疗失败和肿瘤复发的主要原因。因此,关于MDR产生的机制以及如何抑制肿瘤多药耐药,提高肿瘤细胞对化疗药物的敏感性问题一直是国内外有关专家的研究热点[8]。引起细胞耐药的原因很多, 形成MDR的机制很复杂,是多因素、多种机制共同作用的结果。现已明确由7号染色体上的MDR1编码的药物转运泵P-糖蛋白(P-glycoprotein, P-gp)表达增强是MDR主要机制之一[9]。编码P-gp的基因为多基因家族MDR,人类有MDR1和MDR2两种MDR基因,仅MDR1基因与耐药有关。从分子生物学理解MDR形成过程是:基因→转录→MDR1mRNA→翻译→P-gp→泵出胞内抗癌药物→MDR表型。MDR1mRNA的水平增高,必将引起其翻译产物P-gp过度表达而产生耐药,因此,MDR1mRNA的扩增水平与肿瘤细胞的耐药程度密切相关。
FQ-PCR亦有人称为"TaqMan"技术,实现了PCR从定性到定量的飞跃,以其特异性强、灵敏度高、重复性好、定量准确、速度快、全封闭反应等优点成为了分子生物学研究中的重要工具,是迄今为止定量最准确,重现性最好的定量方法,已得到全世界的公认,广泛用于基因表达研究、转基因研究、药物疗效考核、病原体检测等诸多领域。
我们从FQ-RT-PCR的结果可以看出,9-cis RA 和?-IFN能明显抑制MYCN和MDR1基因扩增,其中联合用药又明显优于单独用药,二者并有协同效应。根据NB细胞分子生物学特性及MYCN和MDR1基因的功能特点,我们分析认为,9-cis RA 协同?-IFN 诱导NB 细胞分化、凋亡、死亡和生长抑制的机制为下调MYCN和MDR1基因扩增,一方面抑制了NB细胞原癌基因的生物学表现,另一方面预防了多药耐药,二者之间起到了良好的协同效应,在小剂量的情况下就得到了显著的效果。用SPSS11.5统计软件对各组细胞MYCN和MDR1基因mRNA表达的相对系数进行Pearson直线相关分析显示,两者呈明显的正相关关系,为其联合应用提供了分子生物学依据和理论基础。
NB作为一个实体肿瘤,其临床表现的多样性和复杂性是由其分子生物学的复杂性所决定的,各个因素不是独立存在的,而是通过某些机制紧密联系在一起的[10],对于其分子生物学标记物的进一步深入研究,将有助于阐明其分子生物学机制,从而形成一套系统合理的诊断、判断预后、指导治疗的方案,可望为NB的治疗提供新的依据和手段。
[1] 孙福涛, 张文同, 王旭平. 9-顺式维甲酸协同g-干扰素诱导神经母细胞瘤分化、凋亡及生长抑制的实验研究[J]. 中华小儿外科杂志,2007,28(5):258-262.
[2] Liu T, Bohlken A, Kuljaca S, et al. The retinoid anticancer signal: mechanisms of target gene regulation[J]. Br J Cancer, 2005, 93(3):310-318.
[3] Weber A, Starke S, Bergmann E, Christiansen H. The coamplification pattern of the MYCN amplicon is an invariable attribute of most MYCN-amplified human neuroblastomas[J]. Clin Cancer Res,2006,12(24):7316-7321.
[4] Parodi S, Papio F, Haupt R, et al. The prognostic role of urinary catecholamines in infants with disseminated neuroblastoma may be mediated by MYCN amplification[J]. Pediatr Blood Cancer, 2007, 48(5):593.
[5] Alaminos M, Gerald WL, Cheung NK. Prognostic value of MYCN and ID2 overexpression in neuroblastoma[J]. Pediatr Blood Cancer, 2005, 45(7):909-915.
[6] Suita S, Tajiri T, Kaneko M, et al. Implications of MYCN amplification in patients with stage 4 neuroblastoma who undergo intensive chemotherapy[J]. J Pediatr Surg, 2007, 42(3):489-493.
[7] Tang XX, Zhao H, Kung B, et al. The MYCN enigma: significance of MYCN expression in neuroblastoma[J]. Cancer Res, 2006, 66(5):2826-2833.
[8] Bader P, Schilling F, Schlaud M, et al. Expression analysis of multidrug resistance associated genes in neuroblastomas[J]. Oncol Rep, 1999, 6(5):1143-1146.
[9] Dhooge CR, De Moerloose BM, Benoit YC, et al. Expression of the MDR1 gene product P-glycoprotein in childhood neuroblastoma[J]. Cancer, 1997, 80(7):1250-1257.
[10] Chen Y, Stallings RL. Differential patterns of microRNA expression in neuroblastoma are correlated with prognosis, differentiation, and apoptosis[J]. Cancer Res, 2007, 67(3):976-983.

