Survivin、COX-2与胆管癌的血管生成
欧阳波,张有成,黄 强
近年来的大量研究表明,Survivin和COX-2在多种肿瘤组织中过表达,通过抑制肿瘤细胞凋亡、影响肿瘤血管生成等机制参与肿瘤的发生和发展,但Survivin和COX-2是否通过影响肿瘤血管形成来影响胆管癌的生物学行为尚未清楚。为此我们采用免疫组织化学技术检测Survivin、环氧合酶-2(COX-2)、血管内皮生长因子(vascular endothelial growth factor,VEGF)和CD34在胆管癌组织和正常胆管组织中的表达,并探讨他们与临床病理特征的关系及Survivin、COX-2表达与VEGF表达及微血管密度(microvessel density,MVD)的相关性,为胆管癌的抗血管治疗提供一个新的途径和理论依据。
1 材料与方法
1.1 标本采集 选取安徽省立医院2005年3月—2008年2月手术切除胆管癌标本32例,其中男17例,女15例,年龄43~79岁,平均年龄60.3岁,术前均未行放化疗等抗肿瘤治疗,所有标本均经病理证实,另选正常胆管组织9例为对照组。所有标本均用10%甲醛固定,石蜡包埋,每个蜡块行4 mm厚连续切片。
1.2 主要试剂 鼠抗人Survivin单克隆抗体,鼠抗人COX-2单克隆抗体,鼠抗人VEGF单克隆抗体,鼠抗人CD34单克隆抗体,PV6000试剂盒、浓缩型二甲基联苯胺(DAB)试剂盒均为北京中杉生物技术有限公司产品。
1.3 检测方法 用免疫组织化学SP二步法。将已知阳性的结肠癌切片作为阳性对照,用磷酸盐缓冲液(phosphate-buffered saline,PBS)代替一抗作为阴性对照。实验步骤按试剂盒说明书进行。
1.4 结果判定 (1) CD34阳性判断及MVD计数:采用Weidner法,抗CD34单抗表达于血管内皮细胞胞质或胞膜,任何染色成棕黄色的单个细胞或细胞团,不管其是否形成管腔,只要与周围的微血管、肿瘤组织和其他连接组织有清楚的分离,都认为是一个可记数的微血管。每一标本先于低倍镜(×100)下选3个微血管数最多的区域,然后在高倍镜(×400)下记数每一个区域中5个血管最高密度区的微血管数,取均值代表MVD值。(2) VEGF、COX-2与Survivin的结果判断:VEGF阳性表达为每张切片中看到有大于5%的肿瘤细胞胞质或胞膜出现棕黄色颗粒;COX-2阳性表达为每张切片中看到有大于5%的肿瘤细胞胞质出现棕黄色颗粒;Survivin阳性表达为每张切片中看到有大于5%的肿瘤细胞胞质出现棕黄色颗粒。

2 结果
2.1 胆管癌组和正常胆管组中MVD、VEGF、Survivin和COX-2的表达 具体见表1。

表1 胆管癌组与对照组MVD、VEGF和Survivin表达比较
注:与对照组相比,at=13.36,P<0.01;bχ2=6.35,P<0.05;cχ2=11.96,P<0.05;dχ2=14.88,P<0.01
在胆管癌组织中检测到VEGF(图1)、COX-2(图2)、CD34(图3)和Survivin(图4)的表达;而在正常胆管组中无Survivin表达,只有1例COX-2微弱表达,MVD、VEGF、Survivin和COX-2的表达在两组中差异有显著性意义。
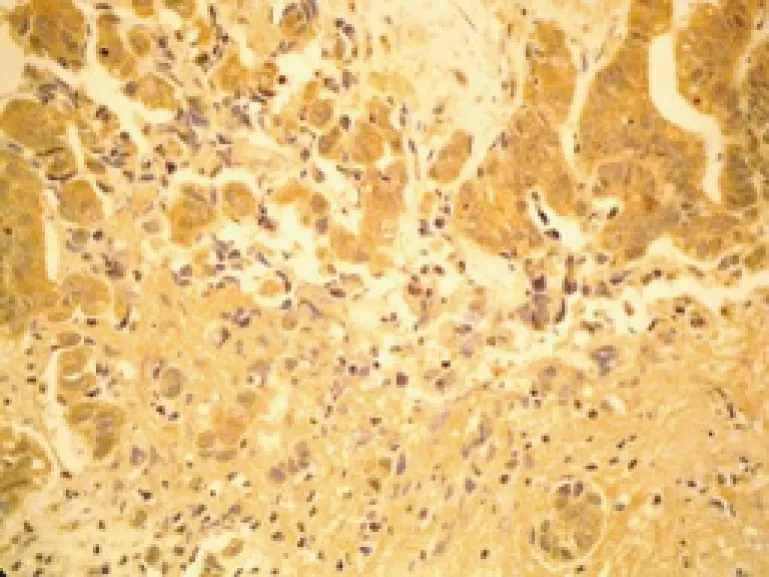
图1 胆管癌中VEGF阳性表达 (SP染色,×400)
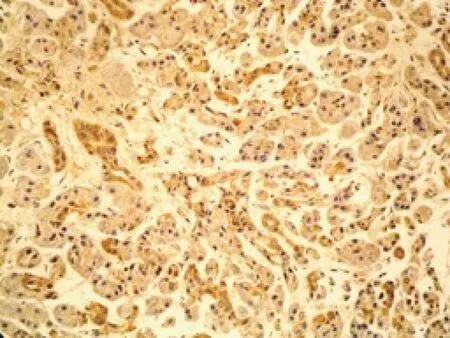
图2 胆管癌中COX-2阳性表达 (SP染色,×400)

图3 胆管癌中CD34阳性表达(SP染色,×400)
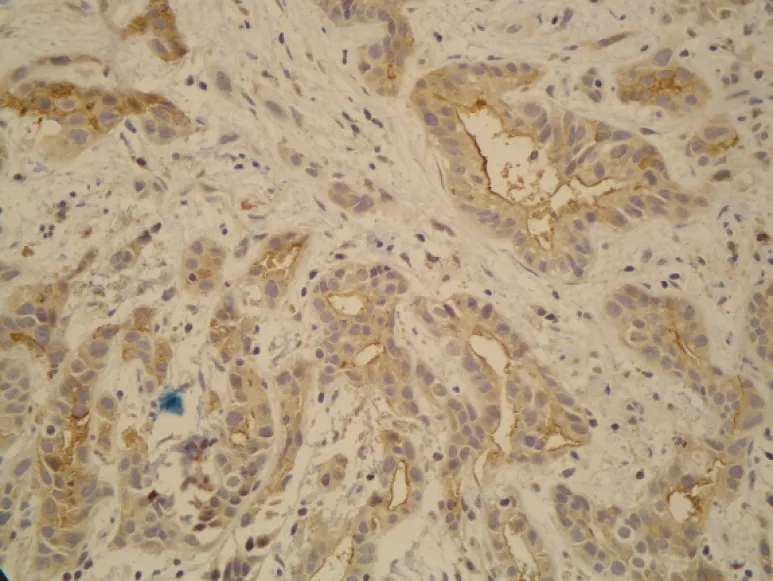
图4 胆管癌中Survivin阳性表达(SP染色,×400)
2.2 胆管癌组织MVD、VEGF、Survivin和COX-2的表达与临床病理资料的关系 胆管癌组织MVD、VEGF、Survivin和COX-2的表达与患者的性别、年龄以及肿瘤的大小、分化无关;而有转移者则较无转移者均显著增高。见表2。
2.3 胆管癌组织MVD与VEGF的表达的相关性 在32例胆管癌病例中,VEGF阳性表达的有21例,其平均MVD为62.97,VEGF表达阴性的平均MVD为34.06,两组比较t=9.35P<0.01,说明VEGF的表达与MVD相关。
2.4 Survivin、COX-2与MVD、VEGF表达的相关性 Survivin阳性表达的病例有23例,其中20例VEGF表达阳性(87.0%),在Survivin表达阴性的9例中,只有1例VEGF表达阳性(11.1%),两组比较χ2=13.31,P<0.01,表明VEGF表达与Survivin表达密切相关;在23例Survivin阳性表达的胆管癌中,MVD平均数为60.94,明显高于Survivin阴性表达的9例(MVD平均数为32.82),两组比较t=8.31,P<0.01;Survivin与VEGF共阳性表达的有20例,其MVD平均数为63.86,明显高于共阴性表达的8例(MVD平均数为31.28),两组比较t=11.13,P<0.01。COX-2阳性表达的病例有25例,其中20例VEGF表达阳性,在COX-2表达阴性的7例中,只有1例VEGF表达阳性,两组比较χ2=7.76,P<0.01,表明VEGF表达与COX-2表达密切相关;在25例COX-2阳性表达的病例中,其MVD平均数为58.95,明显高于COX-2阴性表达的7例(MVD平均数为31.89),两组比较t=6.89 ,P<0.01;COX-2与VEGF共阳性表达病例有20例,其MVD平均数为63.78,明显高于共阴性表达的6例(MVD平均数为29.42),两组比较t=11.96,P<0.05。

表2 MVD、VEGF、Survivin和COX-2的表达与胆管癌临床病理特征的关系
注:与对照组相比,at=6.55,P<0.01;bχ2=16.67,P<0.05;cχ2=4.17,P<0.05;dχ2=2.99,P>0.05
3 讨论
1971年,Folkman首先提出肿瘤生长和转移有血管依赖性。大量研究证实肿瘤生长、侵袭和转移依赖于新生血管的形成,阻断血管生成是抑制肿瘤生长的有效策略,由此产生了抗血管生成治疗肿瘤的设想。随着人们对肿瘤血管生成机制更为广泛深入的研究,针对肿瘤血管生成分子机制所设计的抗血管生成策略,成为肿瘤治疗研究的新热点。胆管癌是胆道常见的恶性肿瘤,既往认为胆管癌是一种血管分布相对较少的肿瘤,但随着对胆管癌形成分子机制研究的深入,血管生成在胆管癌发生发展中的重要性已逐步受到重视。
VEGF是迄今鉴定出来的最重要的血管生成因子,与肿瘤血管新生密切相关,并与肿瘤的转移、预后有关[1]。MVD不仅与肿瘤细胞的营养和供氧有关,还是一个有意义的预测性指标[2]。本实验显示在胆管癌组中的VEGF表达和MVD平均值显著高于正常胆管组织,提示血管新生在胆管癌的发展过程中同样起重要作用,且VEGF、MVD与胆管癌转移关系密切,由此推测VEGF、MVD可能与胆管癌的转移和预后相关。
Survivin是一种结构独特的凋亡蛋白抑制因子家族的成员,特异地表达于人和鼠的胚胎发育组织以及多数人类肿瘤细胞。研究表明,Survivin在细胞凋亡和细胞周期的基因调控中发挥重要作用,使其成为一个非常有吸引力的癌症治疗靶点;我们前期的研究发现Survivin基因参与了胆管癌细胞增殖和凋亡过程[3],本实验结果显示在胆管癌中Survivin基因的表达与转移相关,但与患者的性别、年龄及肿瘤的大小、分化等无关。
血管形成过程的核心是内皮细胞的分裂增殖,确切地说,取决于血管内皮细胞的生存和凋亡平衡的结果,有研究证实在肿瘤血管生成过程中内皮细胞中表达的VEGF可诱导和促进Survivin的高表达,而高表达的Survivin抑制了各种指向caspases的凋亡机制,从而保护内皮细胞逃避凋亡[4]。相反,Survivin表达缺乏可导致内皮细胞及新生毛细血管的退化。研究显示向内皮细胞中导入靶向Survivin的反义寡核苷酸,结果VEGF的促内皮细胞功能受到抑制,从而促进肿瘤内皮细胞凋亡,抑制肿瘤血管的新生,最后导致肿瘤生长受到抑制,达到治疗肿瘤的目的[4-5]。可见,VEGF促进了Survivin的表达,而同时高表达的Survivin又维持和保护了VEGF的促内皮细胞功能,从而促进了肿瘤血管生成和浸润转移。由此推测:VEGF的表达上调可能直接或间接地参与Survivin的基因转录、蛋白合成的调控,及其蛋白功能活化的过程,从而增加Survivin的积累;而Survivin的过度表达,使G2/M期点失控,细胞失去了正常增殖周期中凋亡开关的限制,可促使肿瘤细胞恶性转化和增殖凋亡平衡失调,还可能作为肿瘤血管生成的调控因子参与肿瘤血管生成。本实验结果显示Survivin与VEGF、MVD在胆管癌中的表达具有正相关性,Survivin与VEGF共阳性表达比共阴性表达癌组织中的MVD显著增高,说明Survivin与VEGF、MVD之间的关系密切及Survivin与VEGF在促血管形成方面有协同作用。
环氧合酶-2(cyclooxygenase-2,COX-2) 是前列腺素生物合成的限速酶,大量研究表明COX-2表达增强与多种肿瘤的发生发展有关,COX-2上调可能是肿瘤发生过程中一个重要的限速步骤,COX-2可能通过促进肿瘤细胞增殖和抑制细胞凋亡、促进肿瘤恶性转化、促进肿瘤血管生成等机制参与肿瘤的发生发展[6]。COX-2不仅在多种肿瘤中过表达,而且在原发或转移肿瘤的新生血管内皮细胞中高表达。敲除COX-2基因的实验动物肿瘤组织血管密度下降,肿瘤生长明显减慢,提示COX-2与肿瘤血管生成关系密切。研究发现,COX-2可诱导VEGF和bFGF等促血管生成因子表达,并可通过基质金属蛋白酶(MMPs)和Integrins促肿瘤血管生成。我们前期的研究发现COX-2基因参与了胆管癌细胞增殖和凋亡过程[7]。本实验结果显示,COX-2在胆管癌中高度表达,而在正常胆管组中只有1例微弱表达,提示COX-2可能对胆管癌的发生发展起重要作用,但COX-2的表达与患者的性别、年龄以及肿瘤的大小、分化及是否转移无关;实验结果还显示COX-2与VEGF、MVD在胆管癌中的表达具有正相关性,COX-2与VEGF共呈阳性表达比共呈阴性表达癌组织中的MVD显著增高(P<0.01),我们认为COX-2表达和胆管癌血管生成有关,而VEGF可能是COX-2诱导胆管癌血管生成的重要介质,COX-2与VEGF、MVD之间的密切关系及COX-2与VEGF在促血管生成方面有协同作用。
鉴于血管生成在肿瘤发生发展及血行转移中的特殊作用,COX-2、Survivin和VEGF可能通过影响肿瘤血管生成在胆管癌转移等恶性行为中发挥着重要作用。但是,胆管癌的发生是一个极其复杂的过程,是多基因协同作用、多因素共同参与、综合发展的结果,COX-2、Survivin不仅可以参与胆管癌细胞的增殖和凋亡过程,而且可促进血管的生成,但其过表达只是其中的一种形式,深入研究COX-2、Survivin及其在胆管癌发生发展中的作用,有可能从另一方面揭示胆管癌的发病机制,使得靶向COX-2、Survivin的抗肿瘤治疗具有广泛的应用前景,并为胆管癌的临床诊治开辟一条新的途径,延缓胆管癌复发和转移,提高胆管癌的疗效。
[1]Martins SF,Reis RM,Rodrigues AM,et al.Role of endoglin and VEGF family expression in colorectal cancer prognosis and anti-angiogenic therapies[J].World J Clin Oncol,2011,2(6):272-280.
[2]Zhou D,Cheng SQ,Ji HF,et al.Evaluation of protein pigment epithelium-derived factor (PEDF) and microvessel density (MVD) as prognostic indicators in breast cancer[J].J Cancer Res Clin Oncol,2010,136(11):1719-1727.
[3]欧阳波,黄强,王志华.Survivin、血管内皮生长因子及微血管密度在正常胆管组织和胆管癌组织中的比较[J].中国组织工程研究与临床康复,2007,11(19):3802-3804.
[4]O’Connor DS,Schechner JS,Adida C,et al.Control of apoptosis during angiogenesis by survivin expression in endothelial cells[J].Am J Pathol,2000,156(2):393-398.
[5]Mesri M,Morales-Ruiz M,Ackermann EJ,et al.Suppression of vascular endothelial growth factor-mediated endothelial cell protection by survivin targeting[J].Am Pathol,2001,l58(5):1757-1765.
[6]Sirica AE,Lai GH,Endo K,et al.Cyclooxygenase-2 and ERBB-2 in cholangiocarcinoma: potential therapeutic targets[J].Semin Liver Dis,2002,22(3):303-313.
[7]欧阳波,黄强,王志华.COX-2在胆管癌中的表达及其与血管生成的关系[J].肝胆外科杂志,2006,14(6):432-435.

