基于光波导分光光谱技术研究蛋白质与亚甲基蓝的竞争吸附行为
邓 琳 祁志美
(中国科学院电子学研究所,传感技术国家重点实验室,北京 100190)
基于光波导分光光谱技术研究蛋白质与亚甲基蓝的竞争吸附行为
邓 琳 祁志美*
(中国科学院电子学研究所,传感技术国家重点实验室,北京 100190)
通过利用时间分辨光波导分光光谱技术原位测量从蛋白质-亚甲基蓝(MB)混合水溶液吸附到亲水玻璃光波导表面的MB可见光吸收谱,观测到在溶液pH值低于蛋白质等电点时MB与牛血清蛋白(BSA)以及MB与血红蛋白(Hb)存在竞争吸附行为,进一步测得这种竞争吸附行为对蛋白质浓度十分敏感,可以用于简单测定溶液中的蛋白质含量.基于Langmuir等温吸附理论推导出了两种分子竞争吸附的动力学方程,并利用该动力学方程对实验测得的吸光度随时间变化曲线进行了最佳拟合,揭示了玻璃表面吸附的MB分子个数在达到最大值后随时间呈指数衰减,同时得出拟合参数与蛋白质浓度呈准线性关系.
光波导分光光谱技术; 竞争吸附; 亚甲基蓝; 蛋白质探测
蛋白质作为生命的物质基础之一,与各种形式的生命活动紧密联系在一起,它在催化生命体内的各种反应,调节新陈代谢以及控制遗传信息等方面都起着至关重要的作用.因此对于蛋白质的探测在临床诊断、食品安全、生命现象研究等方面都有重要的应用价值.传统的探测蛋白质含量的方法主要有Folin-酚试剂法(Lowry法)、双缩脲法(Biuret法)、凯氏定氮法(Kjeldahl法)、考马斯亮蓝法(Bradford法)等 ,操作时需要对待测样品进行复杂的化学前处理过程.
随着集成光学技术的发展和波导制造技术的日益成熟,基于光波导传感技术的蛋白质探测方法越来越受到人们的关注[7-13].这类方法具有灵敏度高、抗电磁干扰、轻便易集成等优点,但由于蛋白质分子通常在可见光波段是无色的,直接探测比较困难,通常需要借助于抗原抗体配对或荧光标记等辅助处理过程,使得整个测试过程比较繁琐.本文利用亚甲基蓝(MB)作为吸附指示剂,采用时间分辨光波导分光光谱技术[14-20]实时监测蛋白质与MB在亲水玻璃光波导表面的竞争性吸附,通过探测MB对导波光的吸收来间接探测溶液中的蛋白质.该方法操作简便,样品需求量极少,无需其它任何标记物,只要选择合适的缓冲溶液就可以检测各类蛋白质.下文对牛血清蛋白(BSA)和血红蛋白(Hb)的探测证实了这种方法的可行性,而且其探测的灵敏度可以达到 10-8mol·L-1量级.
1 实验部分
1.1 实验仪器及试剂
LS-1-LL型卤钨灯、光纤、HR4000型CCD光谱分析仪(美国Ocean Optics公司);50 μm厚平面玻璃光波导(日本Matsunami Glass公司);BQ50-1J型蠕动泵(中美合资保定兰格恒流泵有限公司);HARKESPCA接触角测量仪(北京哈科试验仪器厂);THB-2000B型pH计(上海宏胜集团);玻璃棱镜、透镜、线性偏振片(国产).
亚甲基蓝(MB)、磷酸、四硼酸钠(分析纯,北京化学试剂公司);牛血清蛋白(BSA)、血红蛋白(Hb)(美国Sigma公司).
1.2 竞争吸附的探测方法
每种蛋白质都有其特定的等电点(PI),如果溶液的pH值在蛋白质的等电点之上,那么蛋白质分子在溶液中带负电,反之则带正电,而亚甲基蓝(分子式为[C16H18N3S]+Cl-)为阳离子染料,在水溶液中电离后色基[C16H18N3S]+始终带正电.由于未经修饰的玻璃光波导表面显负电性,如果调节溶液的pH值到蛋白质的等电点之下,那么蛋白质分子与MB分子在光波导表面形成竞争吸附的关系.通常蛋白质分子体积较大,吸附慢但吸附牢固,而染料分子小,吸附快但吸附不牢固,因此混合溶液的吸光度应该是随时间迅速上升然后又逐渐下降至平衡的过程.如果选取吸收谱峰值处的某一波长(本文均采用λ=605 nm)处的吸光度数据进行观察,可以发现对于某种特定的蛋白质,不同的浓度对应不同的吸光度下降速率;而对于同一浓度的蛋白质,在不同pH值的缓冲溶液中,对应的吸光度下降速率也不同,这是本文探测溶液中蛋白质含量的主要依据.
实验时首先用去离子水配制浓度为1 mmol·L-1的标准MB溶液和浓度分别为1,2,5和10 μmol· L-1的BSA溶液及Hb溶液备用.对于BSA,配制了pH值分别为2.03和4.02的缓冲溶液,溶液的pH值使用pH计测得,可精确到小数点后两位.本实验中使用的去离子水的pH值为5.89,磷酸经去离子水稀释后用来提供pH值小于去离子水的各种缓冲溶液.对于Hb,配制了pH值分别为4.02和7.70的缓冲溶液,其中pH值为7.70的缓冲溶液由四硼酸钠配制得到.
测试所用的溶液是向2.5 mL缓冲溶液中滴入50 μL 1 mmol·L-1MB备用溶液和100 μL蛋白质备用溶液.因此最终得到的待测溶液中,MB的浓度为18.868 μmol·L-1,BSA及Hb的浓度分别为0.038, 0.075,0.189和0.377 μmol·L-1.为了准确观察蛋白质浓度对吸光度的影响,每次实验中MB的浓度保持不变.
采用时间分辨光波导分光光谱法探测蛋白质和MB混合缓冲溶液在亲水玻璃表面的竞争吸附行为,探测装置及操作方法在参考文献[20]中已有详细的论述.
2 结果与讨论
2.1 BSA与MB的竞争吸附结果
BSA是血液的主要成分,相对分子质量为66000 Da,等电点为4.7.为了对比实验结果,首先以去离子水(pH=5.89)为缓冲溶液进行实验,由于去离子水的pH值高于BSA的等电点,因此观察不到竞争吸附现象.图1显示了pH=5.89的缓冲溶液中MB和BSA的共吸附光谱随时间的变化,插图给出了λ=605 nm处的吸光度随时间的变化,其中BSA的浓度为 0.377 μmol·L-1,MB的浓度为 18.868 μmol·L-1.

图1 利用pH 5.89的MB-BSA混合水溶液得到的MB吸附层的光波导吸收光谱Fig.1 OWG absorption spectra of MB adsorbed from the pH 5.89 mixed aqueous solution of MB and BSAInsert shows the absorbance at λ=605 nm versus time.
下面分别采用pH值为2.03和4.02的缓冲溶液进行实验,BSA的浓度分别为0.038,0.075,0.189和0.377 μmol·L-1,测试结果如图2和图3所示.由于滴入溶液的时刻比CCD开始记录数据的时刻有所延迟,所以吸光度曲线不是严格从t=0 s开始上升.图2和图3中的曲线反映出BSA分子与亚甲基蓝之间具有明显的竞争吸附现象,最初亚甲基蓝迅速吸附到光波导表面,吸光度迅速上升至峰值,之后BSA分子开始吸附并使得亚甲基蓝从光波导表面脱附,吸光度逐渐下降,最终达到平衡.对于某一特定pH值的缓冲溶液,BSA浓度越高,吸光度下降越快,说明竞争吸附现象越明显.
为了讨论光波导芯片的可重复性使用,每进行一步实验都会记录光波导表面五个不同位置的水接触角变化,每次实验完毕使用酒精仔细擦拭玻璃光波导表面,记录结果列于表1.从表中数据可以看出,酒精清洗可使光波导的水接触角恢复到实验前的水平,重复性良好.
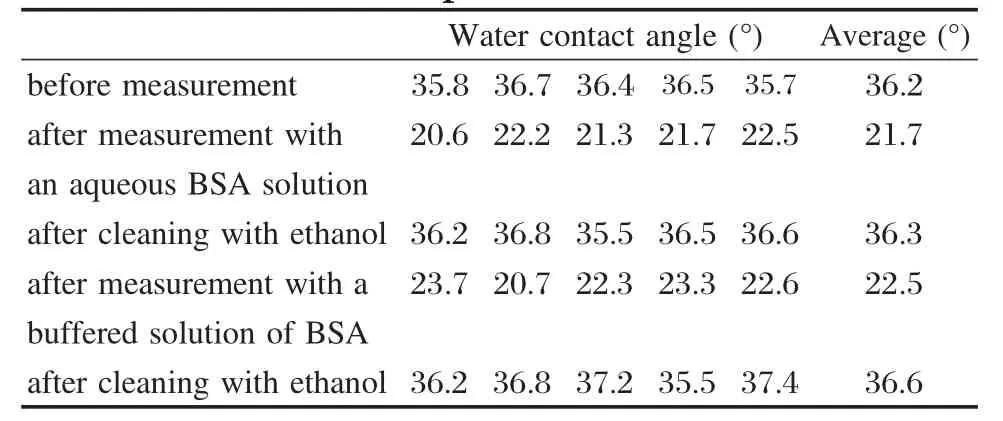
表1 在各个实验阶段测得的玻璃光波导表面的水接触角Table 1 Water contact angles of the glass waveguide surface measured at different time points during the experiment
2.2 Hb与MB的竞争吸附结果
Hb是高等生物体内负责运载氧的一种蛋白质,它的等电点为6.8,分子量为68000 Da.对于Hb我们同样测试了0.038,0.075,0.189和0.377 μmol·L-1四个浓度的蛋白质溶液.由于Hb的等电点高于去离子水的pH值,因此实验用的缓冲溶液的pH值有所调整,分别采用了磷酸配制的pH=4.02的缓冲溶液和四硼酸钠配制的pH=7.70的缓冲溶液.图4和图5给出了这两种pH条件下的测试结果,在pH= 4.02的缓冲溶液中可以观察到明显的竞争吸附现象,而在pH=7.70的缓冲溶液中则无法观察到竞争吸附现象,这跟所预期的结果相一致.

图2 利用pH 2.03的MB-BSA混合水溶液得到的MB吸附层在λ=605 nm处的光波导吸光度随时间的变化Fig.2 Time courses of OWG absorbance at λ=605 nm of MB adsorbed from the pH 2.03 mixed aqueous solutions of MB and BSA
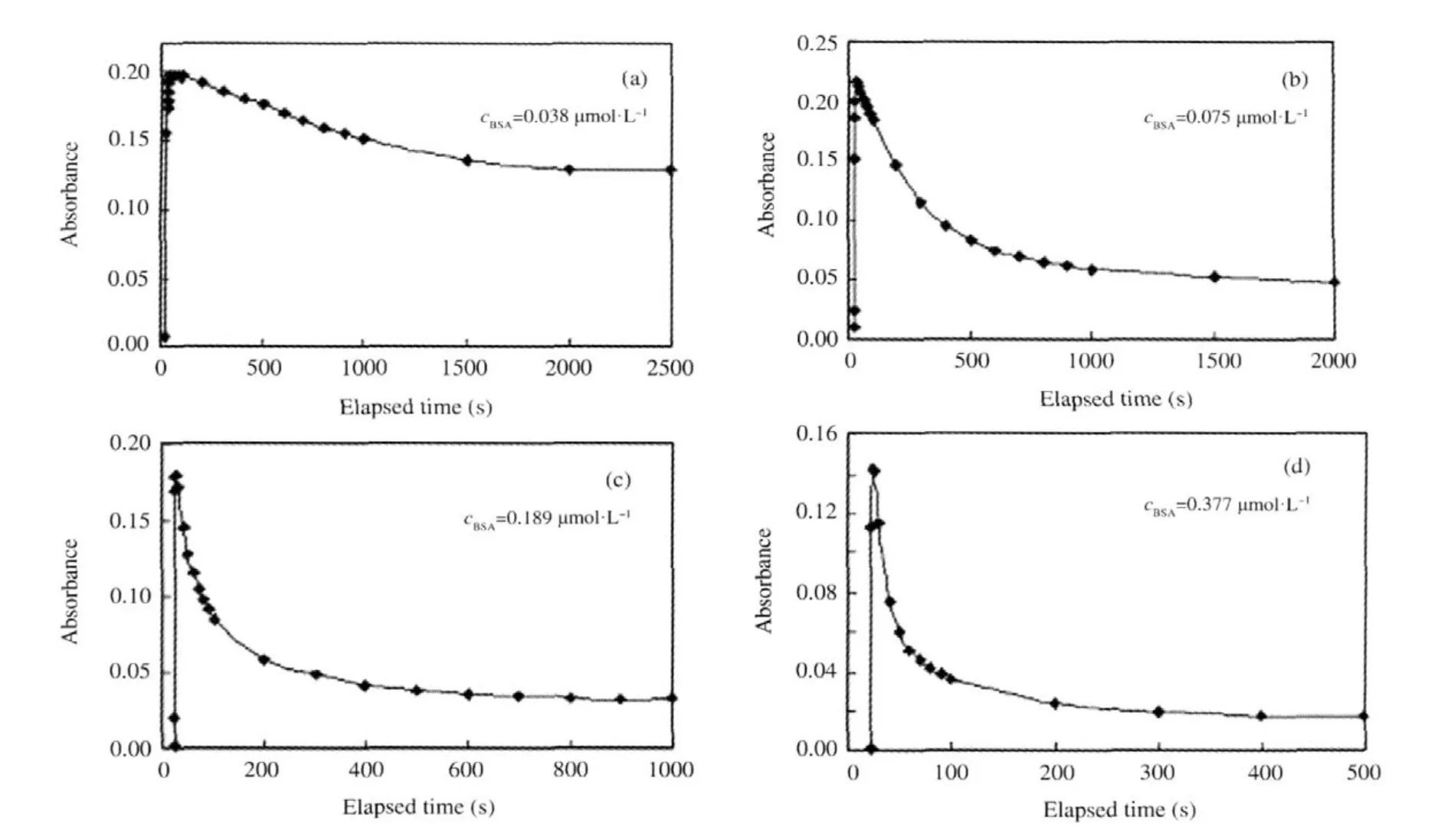
图3 利用pH 4.02的MB-BSA混合水溶液得到的MB吸附层在λ=605 nm处的光波导吸光度随时间的变化Fig.3 Time courses of OWG absorbance at λ=605 nm of MB adsorbed from the pH 4.02 mixed aqueous solutions of MB and BSA
2.3 竞争吸附的动力学模型
光波导表面蛋白质亚单分子层和MB亚单分子层的吸附都满足Langmuir吸附模型[21-25],这里讨论两种不同分子的竞争吸附动力学模型.
对于MB分子和蛋白质分子,其吸附动力学方程可以表示为式(1)和(2):
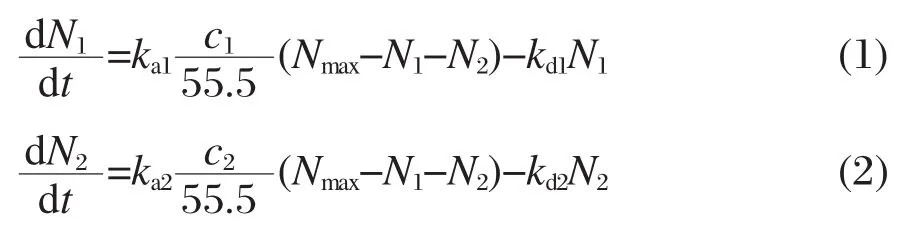
其中,N1和N2分别是某一时刻MB分子和蛋白质分子的表面覆盖率,Nmax是最大表面覆盖率,ka1、kd1和ka2、kd2分别是MB和蛋白质的吸附、脱附速率常数,c1和c2分别为MB和蛋白质的体溶液浓度,55.5为水的浓度(mol·L-1).
当吸光度在时刻tm达到最大值时,图2-图4中的曲线达到拐点,即dN1/dt=0,得到MB的覆盖率峰值(N1peak)为:当N1达到峰值时,可以认为dN2/dt=-dN1/dt,由此得到:


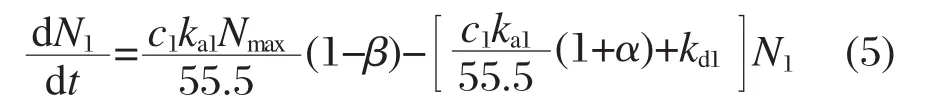
将式(5)移项后两端积分,得到:

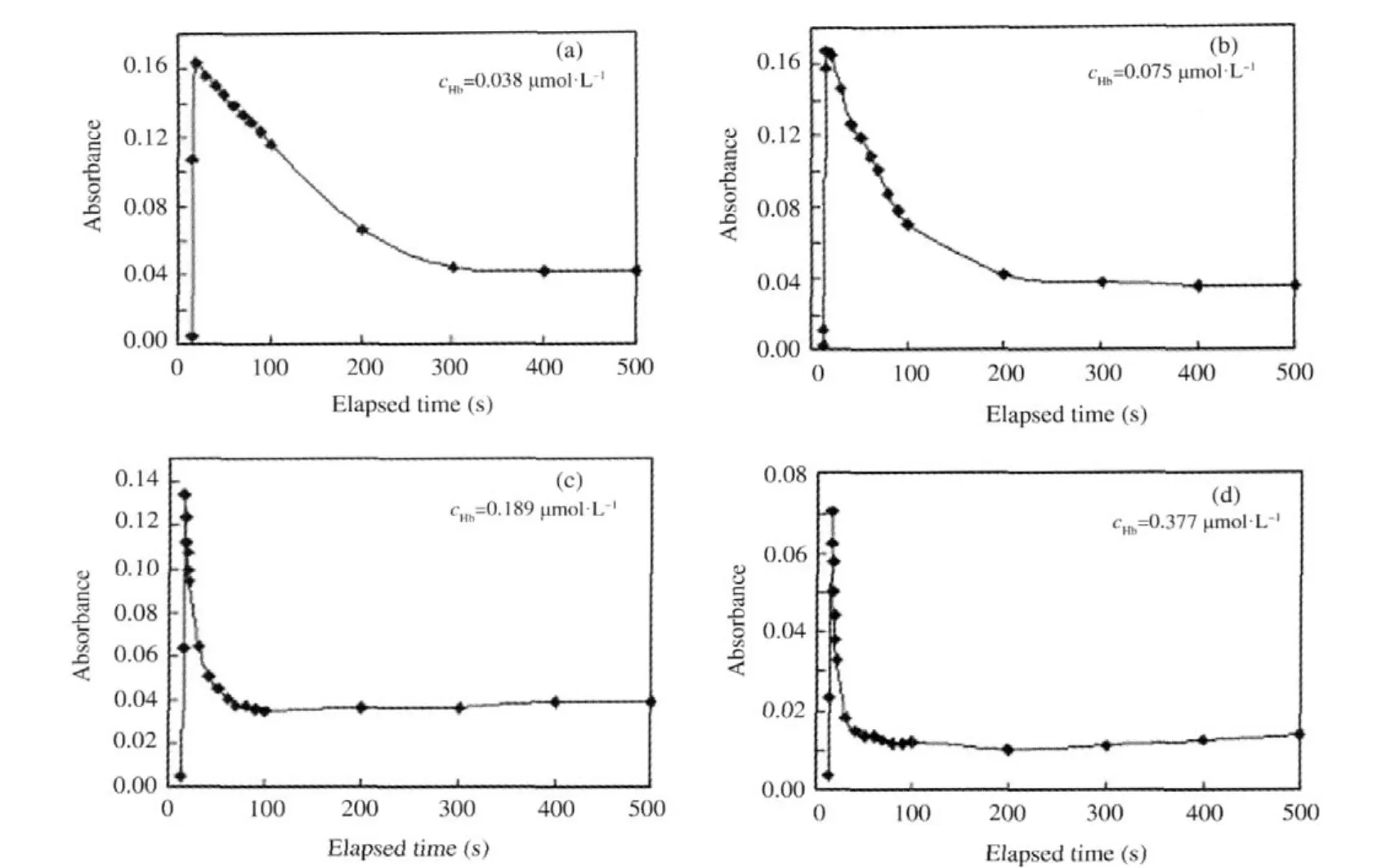
图4 利用pH 4.02的MB-Hb混合水溶液得到的MB吸附层在λ=605 nm处的光波导吸光度随时间的变化Fig.4 Time courses of OWG absorbance at λ=605 nm of MB adsorbed from the pH 4.02 mixed aqueous solutions of MB and Hb
根据公式(8)可知,在竞争吸附过程中MB的表面覆盖率随时间的变化满足指数衰减关系.公式(8)还指出当时间趋于无穷大时N1t=η,也就是说在竞争吸附达到平衡时MB的表面覆盖率为η.在上面的式子中,α、β、η,τ都是只与ka1、kd1、ka2、kd2、c1、c2、Nmax有关的常数.

图5 利用pH 7.70的MB-Hb混合水溶液得到的MB吸附层在λ=605 nm处的光波导吸光度随时间的变化Fig.5 Time courses of OWG absorbance at λ=605 nm of MB adsorbed from the pH 7.70 mixed aqueous solutions of MB and Hb

图6 模拟计算得出的拟合参数τ-1与蛋白质浓度的线性关系Fig.6 Linear relationship between the fitting parameter τ-1and protein concentration obtained with simulationk:rate constant,subscripts 1 and 2 denote the MB and protein, respectively,and subscripts a and d refer to adsorption and desorption,respectively.
根据光波导消逝场理论分析可知在时刻t测得的给定波长的吸光度(At)与该时刻的MB表面覆盖率成正比,即At=γN1t,Amax=γN1peak,Aeq=γη,其中γ为比例常数,Amax为峰值吸光度,Aeq是竞争吸附达到平衡时的吸光度.因此由公式(8)可以得出公式(9):

图7 被吸附的MB分子在λ=605 nm处的吸光度随时间的变化及其最佳拟合曲线Fig.7 Best fitting curve of the time course of absorbance at λ=605 nm for adsorbed MB molecules cBSA=0.038 μmol·L-1,cMB=18.868 μmol·L-1,pH=2.03
在公式(8)和(9)中参数τ的单位为s,其含义为吸光度从其峰值下降了峰值与稳定值之差的1/e所用的时间,或者说MB覆盖率从其峰值下降了峰值与稳定值之差的1/e所用的时间.给定ka1、kd1、ka2、kd2、 c1和Nmax,利用公式(8)对τ和c2的依赖关系进行模拟计算,得到如图6所示的结果.从图中可看出τ的倒数(τ-1)随着c2的增大而线性增加.由此可见增大蛋白质浓度能够使吸附竞争加剧,使竞争吸附达到平衡所用的时间缩短.在利用公式(9)对图2-图4中的实验曲线进行拟合时把τ-1直接作为拟合参数.为了验证拟合效果,选取图2(a)进行拟合,得到图7所示的结果,实验曲线与拟合曲线吻合良好,说明上述理论推导得出的拟合公式具有充分的合理性.
根据拟合的结果,我们可以给出拟合参数τ-1与BSA浓度及Hb浓度的关系曲线,图8(a)和(b)分别给出了pH=2.03和pH=4.02时拟合参数τ-1与BSA浓度的关系图.图9给出了pH=4.02时拟合参数τ-1与Hb浓度的关系图.可以发现对于不同的pH条件以及不同的蛋白质,拟合参数τ-1随蛋白质浓度的升高而增大,二者呈准线性关系,这与图6给出的模拟计算结果一致.

图8 (a)pH=2.03和(b)pH=4.02时拟合参数τ-1与BSA浓度的关系Fig.8 Relationships between the fitting parameter τ-1 and BSA concentration obtained at(a)pH=2.03 and (b)pH=4.02
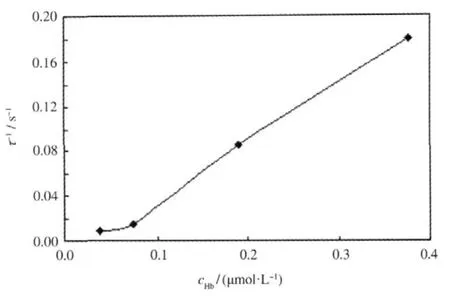
图9 pH=4.02时拟合参数τ-1与Hb浓度的关系Fig.9 Relationship between the fitting parameter τ-1 and Hb concentration obtained at pH=4.02
3 结 论
本文研究了吸附指示剂MB与两种蛋白质BSA和Hb在亲水玻璃光波导表面的竞争吸附行为,给出了一种通过探测MB对导波光的吸收来间接探测溶液中蛋白质含量的方法.该方法基于光波导分光光谱技术,与其它基于光波导的探测技术相比,有效地避免了复杂的样品前处理过程,如:蛋白质抗原抗体配对以及荧光标记等,使得整个测试过程简便易操作.文中根据Langmuir吸附模型推导出了两种分子竞争吸附的动力学方程,根据推导结果对实验测得的吸光度曲线进行拟合,发现实验数据与理论推导符合得很好.由于竞争吸附的存在,MB与蛋白质混合溶液的吸光度在达到峰值以后随时间呈指数衰减,对于某一特定的蛋白质,当缓冲溶液的pH值一定时,蛋白质浓度越高,吸光度下降越快,即衰减系数越大.考察不同情况下拟合参数与蛋白质浓度的关系,得到的曲线具有良好的规律性,为溶液中蛋白质含量的探测提供了依据.
1 Marco,A.;Rubio,R.;Compano,R.;Casals,I.Talanta,2002,57: 1019
2 Coakley,W.T.;James,C.J.Anal.Biochem.,1978,85:90
3 Shen,W.;Chen,J.Z.;Dai,C.J.Food Res.Dev.,2009,30:96 [沈 文,陈均志,代春吉.食品研究与开发,2009,30:96]
4 Li,J.;Zhang,Y.T.;Zeng,W.;Luo,X.;Liao,C.C.Chin.J.Biol., 2000,13:118 [李 娟,张耀庭,曾 伟,罗 璇,廖长春.中国生物制品学杂志,2000,13:118]
5 Minagawa,M.;Winter,D.A.;Kaplan,I.R.Anal.Chem.,1984, 56:1859
6 Penninckx,W.;Verbeke,J.S.;Vankeerberghen,P.;Massart,D.L. Anal.Chem.,1996,68:481
7 Yu,X.L.;Wei,X.;Wang,D.X.;Ding,X.;Liao,W.;Zhao,X.S. Acta Phys.-Chim.Sin.,2005,21:888 [余兴龙,魏 星,王鼎新,定 翔,廖 伟,赵新生.物理化学学报,2005,21:888]
8 Schmitt,K.;Schirmer,B.;Hoffmann,C.;Brandenburg,A.; Meyrueis,P.Biosens.Bioelectro.,2007,22:2591
9 Wu,Z.W.;Liu,Q.J.;Wu,L.W.;Xie,X.;Zhuang,Y.;Wen,T.; Bai,Y.F.;Lu,Z.H.Acta Optica Sinica,2007,27:521 [吴中伟,刘全俊,吴凌伟,谢 骁,庄 萤,温 恬,白云飞,陆祖宏.光学学报,2007,27:521]
10 Kim,N.;Kim,D.K.;Kim,W.Y.Food Chem.,2008,108:768
11 Enami,Y.;Fukuda,T.;Suye,S.Appl.Phys.Lett.,2007,91: 203507-1
12 Kim,N.;Kim,D.Y.;Cho,Y.J.;Moon,D.K.;Kim,W.Y.Biosens. Bioelectro.,2008,24:391
13 Choquette,S.J.;Browm,L.L.;Durst,R.A.Anal.Chem.,1992, 64:55
14 Bradshaw,J.T.;Mendes,S.B.;Saavedra,S.S.Anal.Chem.,2005: 29A
15 Qi,Z.M.;Matsuda,N.;Takatsu,A.;Kato,K.J.Phys.Chem.B, 2003,107:6873
16 Cameron,P.J.;Jenkins,A.T.A.;Knoll,W.;Marken,F.;Milsom, E.V.;Williams,T.L.J.Mater.Chem.,2008,18:4304
17 Qi,Z.M.;Xia,S.H.;Matsuda,N.Anal.Biochem.,2008,374:196
18 Mendes,S.B.;Saavedra,S.S.Opt.Express,1999,4:449
19 Fujita,K.;Taniguchi,K.;Ohno,H.Talanta,2005,65:1066
20 Deng,L.;Lu,D.F.;Qi,Z.M.Acta Phys.-Chim.Sin.,2009,25: 2481 [邓 琳,逯丹凤,祁志美.物理化学学报,2009,25:2481]
21 Azizian,S.;Haerifar,M.;Parsa,J.B.Chemosphere,2007,68: 2040
22 Gomri,S.;Seguin,J.L.;Guerin,J.;Aguir,K.Sens.Actuators, 2006,114:451
23 Koutsopoulos,S.;Patzsch,K.;Bosker,W.T.E.;Norde,W. Langmuir,2007,23:2000
24 Kusakari,A.;Izumi,M.;Ohnuki,H.Colloids Surf.A,2008,321: 47
25 Can,O.;Holland,N.B.J.Colloid Interface Sci.,2009,329:24
May 24,2010;Revised:July 5,2010;Published on Web:August 17,2010.
Study of Competitive Adsorption Behavior of Protein and Methylene Blue by Optical Waveguide Spectroscopy
DENG Lin QI Zhi-Mei*
(State Key Laboratory of Transducer Technology,Institute of Electronics,Chinese Academy of Sciences, Beijing 100190,P.R.China)
We used time-resolved optical waveguide spectroscopy(OWGS)to in-situ measure visible absorption spectrum for methylene blue(MB)adsorbed on a hydrophilic glass waveguide from an aqueous solution containing proteins such as bovine serum albumin(BSA)and hemoglobin(Hb).The competitive adsorption of MB and the protein was detected at a solution pH lower than the isoelectric point of the protein.Since the competitive adsorption behavior of MB and the protein is very sensitive to the protein concentration,the protein content in the mixed solution was readily determined by time-resolved OWGS.In addition,a kinetic equation for the competitive adsorption of the two molecules was deduced based on the Langmuir adsorption isotherm.The best fit of the measured time course of the absorbance with the theoretical kinetic equation reveals that the number of MB molecules adsorbed on the surface exponentially decreases with time after reaching a maximum.A quasi-linear relationship between the fitting parameters and the protein concentration was also obtained.
Optical waveguide spectroscopy; Competitive adsorption; Methylene blue; Protein detection
O647
*Corresponding author.Email:zhimei-qi@mail.ie.ac.cn;Tel:+86-10-58887533.
The project was supported by the National Key Basic Research Program of China(973)(2009CB320300),National Natural Science Foundation of China(60978042),and the BaiRenJiHua Program of Chinese Academy of Sciences.
国家重点基础研究发展计划(973)(2009CB320300),国家自然科学基金(60978042)和中科院“百人计划”择优支持项目资助

