4个传染性囊病野毒株的致病性试验
唐德宏,吴永启,郝明飞,张 帅,孙 见,丁 源,孙淑红
(1.山东省泰安市畜牧兽医局,山东 泰安271000;2.山东农业大学动物科技学院,山东 泰安271018)
传染性囊病(infectious brusal disease,IBD)是由传染性囊病病毒(infectious brusal disease virus,IBDV)引起的一种急性、高度接触性、高度传染性的病毒病。自20世纪 60年代发现传染性囊病(IBD)以来,给世界养禽业带来了极大的损失。对养禽业影响更严重的是,欧洲国家及我国相继出现了vvIBDV方面的报道,其致死率达到了100%[1-4]。
我们曾比较了1998~1999年间采集的12个中国野毒株的致病性[5]以及31个1998~2001年间来自我国不同地区的IBDV野毒株[6],阐明了10年前我国鸡群中IBDV致病性变化的流行病学规律。为揭示近几年来IBDV在致病性上的变异动态,本试验选取了2006~2008年间从山东某地采集表现出IBD临床症状的病鸡病料,分离鉴定了4个IBDV野毒株,并分别在5周龄SPF鸡进行了致病性的比较。
1 材料与方法
1.1 SPF鸡胚、SPF鸡 购自山东济南赛斯家禽有限公司。
1.2 毒株 4个野毒株,分别来自2006~2008年的山东某地收集的原始腔上囊病料。分别取腔上囊病料称重,加4倍灭菌PBS(p H值7.4)研磨,冻融3次。悬液加20%氯仿混匀作用20 min,4 000 r/min离心10 min。并重复1次,加双抗至终浓度4 000 IU/mL。放置4℃过夜。
将处理的病料再接种4~6只4周龄SPF鸡传代,3~4 d后不论是否死亡均采集腔上囊,混合研磨后再按如上处理继续传代。将传代3次并经处理后的腔上囊悬液用无菌离心管分装,放置-20℃待用。分别用作测定ELD50、EID50及人工感染鸡的试验。试验时每次取用一管,不重复使用。
1.3 SPF鸡感染方法 分别用4周龄SPF鸡,每只鸡接种不同毒株的病毒液0.2 mL,点眼、滴鼻各0.1 mL。观察6 d内鸡的死亡数,并对6 d后存活鸡进行剖检,记录腔上囊/体重、胸腺/体重的百分数。
1.4 ELD50和 EID50的测定比较 分别用7 d的SPF鸡胚采用卵黄囊接种法进行接种。不同的IBDV毒株分别按10倍倍比稀释至10-6,每个稀释度接种6个鸡胚,每胚接种0.1 mL。剔除24 h内死亡的鸡胚。以后12 h照胚2次,观察至 144 h,然后根据Reed-Muench计算方法计算每株野毒的囊毒悬液的ELD50。
对144 h内死亡或不死亡的鸡胚,分别取每个鸡胚的部分肝脏、肾脏和脾脏,与p H值7.4的PBS以1∶4比例混合研磨,离心取上清液,采用鸡传染性囊病快速诊断试纸条进行测试是否有IBDV感染,根据Reed-Muench来计算其EID50。传染性囊病快速诊断试纸条由河南省农业科学院生物技术研究所提供。
1.5 血清中抗体滴度的检测 采集血清样品,用Idexx公司提供的IBDV抗体检测试剂盒进行测定。
1.6 统计学分析所有数据用Student′s t分析。
2 结果
2.1 不同IBDV毒株的ELD50和EID50的测定结果4个传染性囊病野毒株均可在SPF鸡胚上复制并使鸡胚致死,但ELD50和EID50呈现一定程度的差异,结果见表1。

表1 4个IBDV野毒株腔上囊悬液中病毒含量
2.2 不同IBDV毒株人工感染SPF鸡后对体重的影响 所有毒株人工感染SPF鸡后,与对照组相比,均造成生长性能下降,而且随着感染日龄的增长,体重下降更加明显。如SD060617株人工感染后7 d,与对照组相比,分别为298.3±40.2(8)vs 324.2±27.6(6),差异不显著(P>0.05);人工感染后14 d,分别为 456.4±62.3(8)vs 593.3±44.9(6),差异显著(P<0.05)(表略)。
2.3 不同毒株对5周龄SPF鸡的致病性 结果见表2。4个IBDV毒株对5周龄SPF鸡的易感性不同,但都能引起腔上囊和胸腺不同程度的萎缩。SD070101、SD080101与SD080102等3株IBDV分别以3 000个 EID50人工感染 5周龄 SPF鸡,造成的死亡率在10%~20%之间;而SD060617株无致死率,但同样造成中枢免疫器官的显著萎缩。
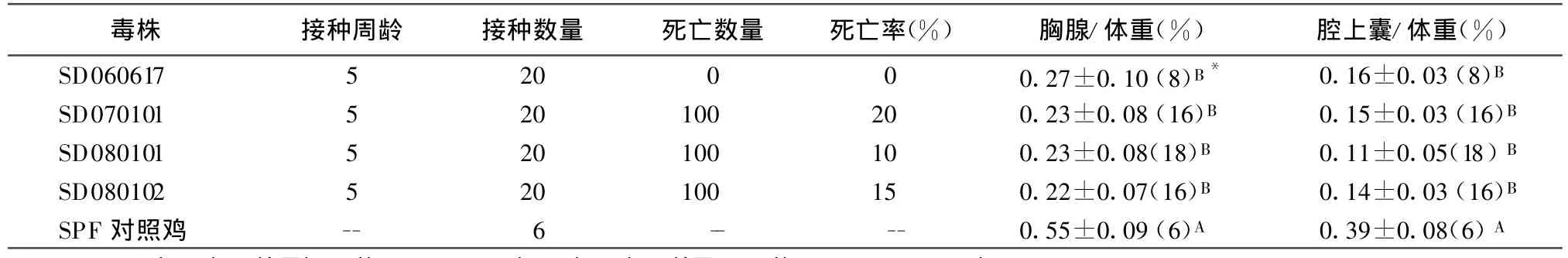
表2 不同毒力的IBDV毒株在同一批次5周龄SPF鸡上的致病性
2.4 SD060617株人工感染SPF鸡后7 d、14 d对胸腺、腔上囊的抑制作用 结果见表2、表3。感染后7d,与对照组相比,腔上囊与胸腺指数分别为0.16±0.032(8)vs 0.39±0.08(6)、0.27±0.10(8)vs 0.55±0.09(6),差异极显著(P<0.01);感染后14 d,腔上囊、胸腺指数分别为0.09±0.02(11)vs 0.42±0.07(6)、0.52±0.13(11)vs 0.81±0.09(6),差异极显著(P<0.01)。
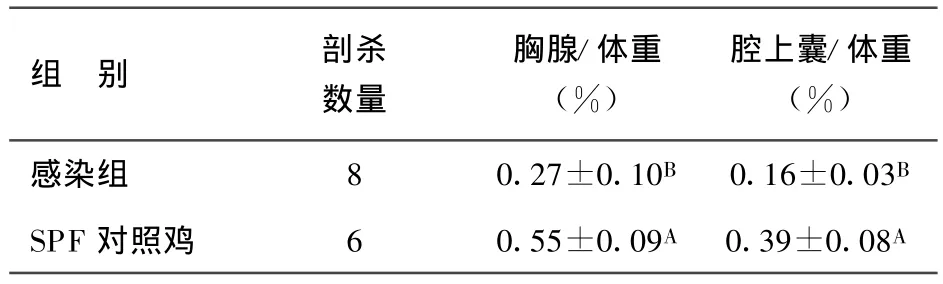
表2 SD060617株感染后7 d对中枢免疫器官的抑制作用
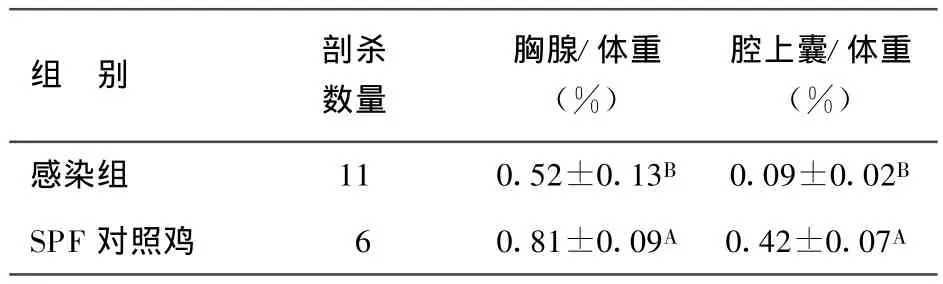
表3 SD060617株感染后14 d对中枢免疫器官的抑制作用
2.5 SD060617株人工感染5周龄SPF鸡后抗体滴度 对SD060617株人工感染SPF鸡4 d、7 d、10 d、13 d的血清抗体进行了检测,结果表明,人工接种SPF鸡后7 d,所有鸡只均产生抗IBDV的抗体,接种后13 d内抗体滴度逐渐升高,表明该毒株具有很好的免疫原性。
3 讨论
本试验针对2006~2008年间从山东地区采集表现出IBD临床症状的病鸡病料,分离鉴定4个野毒株,并在5周龄SPF鸡比较了其致病性变异。结果显示,以3 000个EID50人工感染5周龄SPF鸡,SD070101、SD080101与SD080102等3个IBDV株造成的死亡率分别为20%(4/20)、10%(2/20)、15%(3/20),而SD060617株无致死率为0%(0/20),但同样造成中枢免疫器官的极显著萎缩(P<0.01)。
对SD060617株人工感染SPF鸡后4 d、7 d、10 d,13 d的血清抗体的检测结果表明,人工接种SPF鸡后7 d开始,所有鸡只均产生抗IBDV抗体,表明该毒株具有很好的免疫原性;对感染后7 d、14 d的中枢免疫器官指数比较发现,该毒株在鸡群中可持续引起鸡中枢免疫器官的萎缩,虽无鸡只死亡,但随着感染时间的延长,免疫器官受到的损伤更加严重。这表明,SD060617株不是强毒株(在其纯化3代的过程中也无1只接种鸡死亡),而5周龄SPF鸡人工感染7 d后即产生IBDV抗体又表明该毒株已诱发了相应的免疫力,是否可以进一步致弱成为疫苗株有待于研究。
本研究表明,强毒株仍然为2006~2008年的主要流行毒株,其在流行病学中所占的比例没有发现明显变化。
[1] Brown M D,Skinner M A.Coding sequences of both genome segments of a European“very virulent” infectious bursal disease virus[J].Virus Res,1996,40:1-5.
[2] 李德山,武志强,陈冠春,等.鸡传染性法氏囊病超强毒毒株的分离和初步鉴定[J].中国畜禽传染病,1991,6:3-6.
[3] 曹永长,毕英佐,梁志清,等.超强传染性法氏囊病毒毒株宿主保护抗原的分子特征[J].中国兽医学报,1998,18(6):521-526.
[4] 崔治中,孙淑红,单忠芳,等.鸡传染性法氏囊病超强毒株GX8/99株的致病性[J].病毒学报,2002,18(6):162-166.
[5] 孙淑红,崔治中,金文杰.鸡传染性法氏囊病病毒 12个野毒株的毒力比较[J].中国兽医学报,2002,22(6):539-540.
[6] 孙淑红,崔治中,金文杰,等.1997~2001年间31个不同传染性法氏囊病病毒分离株的致病性研究[J].中国预防兽医学报,2004,26(2):121-126.