间接免疫荧光抗体法在APP疫苗保护效果评价中的初步应用
邵美丽,刘思国
(1.中国农业科学院哈尔滨兽医研究所,黑龙江哈尔滨150001;2.东北农业大学食品学院,黑龙江哈尔滨150030)
猪传染性胸膜肺炎(PCP)是由胸膜肺炎放线杆菌(APP)引起的一种以肺的急性出血、坏死和慢性纤维素性胸膜肺炎为主要特征的高度接触性呼吸道传染病。该病可致各年龄段的猪只发生急性和慢性感染,最高死亡率可达 80%~100%[1]。自1957年首次报道本病以来,本病几乎遍及世界所有养猪国家,且流行日趋严重,已成为世界性规模化养猪的重要疫病之一[2]。因此,研发高效、安全的APP疫苗成为预防和控制本病蔓延的根本。而在研发疫苗的保护效果评价方面,大多以动物的存活率、抗体的产生情况、脏器的损伤情况为评价指标[3-5]。但这些指标均不能直接反映疫苗对试验动物靶器官抗原的清除情况,也不能直接体现靶器官抗原的分布情况。故本课题组采用间接免疫荧光抗体法对免疫攻毒后小鼠靶器官-肺脏中的APP抗原进行了定位,比较了灭活疫苗和重组亚单位疫苗对小鼠肺脏中APP抗原的清除能力。同时与各组小鼠的存活率及其肺脏的病理学变化进行相关性比较。该方法的应用不仅为跟踪定位 APP抗原在动物体内的分布奠定基础,同时为更加直接、深入评价疫苗的保护效果提供新的思路。
1 材料与方法
1.1 菌株 APP1型72-1株由中国农业科学院哈尔滨兽医研究所细菌病研究室提供。
1.2 实验动物 7周龄雄性BALB/c小鼠,购自哈尔滨医科大学第二医院。
1.3 抗体 辣根过氧化物酶(HRP)标记的山羊抗兔IgG购自Sigma公司,兔抗APP1型阳性血清由中国农业科学院哈尔滨兽医研究所细菌病研究室提供。
1.4 疫苗 APP1型灭活疫苗和重组亚单位疫苗(重组蛋白rApx I+rApxⅡ+rApx III+rOMP)均由中国农业科学院哈尔滨兽医研究所细菌病研究室自行制备。
1.5 免疫攻毒及样品采集 将小鼠分成对照组、灭活疫苗组和重组亚单位疫苗组,背部皮下多点注射,每2周免疫1次,共3次。3免1周后,采用5LD50剂量,通过滴鼻攻 APP1型菌。攻毒5 d后,将存活小鼠剖杀,分离肺脏,备用。
1.6 间接免疫荧光抗体法定位肺脏中 APP抗原 用冰冻切片机将冰冻好的肺脏组织切成4μm厚的薄片,并将其粘附于载玻片上。待其自然干燥。滴加预冷的丙酮固定5 min。用0.01 mol/L p H值7.4 PBS洗涤3次,自然干燥。滴加兔抗 APP1型菌的阳性血清(1∶40稀释),同时以未免疫小鼠的血清作阴性对照。玻片置于湿盒中,37℃孵育45 min。用0.01 mol/L p H 值7.4 PBS冲洗后,在装有0.01 mol/L p H值7.2 PBS液的3个缸内依次浸泡,每个缸浸泡5 min,期间不时振荡几次。玻片从玻缸取出后,用滤纸吸干,滴加FITC标记山羊抗兔IgG抗体(1∶100稀释,且含0.01%伊文思蓝)。将玻片置于湿盒中,37℃孵育45 min,洗涤3次。晾干后,用碳酸甘油封片,于荧光显微镜下观察。
1.7 肺脏的病理组织切片的制备 将小鼠的肺脏,经10%缓冲液福尔马林固定后,常规石蜡包埋、切片,苏木精-伊红染色,制备病理组织切片[6]。
2 结果
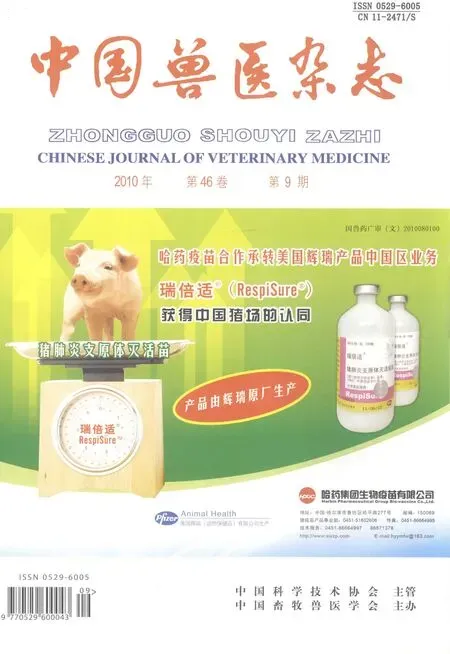
2.1 免疫攻毒后各组小鼠肺脏中 APP抗原的分布情况 荧光检测显示,对照组小鼠攻毒后,肺泡及其间质内呈现闪亮荧光团,且团块较大、数量较多。灭活苗组也有荧光团出现,但亮度、大小明显小于对照组,数量也明显少于对照组。重组亚单位疫苗组则无明显荧光团出现,只见微弱的散在的荧光点,具体见表1、中插彩版图1。
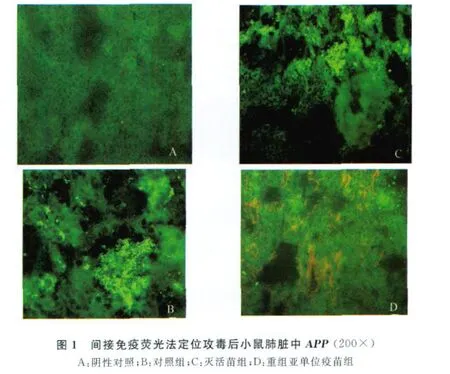

表1 间接免疫荧光检测结果
2.2 免疫攻毒后各组小鼠的存活情况 免疫攻毒后,对照组小鼠全部死亡。灭活疫苗组存活率为60%(6/10)。重组亚单位疫苗组存活率为90%(9/10)。
2.3 免疫攻毒后各组小鼠肺脏的病理学变化情况 剖检显示,对照组小鼠肺脏颜色发黑,且有严重出血、坏死,损伤面积达90%以上。灭活疫苗组小鼠肺脏有中度出血、坏死,损伤面积达25%~35%。重组亚单位疫苗组小鼠肺脏无明显病变(见中插彩版图2)。
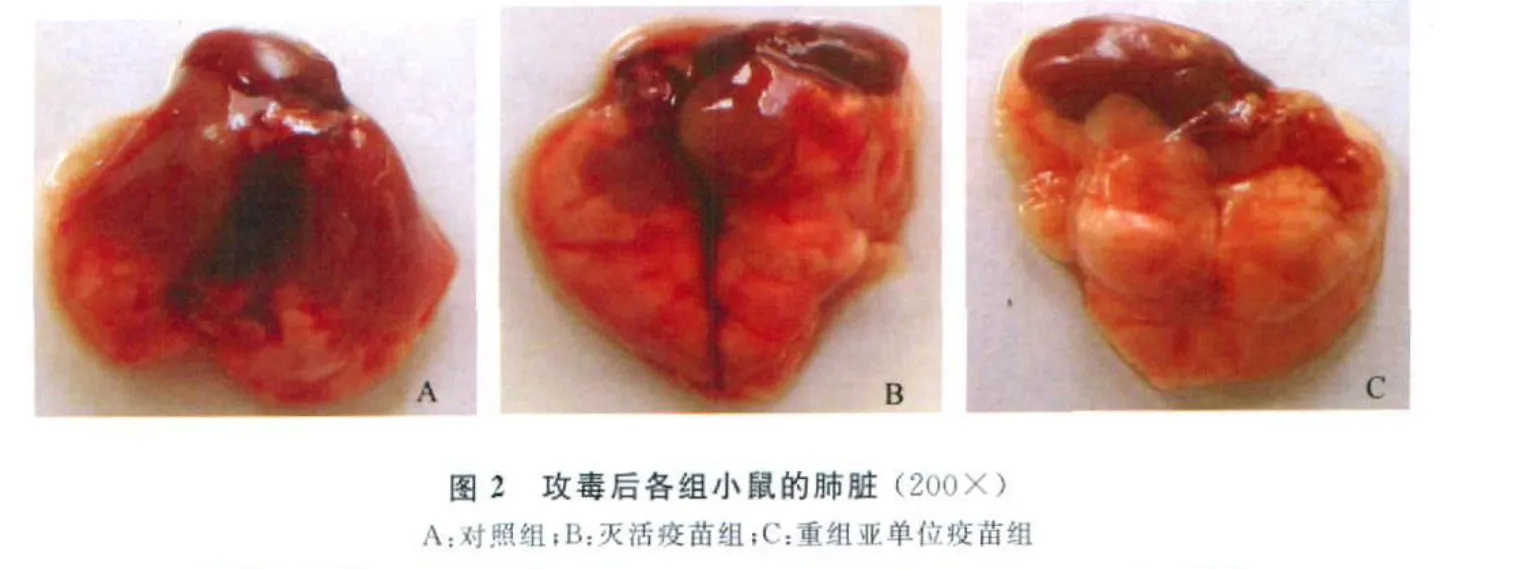
病理组织学观察发现,对照组小鼠肺脏有大量炎性细胞浸润,出血严重,肺泡内浆液性、纤维素性渗出且伴有大量脱落的肺泡上皮细胞,肺泡膈细胞变性、坏死、核浓缩,大部分肺泡崩解而造成实变。灭活疫苗组有中度出血,气管周围有炎性细胞、灶状浸润。肺泡浆液性、纤维素性渗出、炎性细胞浸润,且部分肺泡裂解,形成实变。重组亚单位疫苗组无明显病变,只有血管周围有轻度水肿,个别肺泡内有少量的浆液性渗出(见中插彩版图3)。
3 讨论
间接免疫荧光抗体法是免疫荧光技术中的一种。该方法通过荧光素标记二抗的结合,将信号进行放大,在一定程度上提高了检测的灵敏度。因其直观性强和操作简便成为实验室常用的细菌、病毒快速检测及临床疾病的快速诊断的手段。不仅如此,由于其能够直观地应用荧光显微镜观察到抗原在组织器官内细胞水平的确切分布和定位,也成为研究病原致病机理的有效手段[7-9]。也正是基于这个原理,本研究尝试将间接免疫荧光抗体法定位组织器官内的抗原与疫苗的保护效果结合起来,这不仅为间接免疫荧光抗体法的更广泛应用提供依据,同时也为评价疫苗的保护效果提供新的思路。
本研究采用间接免疫荧光法定位了免疫攻毒后的各组小鼠肺脏中的APP。结果显示,灭活疫苗组和重组亚单位疫苗组小鼠肺脏中荧光强度、数量均明显弱于对照组。重组亚单位疫苗组的荧光强度又明显弱于灭活疫苗组。这说明灭活疫苗和重组亚单位疫苗均对APP抗原起到了一定的清除和中和作用,且重组亚单位疫苗组对APP抗原的清除和中和能力最强。因此初步判定,重组亚单位疫苗的保护效果优于灭活疫苗组。将该判定结果与各组小鼠的存活率及其肺脏的病理学损伤进行相关性比较,发现它们三者具有一致性,即重组亚单位疫苗组和灭活疫苗组小鼠的存活率及其肺脏的病理学损伤均弱于对照组,且重组亚单位疫苗组小鼠的存活率及其肺脏的病理学损伤又明显弱于灭活疫苗组。因此我们认为,通过间接免疫荧光定位法攻毒后小鼠肺脏中的APP抗原作为疫苗保护效果的一种评价手段是可行的。
[1] 张立昌.猪传染性胸膜肺炎研究进展[J].养猪,2001(1):40-42.
[2] 陈小玲,杨旭夫,朱士盛.猪传染性胸膜肺炎的流行现状和防制措施[J].中国兽医杂志,2001,37(7):33-35.
[3] Fenwick B W,Henry S.Porcine pleuropneumonia[J].J Am Vet Med Assoc,1994,204(9):1334-1340.
[4] Hensel A,Huter V,Katinger A,etal.Intramuscular immunization with genetically inactivated(ghosts)Actinobacillus pleuropeneumoniae serotype 9 protects pigs against homologous aerosol challenge and prevents carrier state[J].Vaccine,2000,18(26):2945-2955.
[5] van DBH,Frey J.Interference of outer membrane protein Pal A with protective immunity against Actinobacillus pleuropneumoniae infections in vaccinated pigs[J].Vaccine,2003,21(25~26):3601-3607.
[6] 陈兴若,陶祥洛.病理切片制备技术[M].北京:人民卫生出版社,1995.
[7] 张舍郁,程安春,汪铭书,等.间接免疫荧光检测石蜡切片中鸭肿头出血症病毒及抗原定位方法的初步建立[J].中国农业科学,2008,41(3):868-874.
[8] 程安春,韩晓英,朱德康,等.间接免疫荧光染色检测石蜡切片中的鸭病毒性肠炎病毒和抗原定位[J].中国兽医学报,2008,28(8):871-875.
[9] 刘思国,尹训南,李广兴,等.间接免疫荧光抗体法对鸡传染性支气管炎病毒进行抗原定位[J].中国预防兽医学报,2000,22(9):82-85.