雷公藤多苷纳米乳体外肝肾的细胞毒性
何 欣,赵兴华,欧阳五庆
(1.河北农业大学中兽医学院中兽医医药系,河北定州 073000;2.西北农林科技大学动物医学学院细胞生物学教研室,陕西杨凌 712100)
雷公藤(Tripterygium wilfordii Hook f.)系卫矛科雷公藤属植物,最早收载于《神农本草经》,味苦、辛、性凉,大毒,归肝肾经。具有祛风除湿、活血通络、消肿止痛和杀虫解毒等功效[1]。雷公藤多苷由雷公藤的根(去皮)经粉碎、提取和精制而成,难溶于水,具有显著的抗炎和免疫抑制作用,临床上主要用于治疗类风湿性关节炎、红斑狼疮、慢性肾炎和皮肤病等,但在使用过程中对肝脏、肾脏、生殖系统和造血系统等毒性较大,这大大限制了其临床应用[2]。纳米乳是一种新型药物载体,可以增强药物的溶解性,显著提高药物的生物利用度,促进药物透皮吸收,提高药效,降低药物的毒性作用[3-4]。
本实验室已研究报道,雷公藤多苷纳米乳给药28 d,大鼠血清谷草转氨酶(glutamic oxaloacetic transaminase,GOT)和谷丙转氨酶(glutamic pyruvic transaminase,GPT)活性及尿素氮含量低于给予雷公藤多苷片,接近正常对照组水平;肝组织病理学观察亦显示雷公藤多苷纳米乳组肝组织病理变化较雷公藤多苷片组轻[5]。为进一步观察用纳米乳作为载体对雷公藤多苷进行包合是否可以降低雷公藤多苷的肝肾细胞毒性,本研究观察了雷公藤多苷纳米乳体外对大鼠原代肝、肾细胞的毒性作用,为扩大其临床应用提供实验依据。
1 材料与方法
1.1 动物、试剂和仪器
Sprague-Dawley(SD)乳大鼠,7日龄,清洁级,第四军医大学实验动物中心提供,动物许可证号:SCXK(军)2002-005。雷公藤多苷,纯度为98%,山东鲁南贝特制药有限公司;雷公藤多苷片,黄石飞云制药有限公司,批号:20060117;药用级聚氧乙烯氢化蓖麻油(ethoxylated hydrogenated castor oil RH-40,RH-40)、肉豆蔻酸异丙酯(iso-propyl myristate,IPM)和药用级聚氧乙烯蓖麻油(polyoxyethylene castor oil,EL-40),德国 BASF公司;聚山梨酯80(Tween-80)和药用石蜡油,天津南开化工厂;DMEM培养基和胶原Ⅱ型酶,Gibco公司;胎牛血清,杭州四季青生物工程材料有限公司,批号:071010,经56℃,30 min灭活后保存于 -20℃备用;胰酶消化液:碧云天生物技术研究所,C0201;二甲亚砜,Amresco公司。HITACHI高效液相色谱仪,日本日立电子公司;JEM1230透射电子显微镜,日本日立公司;马尔文激光粒度分析仪,英国马尔文有限公司;SW-CJ-1F型超净工作台,苏州净化设备有限公司;XDS-1B型倒置显微镜,重庆光学仪器厂;CKX41倒置显微镜,日本Olympus公司;Model550酶标仪,美国Bio-Rad公司;MCO-15AC型CO2培养箱,日本三洋公司;FA1104型电子天平,上海天平仪器厂;ILAB600型全自动系列生化分析仪,日本岛津公司。
1.2 雷公藤多苷纳米乳的制备及基本理化性质评价
高效液相色谱仪测定雷公藤多苷在4种油(IPM、大豆油、药用石蜡油和橄榄油)以及3种表面活性剂(EL-40,RH-40和Tween-80)中的溶解度,根据纳米乳的评价标准[6],利用序贯设计思想,采用滴定法绘制伪三元相图,确定出纳米乳的最佳组成,制备雷公藤多苷纳米乳。肉眼观察雷公藤多苷纳米乳及空白纳米乳的外观。根据文献[6]方法,用透射电镜观察纳米乳形态。马尔文粒度分析仪测定其粒径。
1.3 雷公藤多苷片的抽提和纯化
因为雷公藤多苷片剂中辅料太多,若直接加入细胞培养液中,会影响观察和实验结果。所以本研究对雷公藤多苷片进行了简单抽提纯化处理,并根据雷公藤多苷片中有效成分雷公藤多苷进行定量。
1.4 大鼠原代细胞的制备和培养
1.4.1 肝细胞
参考门静脉插管二步灌注法[7],因为考虑到本次实验中用的是乳大鼠,门静脉灌注难度较大,故选择心脏灌注,以除去肝脏中的血液。当看到肝脏呈土黄色时,停止灌注。仔细分离肝脏,PBS清洗2~3次并剪碎,边剪边用PBS洗涤,肝组织(约1 mm3)置于0.05%的胶原酶消化液中,37℃约15 min,消化结束后,用200目尼龙网过滤细胞悬液,去除上清。低速离心法(40×g,1~2 min)清洗细胞3次,重悬细胞,制成肝细胞悬液。经锥虫蓝染色测定,细胞存活率>90%。将肝细胞密度调整为(2~4)×108L-1,分别接种于细胞培养板及培养瓶中。
1.4.2 肾上皮细胞
采用胶原Ⅱ型酶和胰蛋白酶二步消化法[8]制备肾上皮细胞。小心剥离肾包膜,将肾组织剪碎并移入离心管中,加入足量Ⅱ型胶原酶,置于37℃水浴中消化,每隔5 min用吸管反复吹打消化液,直至组织块消化完全。经200目尼龙网过滤以去除残余的组织块,再以40×g,离心5 min,倾去上清。在沉淀中加入足量的胰蛋白酶消化液,37℃水浴消化5~10 min,加入含10%血清的培养液终止消化。将上述细胞悬液置于离心管中,103×g离心5 min,弃掉上清,在沉淀中加入培养液,用吸管将沉淀轻轻吹起。细胞计数后取适量细胞悬液,接种入培养瓶中,37℃,5%CO2的培养箱中培养。用倒置相差显微镜观察,发现24 h细胞从周边贴壁生长,48 h细胞铺满瓶底,细胞呈扁平不规则多角形,鹅卵石排列。
1.5 细胞存活率的测定
用含10%胎牛血清的培养液配成单个细胞悬液,以每孔2×108L-1接种于96孔培养板中,每孔体积为100μl。将培养板置37℃,5%CO2及饱和湿度条件下培养24 h。弃培养液,分别加入空白纳米乳溶液、雷公藤多苷片和雷公藤多苷纳米乳溶液各100 μl,药物终浓度为0(培养液对照),2,8,32,128 和 512 mg·L-1;同时设空白对照组,只加等体积的培养液,不加细胞,用于检测本底。雷公藤多苷纳米乳和雷公藤多苷片和空白纳米乳用含10%胎牛血清的培养液配制。在37℃,5%CO2及饱和湿度条件下,继续培养24 h。培养结束前4 h,每孔加入20 μl MTT 5 g·L-1溶液。终止培养,弃去孔内培养上清液。每孔加入DMSO 150μl,振荡10 min,使结晶物充分溶解。选择波长570 nm,在酶联免疫检测仪上测定各孔光吸收度(absorbance,A)值,计算细胞存活率:细胞存活率(%)=(A待测药物- A空白对照)/(A培养液对照- A空白对照)×100%。再用作图法和直线回归分析计算出待测药物抑制细胞存活的半数抑制浓度(IC50)。
1.6 细胞培养液中乳酸脱氢酶、谷草转氨酶和谷丙转氨酶活性的测定
用含10%胎牛血清的培养液配成单个细胞悬液,以每孔2×108L-1接种于96孔培养板,每孔100 μl;将培养板置37℃,5%CO2及饱和湿度条件下培养24 h;将含不同浓度(空白纳米乳溶液、雷公藤多苷片和雷公藤多苷纳米乳溶液各100μl,使药物终浓度为2,32和512 mg·L-1)待测药物的培养液分别加入肝细胞或肾细胞的培养板中,继续培养24 h后,收集培养液,离心取上清,用自动生化分析仪测定乳酸脱氢酶(lactate dehydrogenase,LDH),GOT 和GPT。
1.7 统计学分析
2 结果
2.1 雷公藤多苷纳米乳的理化性质
由雷公藤多苷在各种表面活性剂和油中的溶解度可知,雷公藤多苷在RH-40和IPM中的溶解度均较大,可以满足药物增溶的需要,且以RH-40为表面活性剂,IPM为油相时,纳米乳形成区域最大,形成的纳米乳最稳定,最终纳米乳的配方确定为RH-40∶IPM∶水,质量比为 27∶3.3∶69.7。
在油和表面活性剂的混合体系中加入经过研磨的雷公藤多苷原料药,制备的雷公藤多苷纳米乳呈棕黄色,澄清,透明,流动性良好。由透射电子显微镜观察显示纳米乳粒子大多数呈圆球形,分散性良好。马尔文激光粒度分析仪测定制备的雷公藤多苷纳米乳的平均粒径为23.6 nm,多分散性系数为0.124,表明纳米乳粒径的分布范围比较窄,粒径比较均匀。
2.2 雷公藤多苷纳米乳对乳大鼠原代培养肝细胞的毒性作用
由图1可以看出,空白纳米乳对大鼠原代肝细胞存活率无明显影响,雷公藤多苷纳米乳和雷公藤多苷片明显抑制原代肝细胞存活,雷公藤多苷纳米乳的 IC50为 128.8 mg·L-1,雷公藤多苷片的 IC50为48.6 mg·L-1。由表1可以看出,雷公藤多苷纳米乳组和雷公藤多苷片组细胞培养液中GPT,GOT和LDH 活性显著升高(P <0.05,P <0.01),所有浓度与空白纳米乳组相比差异均有统计学意义(P <0.05,P <0.01)。雷公藤多苷片2 和32 mg·L-1组的GPT,GOT和LDH活性高于对应浓度雷公藤多苷纳米乳组。表明雷公藤多苷纳米乳和雷公藤多苷片对体外培养肝细胞有毒性,且前者对肝细胞毒性强于后者。
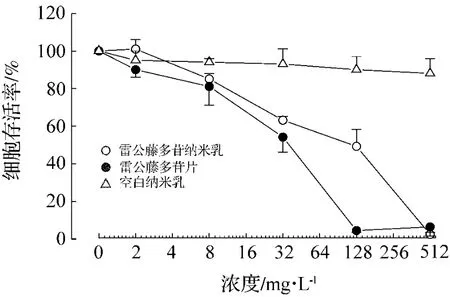
图1 雷公藤多苷纳米乳对大鼠肝细胞存活率的影响.药物体外作用大鼠肝细胞24 h.用MTT法测定细胞存活.细胞存活率(%)=(A待测药物-A空白对照)/(A培养液对照-A空白对照)×100%.±s,n=3.Fig.1 The effect of Tripterygium wilfordii glycoside nanoemulsion on primary cultured hepatic cells survival rate.
2.3 雷公藤多苷纳米乳对乳大鼠肾细胞的毒性作用
由图2可以看出,空白纳米乳对大鼠原代肾细胞存活率无明显影响,雷公藤多苷纳米乳和雷公藤多苷片明显抑制原代肾上皮细胞存活,雷公藤多苷纳米乳的 IC50为 61.7 mg·L-1,雷公藤多苷片的 IC50为19.5 mg·L-1。由表2可以看出,雷公藤多苷纳米乳组和雷公藤多苷片32和512 mg·L-1组细胞培养液中GOT和LDH活性明显高于空白纳米乳组,差异均有统计学意义(P<0.05),表明药物对肾细胞有毒性作用。雷公藤多苷片组的GOT和LDH活性高于相应浓度雷公藤多苷纳米乳组,表明雷公藤多苷纳米乳的肾上皮细胞毒性强于雷公藤多苷片。

表1 雷公藤多苷纳米乳对大鼠肝细胞培养液中谷草转氨酶(GOT),谷丙转氨酶(GPT)和乳酸脱氢酶(LDH)活性的影响Tab.1 Effect of Tripterygium wilfordii glycoside nanoemulsion on glutamicoxaloacetic transaminase(GOT),glutamicpyruvic transaminase(GPT)and lactate dehydrogenase(LDH)activities in primary cultured hepatic cells

图2 雷公藤多苷纳米乳对大鼠肾细胞存活率的影响.药物体外作用大鼠肝细胞24 h.用MTT法测定细胞存活.细胞存活率(%)=(A待测药物 -A空白对照)/(A培养液对照 -A空白对照)×100%.x¯±s,n=3.Fig.2 Effect of T.wilfordii glycoside nanoemulsion on primary cultured renal cells survival rate.

表2 雷公藤多苷纳米乳对大鼠肾细胞培养液中GOT和LDH活性的影响Tab.2 Effect of T.wilfordii glycoside nanoemulsion on GOT and LDH activities in primary cultured renal cells
3 讨论
雷公藤多苷所引起的急性肝损伤主要表现为似急性病毒性肝炎或无黄疸型肝炎,多数患者有单项GPT升高的症状,提示雷公藤所致肝损伤以肝实质细胞损伤为主[9]。GOT和GPT是目前临床上最常用的肝功能指标,主要分布在肝脏的肝细胞内。如果肝细胞坏死,GOT和GPT就会升高,其升高的程度与肝细胞受损的程度相一致,因此细胞活性越低,GOT和GPT在培养液中的含量越高。LDH是一种稳定的蛋白质,存在于正常细胞的胞质中,一旦细胞膜受损,LDH即被释放到细胞外。通过检测细胞培养上清中LDH的活性,可判断细胞受损的程度[8]。本研究发现,相同剂量时雷公藤多苷片作用下的肝细胞培养液中GOT,GPT和LDH的含量比雷公藤纳米乳作用下的要高,说明在相同剂量下,片剂对肝细胞的毒性更大。这一点由药物对肝细胞的IC50也可以得到证实,雷公藤多苷片对肝细胞的 IC50为48.6 mg·L-1,雷公藤多苷纳米乳对肝细胞的 IC50为128.8 mg·L-1,后者是前者的 2.65 倍。
雷公藤肾损害多为急性肾损害,呈现急性肾衰竭,尤其过量用药时发生率尤高[10]。本研究结果显示,雷公藤多苷片作用下的肾细胞培养液中这两种酶的含量比相同剂量下雷公藤多苷纳米乳组中的含量高,证明雷公藤多苷片的肾毒性较强。经计算,雷公藤多苷片对肾细胞的 IC50为19.5 mg·L-1,雷公藤多苷纳米乳对肝细胞的 IC50为61.7 mg·L-1,后者是前者的3.16倍。
本实验室前期观察大鼠体内毒性结果表明,雷公藤多苷纳米乳给药28 d血清GOT和GPT活性及尿素氮含量比雷公藤多苷片组低,与正常对照组无显著性差异;肝组织病理学观察显示,雷公藤多苷纳米乳组肝小叶放射状结构基本清晰,肝细胞稍有肿胀;肾小管细胞轻微肿胀,有的细胞脱落或者发生溶解;雷公藤多苷片组肝细胞索紊乱,放射状排列消失,细胞变形,胞浆有的呈现空泡状,肝细胞之间炎性细胞增多,肾小管上皮增厚,细胞肿胀、脱落,肾小管间质中有明显炎性细胞浸润;肾小球上皮细胞增生,甚至与囊壁发生粘连[5]。结合本研究体外肝、肾细胞毒性研究结果表明,雷公藤多苷纳米乳比雷公藤多苷片的肝肾细胞毒性小,用纳米乳对雷公藤多苷进行包合降低了其对肝脏和肾脏的毒性作用,这为扩大雷公藤多苷在临床上的应用奠定理论基础。
[1]李家明.从构效关系角度探讨中药雷公藤的药效和毒性的关系[J].中国中药杂志,2005,30(20):1638-1640.
[2]Mei Z,Li X,Wu Q,Hu S,Yang X.The research on the anti-inflammatory activity and hepatotoxicity of triptolide-loaded solid lipid nanoparticle[J].Pharmacol Res,2005,51(4):345-351.
[3]Lawrence MJ,Rees GD.Microemulsion-based media as novel drug delivery systems[J].Adv Drug Deliv Rev,2000,45(1):89-121.
[4]朱盛山.药物新剂型[M].北京:化学工业出版社,2003:320.
[5]何 欣,欧阳五庆,赵兴华,孙江才,阳卫超.纳米乳对雷公藤多苷增效减毒作用研究[J].浙江大学学报(农业与生命科学版),2008,34(3):261-265
[6]杨惊宇,严 冬,罗杰英,杨大坚,陈士林.新型药物剂型-微乳[J].中国医学工程,2005,13(4):378-381.
[7]张卓然.培养细胞学与细胞培养技术[M].上海:上海科学技术出版社,2004:68-70.
[8]顾 光,高 芃,支 媛,殷召雪,隋海霞,刘 珊,等.大鼠肾细胞分离制备及培养方法的比较[J].卫生研究,2005,34(5):574-576.
[9]窦建卫,雷 莹,王嗣岑.雷公藤毒性的研究现状[J].陕西中医,2006,27(4):485-487.
[10]王丽君,姜晓冬.雷公藤多甙片的不良反应[J].基层中药杂志,1998,12(4):52-54.

