重组人集成干扰素α对金黄地鼠胚胎和胎鼠的毒性
柴振海,杨 东,蔡永明,申秀萍,刘昌孝
(天津药物研究院天津市药代动力学与药效动力学国家重点实验室,天津 300193)
重组人集成干扰素 α(recombinant human consensus interferonα,rh-CINF)是深圳九先生物工程有限公司研制的具有自主知识产权的一种非天然存在的重组人Ⅰ型干扰素,由166个氨基酸组成,其生物活性远高于传统干扰素,临床用于治疗丙型肝炎[1-2]。在结构上rh-CINF与Amgen公司的干扰素制剂Infergen(干复津)基本相同,都是通过对多种人源干扰素α亚型氨基酸顺序的扫描分析,并通过在氨基酸顺序的每一位置指定出现频率最高的氨基酸而衍生出来的集成干扰素[3]。rh-CINF和Infergen的唯一区别仅为一个氨基酸的差异,即第158位氨基酸位点由亮氨酸改为缬氨酸[1],这也是中国人干扰素与美国人干扰素唯一的一个氨基酸差异。因此,rh-CINF具有中国人自己的遗传特性,更适合中国人使用,在我国开发该药具有更好的临床应用前景。为了评价其安全性,本实验室根据ICH S5A对生殖毒性的技术要求和ICH S6对生物技术药物临床前安全性评价的一般要求,选用rh-CINF的敏感动物金黄地鼠作为实验动物模型,对rh-CINF的胚胎-胎鼠毒性进行研究,以为临床安全用药提供参考。
1 材料与方法
1.1 药物、试剂和仪器
rh-CINF,无色透明液体,含量 25 mg·L-1,批号:20020602,由深圳九先生物工程有限公司提供。4~8℃冰箱保存。实验时用赋形剂配成25,7.5和1.25 mg·L-1,分 别 用 于 rh-CINF 100,30 和 5 μg·kg-1剂量组。赋形剂为无色透明液体,组成:PB 20 mmol·L-1,NaCl 0.1 mol·L-1,pH 6.8 ~ 7.2,批号:20020301,由深圳九先生物工程有限公司提供。4~8℃冰箱保存。T2000型电子天平,美国双杰兄弟(集团)有限公司常熟双杰测试仪器厂;PL203电子天平,梅特勒托利多仪器(上海)有限公司;游标卡尺,陕西航空硬质合金工具厂;实体显微镜,日本Olympus株式会社。
1.2 动物
妊娠第0天金黄地鼠,80只,体重92~146 g,由北京生物制品研究所动物室提供,动物合格证号:0025104,动物许可证号:京动许字(1999)第012号。饲养设施为天津药物研究院屏障系统(实验动物使用许可证号:津实设施准字012号),观察室温度20~25℃,光照为12 h明、12 h暗;饲料为金黄地鼠专用饲料,并每日补充新鲜的大麦芽,饮用水为生活用自来水。
1.3 剂量设计
本实验设3个药物组和1个赋形剂对照组。rh-CINF临床拟用剂量为9~15μg(日用量),按体表面积折算成金黄地鼠(按平均体重118 g计)的等效剂量为1.02 ~1.70 μg·kg-1。本实验分别选用rh-CINF临床拟用最高剂量的59,18和3倍即100,30 和5 μg·kg-1作为 rh-CINF 实验剂量。
1.4 动物分组与给药
妊娠第0天金黄地鼠80只,随机分成赋形剂对照组,rh-CINF 5,30和100 μg·kg-1组,每组20只。在妊娠第5~14天sc给予赋形剂或rh-CINF,每天1次,给药体积为每100 g体重0.4 ml。
1.5 动物一般情况观察[4]
妊娠动物在给药前每日观察1次一般情况。在给药期间每日观察药后2 h内的一般毒性反应。若发现毒性反应,则增加观察时间或观察次数。一般观察的内容包括外观体征、行为活动、腺体分泌、呼吸和阴道出血等。在妊娠的第0天和第5~15天称重。
1.6 解剖检查
1.6.1 母鼠
母鼠在妊娠第15天进行解剖检查。检查内容包括腹腔、胸腔和颅腔有无积液,主要器官有无粘连,各器官的色泽、大小、形状和表面是否正常。发现异常脏器时固定保存,并同时保存足够的对照组相应器官,供必要时进行组织病理学检查。
1.6.2 胚胎
检查羊水的颜色和量及胎盘的颜色和大小,然后检查着床点数及活胎、死胎和吸收胎数量。
1.6.3 黄体计数
计数双侧卵巢上的黄体数。
1.6.4 胎鼠
胎鼠称重并进行外观检查和身长、尾长测量。各窝活胎一半制成骨骼标本,一半制成内脏标本,并进行内脏和骨骼畸形检查。
1.7 统计学分析
2 结果
2.1 rh-CINF对母鼠一般情况的影响
rh-CINF 100,30 和 5 μg·kg-1组及赋形剂对照组母鼠在妊娠期间(包括给药期间)被毛光泽,精神状态、行为活动和呼吸均正常,未发现分泌物增多、腹泻、阴道出血和流产等现象,但 rh-CINF 100 μg·kg-1组孕鼠在给药期间体重增长显著减缓(P <0.01),rh-CINF 30 μg·kg-1组孕鼠在给药期间体重增长亦有减缓的趋势(表1)。
2.2 rh-CINF对孕鼠生育能力的影响
在金黄地鼠受精卵着床至生产前sc给予rh-CINF,rh-CINF 100,30 和 5 μg·kg-1组孕鼠的黄体数、植入数、植入前丢失率及性别比例与赋形剂对照组比较无统计学差异(表2,表3)。rh-CINF5 μg·kg-1组孕鼠吸收胎数、死胎数、活胎数及植入后丢失率与赋形剂对照组比较无统计学差异;rh-CINF 30μg·kg-1组孕鼠活胎数减少、植入后丢失率增加,与赋形剂对照组比较差异显著(P<0.05);rh-CINF 100 μg·kg-1组孕鼠活胎数显著减少,吸收胎数(窝)、死胎数及植入后丢失率显著增加,与赋形剂对照组比较有显著差异(P<0.01)(表3)。表明rh-CINF具有一定的胚胎毒性。
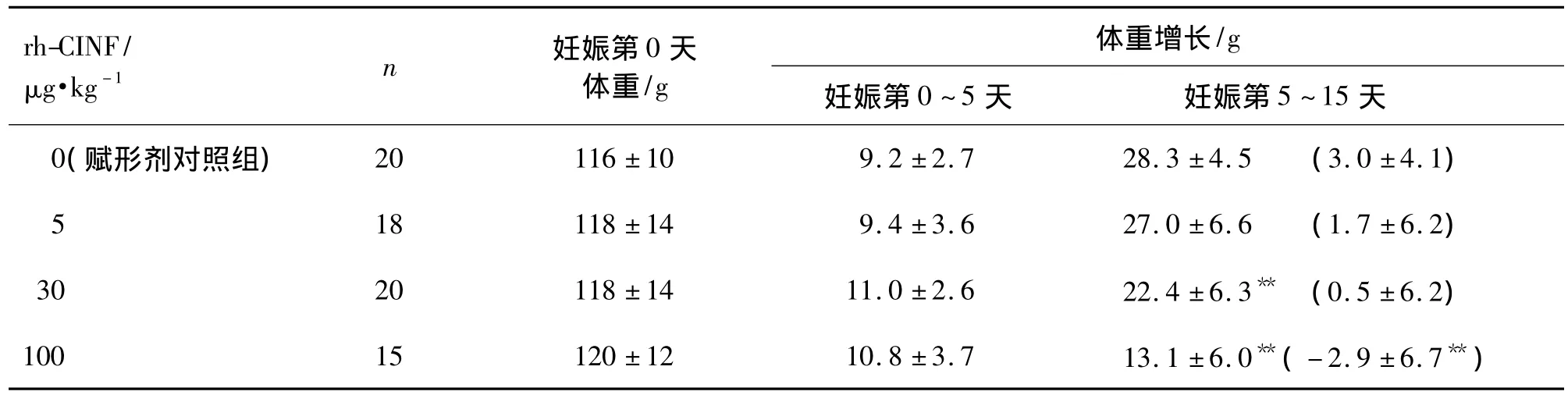
表1 重组人集成干扰素α(rh-CINF)对妊娠金黄地鼠体重的影响Tab.1 Effects of recombinant human consensus interferonα(rh-CINF)on the body weight gain of golden Syrian hamsters

表2 rh-CINF对金黄地鼠黄体和植入的影响Tab.2 Effects of rh-CINF on the corpora lutea and implantation in golden Syrian hamsters

表3 rh-CINF对金黄地鼠胚胎的影响Tab.3 Effects of rh-CINF on the conceptus in golden Syrian hamsters
2.3 rh-CINF对胎鼠生长发育的影响
rh-CINF 100 μg·kg-1组胎鼠身长较短、平均胎鼠体重较轻,与赋形剂对照组比较有显著差异(P <0.01);rh-CINF 30 和 5 μg·kg-1组胎鼠身长、尾长以及平均胎鼠体重及rh-CINF 100μg·kg-1组胎鼠尾长与赋形剂对照组比较无统计学差异。表明rh-CINF 100 μg·kg-1对胎鼠的生长发育有一定影响(表4)。
2.4 rh-CINF的致畸作用
2.4.1 rh-CINF 对胎鼠外观的影响
在金黄地鼠妊娠第15天解剖后对胎鼠的外观检查中发现,各剂量组中均见个别胎鼠皮下出血,但给药组皮下出血胎仔数及皮下出血窝数与赋形剂对照组比较无统计学差异。除胎鼠皮下出血外,在rh-CINF 100,30 和5 μg·kg-1组和赋形剂对照组中未发现外观畸形或变异胎鼠(表5)。
2.4.2 rh-CINF 对胎鼠骨骼的影响
表 6检查结果显示,rh-CINF 100,30和 5 μg·kg-1组颅骨、颈椎、胸椎、腰椎、骶椎和四肢骨均发育良好,上枕骨骨化程度均为0级;检查中发现的主要异常有胸骨发育不全、缺失和错节及14肋,但rh-CINF 100,30和5 μg·kg-1组中胸骨发育不全、胸骨缺失、胸骨错节及长有14肋的胎仔数与赋形剂对照组比较统计学差异均不显著。

表4 rh-CINF对金黄地鼠胎鼠发育的影响Tab.4 Effects of rh-CINF on the fetus development in golden Syrian hamsters

表5 rh-CINF对金黄地鼠胎鼠外观的影响Tab.5 Effects of rh-CINF on the fetus externals in golden Syrian hamsters

表6 rh-CINF对金黄地鼠胎鼠骨骼发育的影响Tab.6 Effects of rh-CINF on the fetus skeleton system in golden Syrian hamsters
2.4.3 rh-CINF对胎鼠内脏的影响
胎鼠的内脏检查采用徒手切片法,通过对不同切面的观察,对胎鼠的眼、鼻、腭、舌、脑、气管、食管、脊髓、胸腺、肺、纵隔、心、胃、肠、肾、肾上腺及生殖器官等进行了系统的检查。检查结果显示,rh-CINF 100,30和5μg·kg-1和赋形剂对照组中均未见任何内脏异常、错位或畸形胎鼠。
3 讨论
传统的小分子药物一般都没有种属特异性,在进行生殖发育毒性评价时一般选用啮齿类动物大鼠和非啮齿类动物兔作为实验动物模型。有些生物技术药物也不具有种属特异性,可以和小分子药物一样,使用大鼠和兔作为实验模型进行生殖发育毒性评价,但大多数生物技术药物都具有种属特异性,这时就必须根据具体药物选择合适的实验动物模型。实验动物模型应该选择能够表达其生物学活性或能够发挥药理学效应的动物种属。rh-CINF作为生物技术药物,具有明显的种属特异性,其安全性评价用实验动物模型的选择亦应遵循上述原则。据文献报道[5],利用多个种属的动物细胞系(大鼠、小鼠、豚鼠、兔、猫、狗和猴)进行的体外抗病毒细胞病理效应测定结果显示,Infergen只在来自于恒河猴和金黄地鼠的细胞系中才具有病毒保护作用。Infergen的体内抗病毒研究也都是用猴和金黄地鼠进行的,且都显示了明显的抗病毒活性[5-6]。另外Infergen的生殖毒性研究也是使用恒河猴和金黄地鼠进行的[5]。因Infergen与笔者研究的rh-CINF同属于重组人集成干扰素α,具有几乎相同的结构和相同的生物学活性,因此rh-CINF生殖毒性研究的实验动物模型选用猴和金黄地鼠比较合适。
Ⅰ型干扰素在猕猴中具有高度免疫原性,妊娠猕猴在给予人源干扰素2周后即产生中和抗体[7]。由于猕猴的胚胎-胎鼠毒性实验的给药时间均在30 d或更长时间,这样就不可避免地会在给药后期出现降低药物在母体的暴露水平和消除药理学效应的情况。因此,若使用猴进行胚胎-胎鼠毒性实验,还必须调整给药方案以分别测定妊娠敏感期不同阶段给药后药物对胚胎-胎鼠的影响。由于金黄地鼠妊娠周期短,给药期间不存在免疫原性问题,因此金黄地鼠是rh-CINF胚胎-胎鼠毒性实验的一种理想和经济的动物模型。
使用妊娠金黄地鼠进行的rh-CINF胚胎-胎鼠毒性实验结果表明,妊娠金黄地鼠sc给予rh-CINF 100μg·kg-1可抑制孕鼠的体重增长,并对孕鼠的胚胎有致死作用,对存活胎鼠的生长发育包括胎仔身长和体重也均有明显影响;妊娠金黄地鼠sc给予rh-CINF 30 μg·kg-1可抑制孕鼠体重增长,并对孕鼠胚胎有致死作用,但作用弱于高剂量组,且对存活胎鼠的生长发育没有影响。妊娠金黄地鼠sc给予rh-CINF 5 μg·kg-1对孕鼠生长、胚胎存活及胎鼠发育均没有影响。在对胎鼠的外观、内脏和骨骼检查中均未见与药物有关的胎鼠变异或畸形。该实验结果与FDA文件中描述的Infergen的生殖毒性实验结果相似。5μg·kg-1可作为rh-CINF对孕鼠和胚胎-胎鼠的无可见不良反应剂量。
干扰素类生物工程药物一般都具有抗增殖作用[8],这与本实验中rh-CINF引起金黄地鼠母体体重增长缓慢是相一致的,但rh-CINF的致胚胎死亡作用和对胚胎生长的影响是否与干扰素类药物的抗增殖作用有关,以及rh-CINF对胚胎的影响是母体介导的毒性反应,还是药物穿过胎盘屏障直接作用于胚胎,这些问题都需要进一步的研究。
胚胎致死作用和生长发育迟缓是生殖毒性的两个重要指标。虽然在受精卵着床至生产前妊娠金黄地鼠sc给予rh-CINF 5μg·kg-1(相当于人用最大剂量的3倍)对金黄地鼠母体和胚胎均没有明显的影响,但更高剂量时已出现明显的母体毒性、胚胎致死作用和胎鼠生长迟缓。由于物种差异和动物实验结果外推至人类仍存在很多不确定性,因此,在没有获得足够的临床证据之前,rh-CINF和Infergen一样,应归在妊娠用药分级目录中的C级,即妊娠或准备怀孕的妇女在使用前应被告知使用rh-CINF可能对胎儿造成的危害,并建议妇女在使用rh-CINF期间采取避孕措施。
[1]徐 冰,王淑琴,李玉环,陶佩珍.重组集成干扰素α体外抗病毒的药效学研究[J].山东大学学报(医学版),2006,44(8):831-833,839.
[2]Yasuda S,Miyata K.Interferon alfacon-1(Advaferon):a novel synthetic interferon for the treatment of hepatitis C,its pharmacological and clinical profile[J].Nippon Yakurigaku Zasshi,2002,120(6):421-426.
[3]Blatt LM, Davis JM, Klein SB, Taylor MW. The biologic activity and molecular characterization of a novel synthetic interferon-alpha species,consensus interferon[J].J Interferon Cytokine Res,1996,16(7):489-499.
[4]袁伯俊,王治乔.生殖毒性试验[M]∥袁伯俊,王治乔.新药临床前安全性评价与实践.北京:军事医学科学出版社,1997:133-134.
[5]Fish EN, Banerjee K, Levine HL, Stebbing N.Antiherpetic effects of a human alpha interferon analog,IFN-alpha Con1,in hamsters[J].Antimicrob Agents Chemother,1986,30(1):52-56.
[6]Gowen BB,Barnard DL,Smee DF,Wong MH,Pace AM,Jung KH,et al.Interferon alfacon-1 protects hamsters from lethal pichinde virus infection[J].Antimicrob Agents Chemother,2005,49(6):2378-2386.
[7]Martin PL.Reproductive toxicity testing for biopharmaceuticals[M]∥Cavagnaro JA.Preclinical Safety Evaluation for Biopharmaceuticals.New York:John Wiley&Sons,Inc.,2008:361.
[8]Gad SC,Drug Safety Evaluation[M].New York:John Wiley & Sons,Inc.,2002:416-417.

