环维黄杨星D对大鼠的肾脏毒性
梁晓雯,周 静,黄 艳,于民权,程 旸,方泰惠,金 路,许 立
(南京中医药大学1.药学院江苏省中药药效与安全性评价重点实验室,2.基础医学院组织胚胎学教研室,江苏南京 210029)
环维黄杨星D(cyclovirobuxine D,CVB-D)系从黄杨科植物小叶黄杨(Buxus microphylla Sieb.et Zucc.var.sinica Rehd.et Wils.)及其同属植物中提取的一种生物碱,为我国研制成功的治疗心脑血管疾病的新药,具有行气活血和通络止痛功能,主要用于治疗气滞血瘀所致的胸痹心痛、冠心病和心律失常。它对心血管系统具有强心,抗心绞痛和抗心律失常等作用[1-2]。对CVB-D的药理及药效报道较多,而对于其毒理学研究报道较少。
CVB-D较大剂量长期应用,无论是口服或静脉注射给药,均可对肝脏、心脏、肾脏等器官产生毒性作用,严重的可引起死亡[1,3]。近来研究发现,大鼠ip给予CVB-D 8 mg·kg-13个月,有3只动物给药期间出现精神萎靡、反应迟钝等毒性反应,且BUN明显升高;CVB-D 4和8 mg·kg-1组部分动物出现肾脏的远曲小管上皮细胞变性、坏死及蛋白管型等病理改变[4]。
本实验在前期研究的基础上,大鼠连续ip给予CVB-D 2个月,观察CVB-D致大鼠肾脏毒性的剂量和时间依赖性关系,并探讨其肾脏毒性的可逆性。
1 材料与方法
1.1 实验动物、药品、试剂与仪器
SD大鼠,清洁级,80~100 g,120只,雌雄各半;浙江省实验动物中心,许可证号:SCXK(浙)2003-001。实验前,大鼠给予适应性喂养1周。CVB-D:为白色粉末状结晶,南京小营药厂提供,纯度≥96%,批号:20050802。由于CVB-D难溶于PBS,故临用前用PBS配成所需浓度,加入微量冰乙酸(终浓度不超过0.1%),将CVB-D全部溶解,pH在6.5左右。尿素氮(blood urea nitrogen,BUN)测试盒、肌酐(creatinine,SCr)测试盒、N-乙酰-β-氨基葡萄糖苷酶(N-acetyl-β-D-glucosaminidase,NAG)酶测试盒:南京建成生物工程研究所;大鼠尿液β2微球蛋白(β2-microglobulin,β2-MG),免疫球蛋白 G(immunoglobulin G,IgG),视黄醇结合蛋白(retinol binding protein,RBP),微量白蛋白(microalbumin,mAlb)和转铁蛋白(transferrin,TRF)测试盒:美国ADL羊抗鼠β2-microglobulin ELISA测定试剂盒,Lot No.RT110371;大鼠血清Tamm Horsfall蛋白(Tamm Horsfall protein,THP)和 β2-MG测试盒:美国 ADL羊抗鼠β2-microglobulin ELISA测定试剂盒,Lot No.RT110371。AY120型电子天平:日本 Shimadzu公司;Vital-200全自动生化分析仪:荷兰威图科学仪器公司;全自动尿液分析仪:日本Sysmex公司;80-2型台式离心机:上海医疗器械有限公司手术器械厂。
1.2 动物分组和给药
大鼠雌雄分笼饲养,自由饮水,室温20~25℃,每天人工光照12 h,室内通风良好,实验室相对湿度为65%~70%。
SD大鼠120只,雌雄各半,随机分为4组,每组30只大鼠。正常对照组:PBS溶液(含0.1%的冰乙酸);CVB-D 2.5,5 和10 mg·kg-1,相当于人用量的25,50 和100 倍;给药体积为5 ml·kg-1。大鼠ip给予CVB-D,连续给药2个月,分别在首次给药后第1个月末和第2个月末每组取10只大鼠,雌雄各半,观察并检测各项指标。2个月后各组留10只大鼠,停药观察4周,做同样检查。
1.3 一般检查及血液、尿液生化指标测定
每天观察并记录动物的一般活动及精神状态;每隔2 d称量1次体重以及摄食量,观察体重与摄食量的动态变化。分别在第1个月末、第2个月末以及恢复期末,各组取10只大鼠,通过眼眶取血3 ml于促凝管中,分离血清,检测 BUN,SCr,THP,β2-MG;并且收集24 h尿液,测定NAG,IgG,RBP,mAlb,TRF和 THP。
1.4 组织病理学检查
第1个月和第2个月末以及恢复期分3批处死大鼠,对肾脏进行肉眼检查,称重,用4%甲醛溶液固定,常规石蜡包埋、切片,片厚4μm,HE染色,光学显微镜下观察。
1.5 统计学分析
2 结果
2.1 动物一般体征
大鼠ip给予CVB-D 2周后,体重出现增长缓慢现象。CVB-D 10 mg·kg-1组大鼠在给药4周后出现反应迟钝、精神不振、呼吸急促、体重增长缓慢的现象,其中有2只大鼠在给药6周后出现大便稀溏的现象,并有1只大鼠在给药5周后死亡。各组摄食量均在正常范围内。上述现象在恢复期得到改善,体重也出现明显增长的现象,精神状态也逐渐好转。
2.2 环维黄杨星D对大鼠血清中尿素氮、肌酐、β2微球蛋白和Tamm Horsfall蛋白的影响
如表1所示,CVB-D ip给予大鼠1个月后,CVB-D 10 mg·kg-1组大鼠血清中的BUN含量与正常对照组相比明显升高(P <0.01)。CVB-D 2.5,5和 10 mg·kg-1组的β2-MG含量均比正常对照组明显升高(P <0.01),CVB-D 5 和10 mg·kg-1组的 THP 含量比正常对照组明显降低(P<0.01)。给药2个月后,CVB-D 5和10 mg·kg-1组大鼠血清中β2-MG含量比正常对照组显著升高(P <0.05),CVB-D 5 mg·kg-1组大鼠血清中的BUN含量比正常对照组显著升高(P <0.05),CVB-D 10 mg·kg-1组大鼠血清中的 THP含量比正常对照组显著降低(P<0.05)。在恢复期内,CVB-D 5 mg·kg-1组大鼠血清中的 SCr含量比正常对照组明显升高(P<0.05)。
2.3 环维黄杨星D对大鼠尿酶及尿液中微量蛋白的影响
CVB-D ip给予大鼠1个月后,与正常对照组相比,CVB-D 10 mg·L-1组大鼠尿液中 NAG,TRF,β2-MG和IgG 含量显著升高(P <0.05),CVB-D 5和10 mg·kg-1组的尿液mAlb含量及RBP含量显著升高(P<0.05,P <0.01)。给药 2 个月后,CVB-D 10 mg·kg-1组大鼠尿液中NAG和IgG含量比正常对照组显著升高(P <0.05,P <0.01),CVB-D 5和 10 mg·kg-1组大鼠尿液中的β2-MG和TRF含量比正常对照组明显升高(P<0.01)。在恢复期内,CVB-D 10 mg·kg-1组大鼠尿液中mAlb和TRF含量比正常对照组显著升高(P <0.05),CVB-D 2.5 mg·kg-1组 mAlb含量比正常对照组显著升高(P<0.05)(表2)。
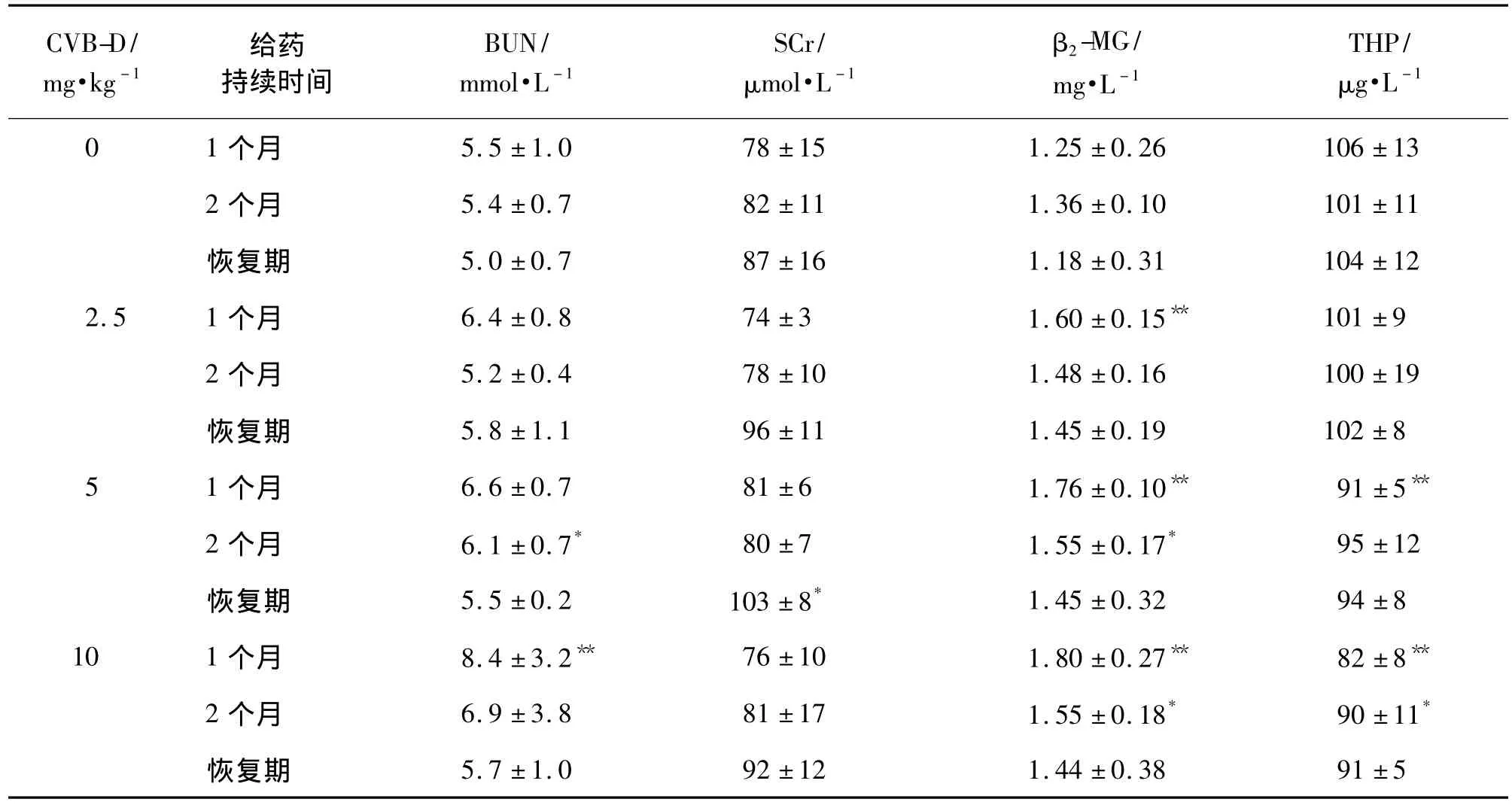
表1 环维黄杨星D(CVB-D)对大鼠血清中尿素氮(BUN)、肌酐(SCr)、β2微球蛋白(β2-MG)、Tamm Horsfall蛋白(THP)的影响Tab.1 Effect of cyclovirobuxine D(CVB-D)on blood urea nitrogen(BUN),creatinine(SCr),β2-microglobulin(β2-MG)and Tamm Horsfall protein(THP)in rats
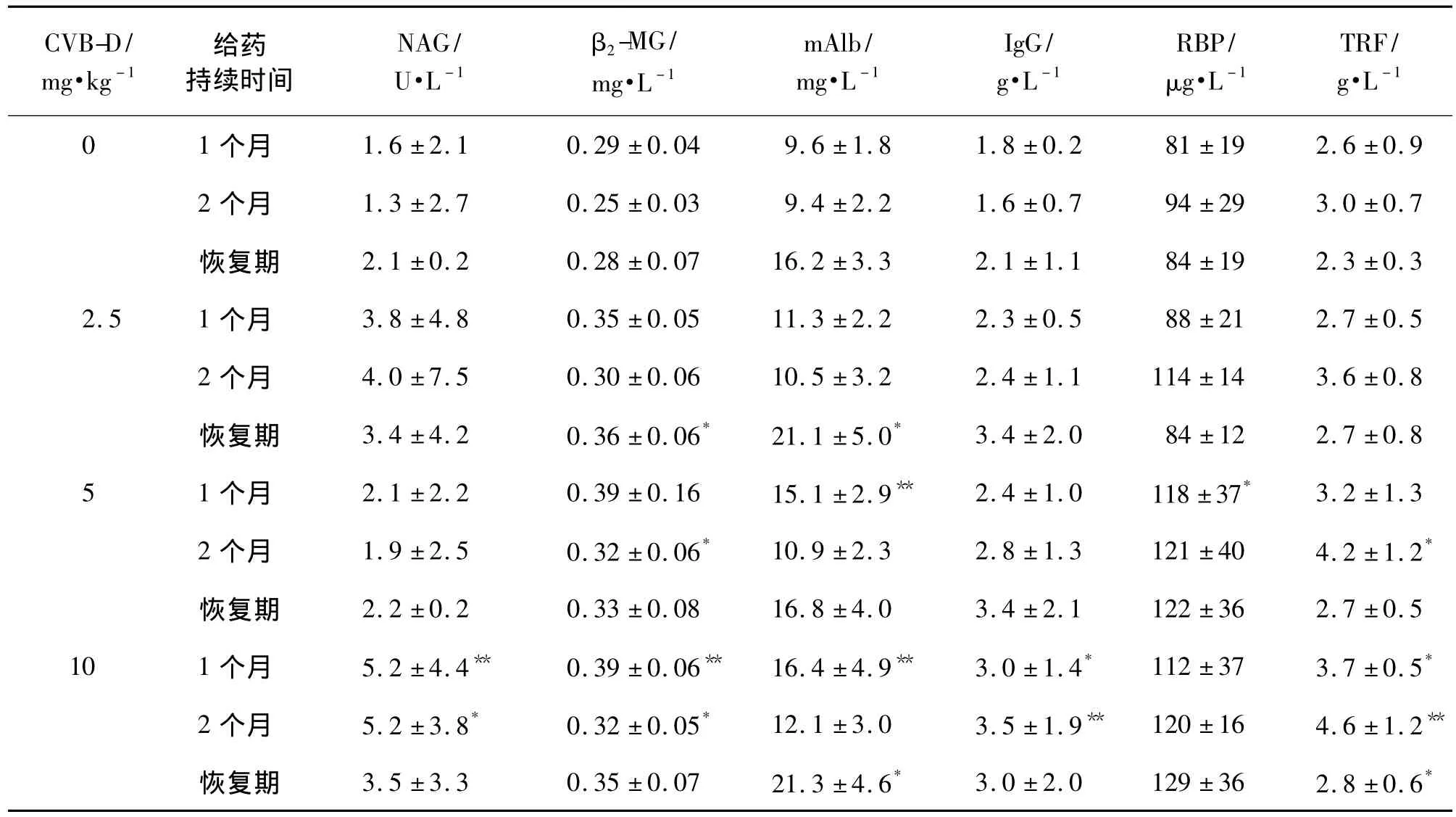
表2 CVB-D对大鼠尿酶及尿液中微量蛋白的影响Tab.2 Effect of CVB-D on concent of urease and protein in urine of rats
2.4 环维黄杨星D对大鼠肾脏组织病理的影响
肉眼观察可见给药1个月的大鼠肾脏组织未见异常,给药2个月及恢复期CVB-D 10 mg·kg-1组部分大鼠肾脏颜色由暗红变为暗黄色,质地变硬,其余未见异常。由图1组织学检查可见,正常对照组中肾脏组织学改变大致正常,未见明显病理改变。CVB-D 2.5 mg·kg-1组给药 1 个月有 2 例动物见肾间质内数量不等炎细胞浸润。CVB-D 2.5 mg·kg-1组给药2个月有2例动物见肾脏化脓性炎症,部分肾小球和肾小管坏死,1例动物见肾间质内少量炎细胞浸润;CVB-D 5和10 mg·kg-1组分别有1例和2例动物见肾脏包膜增厚,包膜下少量炎细胞浸润,并且有部分动物出现肾脏组织自溶现象;恢复期中各剂量组均有部分动物见肾间质内少量炎细胞浸润,少数动物肾间质内淤血明显。
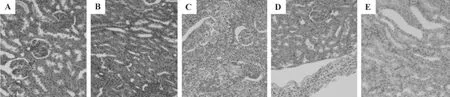
图1 CVB-D对大鼠肾脏组织病理变化的影响 (HE×200).A:给药1个月正常对照组,肾组织结构正常;B:给药1个月CVB-D 2.5 mg·kg-1组,肾间质炎症,细胞浸润;C:给药2 个月CVB-D 2.5 mg·kg-1组,肾化脓性炎症 ;D:给药2 个月CVB-D 10 mg·kg-1组肾包膜炎;E:恢复期 CVB-D 2.5 mg·kg-1组肾间质炎症.Fig 1. Effect of CVB-D on pathology of kidney in rats(HE×200).
3 讨论
药代动力学研究和早期的毒性实验均显示CVB-D在体内有蓄积作用,且肾脏为分布浓度较高的脏器之一,也是CVB-D的主要排泄器官。其次,已有的犬长期毒性实验中,有动物在观察期内的BUN升高,死亡的犬尿中出现蛋白、红细胞、白细胞及贫血的现象。家兔的长期毒性实验中,大剂量组部分动物远曲小管及享勒袢起始部位黄色素沉着,远曲小管上皮细胞核固缩,胞浆有嗜酸性变。均提示CVB-D对肾有影响的可能[1]。前期的研究显示,在SPF级大鼠和比格犬上,连续注射给药后,较大剂量组部分动物有明显肾脏毒性反应,尿中见有蛋白、上皮细胞及少量管型;血液生化中BUN明显高于正常对照组;肾脏见有远曲小管上皮细胞变性、坏死及蛋白管型等病理损伤改变[4]。
尿TRF的升高是肾小球电荷屏障受损的标志[5]。血清β2-MG的升高一般认为是肾小球滤过功能受损或滤过负荷是否增加的情况;而尿液中排出β2-MG增高,则提示肾小管损害或滤过负荷增加。尿液中mAlb和IgG的含量增加均可作为肾小球损伤的敏感指标,其中mAlb测定对早期肾损害的监测价值已被公认,现常把它作为糖尿病、高血压早期肾损害的一个敏感指标。本实验结果表明,大鼠ip给予CVB-D后尿液中的 TRF[5],mAlb和 IgG的含量以及血清中β2-MG的含量比正常对照组均明显增加,具有显著性差异,且呈量效关系。同时,通过肾组织病理切片发现,应用CVB-D给药2个月后,CVB-D 2.5 mg·kg-1组部分大鼠出现肾小球坏死的现象。可见,CVB-D 长期 CVB-D 2.5 mg·kg-1应用可能导致肾小球滤膜屏障的损伤。
尿液中NAG酶,RBP和β2-MG含量的增加以及THP含量的减少均可作为近端肾小管受损的敏感指标[6-7]。在本实验中以上指标的含量均随着剂量的增加及时间的延长而明显升高,与正常对照组相比具有显著性差异。这些指标均与血清中BUN和SCr呈相关性。同时在给药1和2个月后动物出现了肾间质炎细胞浸润,给药2个月后部分动物出现了肾小管坏死的现象。CVB-D大剂量及长期给药可能损伤近段肾小管以及导致急性间质性肾炎的现象。
在恢复期,血清及尿液中仍有部分指标显著高于正常对照组,病理组织切片显示 CVB-D 2.5 mg·kg-1组仍有部分单位出现肾间质内少量炎细胞浸润或不同程度淤血的现象。可见CVB-D致肾毒性病变在停药后无法彻底恢复。
[1]梁秉文,张朝位.黄杨宁与心脑血管疾病[M].北京:蓝天出版社,2000:67-82.
[2]梁 涛,方泰惠,姚秀娟等.环维黄杨星D药理研究进展[J].解放军药学学报,2001,17(1):35-37.
[3]刘锡明,姚明辉,方泰惠.环维黄杨星D的一些心血管作用[J].中国药理学报,1982,3(2):101-104.
[4]许 立,梁 涛,徐 立,袁冬平,周玲玲,方泰惠.环维黄杨星D对大鼠肾脏毒性的初步观察[J].中药新药与临床药理,2007,18(2):91-93.
[5]徐一甄,史虹莉,沈稚舟,叶山东,朱禧星,张桂生,等.NIDDM患者转铁蛋白尿和慢性并发症的关系[J].中华内分泌代谢杂志,1997,13(2):101-103.
[6]吴伟岚,卫敏江,陈敏怡,陈 难,苏宛华,陈 妍.尿α1-MG和尿NAG与肾小管间质病理变化的关系[J].上海第二医科大学学报,2004,24(5):357-358,392.
[7]Mao JH, HuangYK, Cheng SJ.Urinary microalbumin and retinal-binding protein assay for verifying children's nephron development and maturation[J].Clin Chim Acta,1997,264(1):127-132.

