缺氧诱导因子-1α在大肠癌及癌旁组织芯片中的表达及其临床意义
赵国琴
(西北民族大学医学院附属医院,甘肃兰州 730030)
缺氧诱导因子-1α在大肠癌及癌旁组织芯片中的表达及其临床意义
赵国琴
(西北民族大学医学院附属医院,甘肃兰州 730030)
目的探讨大肠癌组织中缺氧诱导因子(HIF)-1α的表达及其临床意义。方法将50例大肠癌手术标本和10例相应癌旁及14例正常大肠组织制作成组织芯片,同时将17例大肠腺瘤活检标本制作成常规切片,应用免疫组化SABC法研究HIF-1α在它们中的表达。结果HIF-1α在大肠癌组织的阳性表达率为64.0%(32/50),明显高于其正常大肠组织中的28.6%(4/14)(P<0.05);在正常大肠组织和腺瘤组织中的阳性表达率有显著性差异(P<0.05);在癌旁组织和大肠癌组织中的阳性表达率无显著性差异(P>0.05);在腺瘤组织和大肠癌组织中的阳性表达率无显著性差异(P>0.05),在大肠癌组织中HIF-1α蛋白的表达与Dukes分期、淋巴结转移有关(P<0.05),与患者年龄、性别、组织分化程度无关(P>0.05)。结论HIF-1α在大肠癌组织中表达增高,可能在大肠癌发生、发展、转移中起重要作用。
大肠癌;缺氧诱导因子-1α;组织芯片;免疫组化
缺氧诱导因子l(HIF-1)是一种分布及作用十分广泛的真核细胞转录因子[1],是由HIF-1α、HIF-1β组成的异源二聚体转录因子,其中HIF-1α是唯一的氧调节亚单位,决定了其活性,在肿瘤的血管生成、细胞生存、葡萄糖代谢、浸润、转移中发挥重要作用。HIF-1α在多种肿瘤组织和细胞株的表达已有研究[2,3]。但利用组织芯片技术研究HIF-1α在正常大肠组织到腺瘤组织再到大肠癌组织中的表达、发展中的作用在国内报道较少。因此,本实验应用组织芯片技术和免疫组化SABC法检测HIF-1α在50例大肠癌、17例大肠腺瘤、10例相应癌旁及14例正常大肠组织中的表达,旨在探讨大肠癌组织中HIF-1α的表达及其与大肠癌发生、发展的关系。
1 材料与方法
1.1 材料及试剂
1.1.1 材料收集兰州市城关区人民医院、兰州石化总医院及甘肃省肿瘤医院近3年大肠癌和大肠腺瘤存档蜡块,通过切片、HE染色,镜下选取代表性蜡块67例,其中大肠癌手术标本50例,大肠腺瘤活检标本17例;另选癌旁大肠黏膜组织10例、正常大肠组织14例作为对照。50例大肠癌病例中男性24例,女性26例,年龄40~76岁,中位年龄58.5岁,≤50岁12例,>50岁38例。按组织学分化程度分为高分化腺癌18例,中分化腺癌21例,低分化腺癌11例;无淋巴结转移18例,有淋巴结转移32例;Dukes(A+B)期14例,Dukes(C+D)期36例。50例大肠癌患者术前均未接受放疗和化疗,均调取其完整的临床资料。
1.1.2 试剂兔抗人HIF-1α多克隆抗体(浓缩型)及SABC试剂盒(购自武汉博士德生物技术有限公司)。
1.2 方法
1.2.1 组织芯片制作首先选择所需大肠癌病例存档蜡块,根据HE切片进行形态学观察,确定具有代表性的病变部位并标记。预先制备25mm×25mm×20mm的空白蜡块,用组织芯片仪按设计好的位置在空白蜡块上用点阵6×7的空心针打孔,每孔直径1.2mm,间距1.0mm,排成6行×7列共42点微阵列,然后在选取的癌(富有癌细胞且无坏死出血区域)、相应癌旁(距肿瘤0.5cm的无癌细胞组织)及正常大肠组织中的标记部位穿刺取直径1.2mm,准确放入空白蜡块小孔内,按序操作,直至将所有组织标本放入空白蜡块中并加以记录,共制备2块组织芯蜡块,其中每个组织芯蜡块含42个组织芯(包括2个标记点),最后将制成的组织芯蜡块面朝下放在铜板上,于55℃放置30min,轻压模块使组织柱在模块中排平,冷却至室温,再放入-20℃冰箱内6min。
1.2.2 切片将已制备好的组织芯片及17例大肠腺瘤组织蜡块标本连续切片,厚度4um,每个标本连续切片3张,1张HE染色,2张贴于经1%多聚赖氨酸处理的洁净载玻片上,经56℃烤箱干燥后,用于免疫组织化学染色。
1.2.3 免疫组化采用SABC免疫组织化学法染色,取4um厚石蜡切片经二甲苯脱蜡,梯度乙醇水化,蒸馏水浸泡,微波抗原修复,二氨基联苯胺(DAB)染色和苏木素复染,用已知阳性片作阳性对照,以PBS代替一抗作为阴性对照。
1.2.4 结果判定光学显微镜下,采用双盲法观片。细胞浆中出现淡黄色至棕黄色颗粒的细胞为阳性细胞。随机观察10个高倍镜视野,按每高倍镜视野阳性细胞数百分比记分:阳性细胞数小于5%为0分,阳性细胞数为5%~25%为1分,阳性细胞数为26%~50%为2分,阳性细胞数为51%~75%为3分,阳性细胞数大于75%为4分。同时按着色强度记分:染色弱,呈淡黄色为1分;染色中等,呈黄色为2分;染色强,呈棕黄色为3分。2种记分的乘积决定病例的结果:0分为阴性(-),1~4分为弱阳性(+),5~8分为中度阳性(++),9~12分为强阳性(+++)。
1.3 统计学处理
采用SPSS10.0统计软件包进行统计学处理。组间比较应用χ2检验和Fisher’s精确概率法,以P<0.05表示有统计学意义。
2 结果
2.1 HIF-1α在不同大肠病变组织中的阳性表达
HIF-1α主要定位于胞核或胞质,为棕色或棕黄色颗粒,主要在癌细胞、腺瘤细胞中表达(见图1、图2,SABC法,X400);在正常黏膜细胞中低表达,见表1。
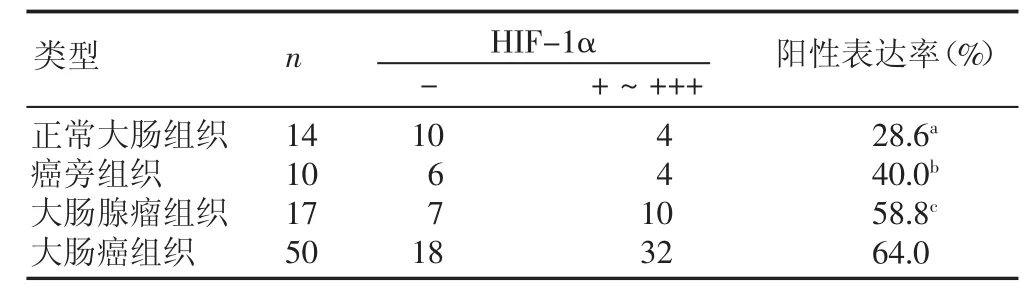
表1 HIF-1α在不同大肠病变组织中的阳性表达率
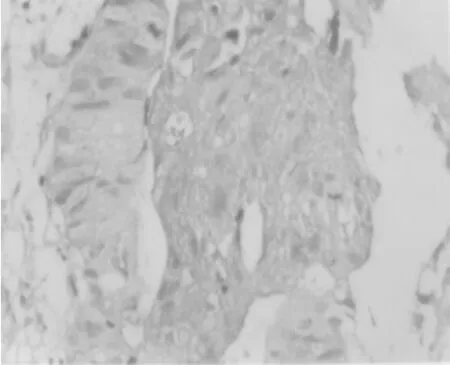
图1 HIF-1α在大肠癌组织中的表达
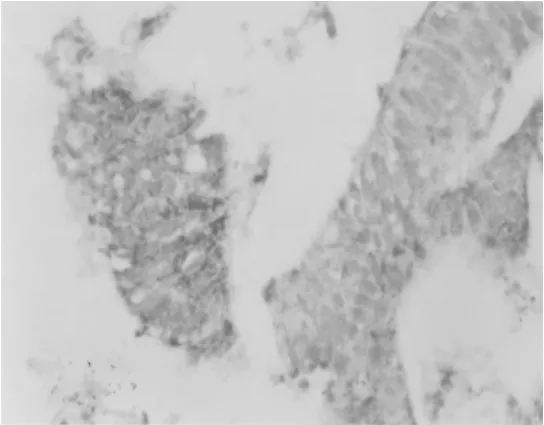
图2 HIF-1α在大肠腺瘤组织中的表达
2.2 HIF-1α表达与大肠癌临床病理特征间的关系
大肠癌组织中,HIF-1α的表达与Dukes分期、淋巴结转移有关(P<0.05),肿瘤淋巴结有转移和Dukes分期较高者HIF-1α的表达均明显高于淋巴结无转移和Dukes分期较低者,存在显著性差异(P<0.05)。HIF-1α的表达与患者性别、年龄、组织分化程度无关(P>0.05),见表2。
缺氧是实体性肿瘤微环境的基本特征之一,血管生成和细胞对缺氧的适应是肿瘤发生、发展的关键。在缺氧条件下,肿瘤细胞内许多基因的转录和表达发生变化,对缺氧做出应激反应(HRG)。HIF-1α是细胞在缺氧条件下产生的核蛋白,它与靶基因结合,促进其转录,使机体产生一系列缺氧适应反应。HIF-1α通过激活靶基因,而发挥舒张血管,增加血管通透性,促进血管生成,增加糖酵解作用,以及增加糖酵解来改善机体供氧及能量代谢需要,这对于因组织增生过快必然导致局部组织严重缺氧的肿瘤来说,有非常大的促进作用。
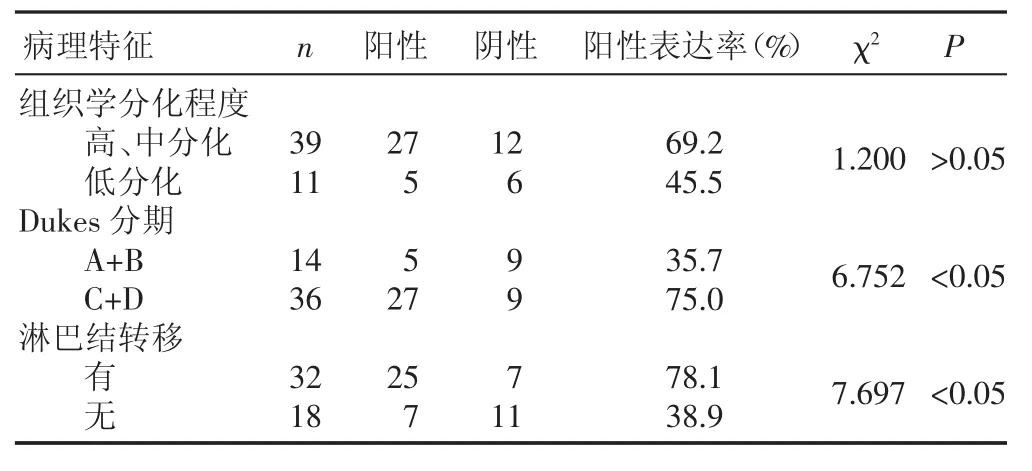
表2 HIF-1α的表达与大肠癌临床病理特征间的关系
本研究用组织芯片技术及免疫组织化学法发现HIF-1α在正常大肠组织、癌旁组织、大肠腺瘤组织及大肠癌组织的表达分别为28.6%、40.0%、58.8%、64.0%,显示大肠组织从正常到腺瘤再到恶性转化,HIF-1α的激活水平渐次增加,且在大肠癌、大肠腺瘤和正常组织的阳性表达率有显著性差异,说明HIF-1α可能参与癌的进展和发生。HIF-lα在癌旁组织和大肠癌组织的阳性表达率无显著性差异,说明HIF-lα在癌旁有高表达。研究发现HIF-1α的表达与Dukes分期、淋巴结转移有关(P<0.05),肿瘤淋巴结有转移和Dukes分期较高者HIF-1α的阳性表达率明显高于淋巴结无转移和Dukes分期较低者,说明HIF-1α在大肠癌的浸润、转移过程中起重要作用。众多研究显示,HIF-lα在多种人类肿瘤组织中有表达,甚至存在癌前病变中,提示肿瘤细胞缺氧发生在血管生成之前,并进而促进肿瘤的恶性转化[4,5]。本研究中17例大肠腺瘤组织中有10例HIF-lα呈阳性表达,很可能HIF在癌前病变组织形成机制中起主要作用,是促进大肠癌发生的关键。同时,本研究体会到应用组织芯片进行检测,具有体积小、信息含量大、节省时间、节约经费、结果准确的优势,可检测大肠癌大样本及HIF-1α在大肠癌不同阶段的表达及其相关性,为临床监测大肠腺瘤癌变及其进展提供有价值的指标,为临床早期诊断大肠癌提供可靠的理论依据,为大肠癌临床病理诊断和判断大肠癌恶性程度及预后提供可靠的参考指标。
[1]孙旭芳,曾水清,张虹,等.缺氧条件下视网膜微血管内皮细胞中缺氧诱导因子1和血管内皮生长因子mRNA表达的研究[J].中国现代医学杂志,2005,15(6):825~827.
[2]Bos R,Zhong H,Hanrahan C F,et a1.Levels of hypoxia—inducible facter-1 a during breast carcinogensis[J].Natl Cancer nst,2000,4(93):309.
[3]Zagzag D,Zhong H,Scalzitti M,et a1.Epression of hypoxia—inducible factorlalpha in brain tomours:association with angiogenesis,invasion,and progression[J].Cancer,2000,88(11):2606.
[4]emenza G L,AgAni F,Booth G,et a1.Structural and functional analysis of hypoxia—inducible factor l[J].Kid—hey Int,1997,5(4):553.
[5]Birner P,Schindl M,Oberhuber G.Overexpression of hypoxia-inducible factor-la is a marker for an unfavorable prognosis in early—stage invasive cervical cancer[J].Cancer ReS,2000,60(18):4693.
R73-3
B
1671-1246(2010)21-0144-02
——以“蜡块的运动”演示实验为例

