生物柴油研究进展
滕虎,牟英,杨天奎,修志龙
大连理工大学生命科学与技术学院,大连 116024
生物柴油研究进展
滕虎,牟英,杨天奎,修志龙
大连理工大学生命科学与技术学院,大连 116024
介绍了国内外生物柴油的发展现状,探讨了我国发展生物柴油的原料来源途径,包括木本油料植物、转基因油料作物、废弃油脂、微生物油脂和微藻油脂等,综述了制备生物柴油的化学法、酶法、超临界法等生产技术及其进展,概括了当前生物柴油主要的品质问题与改性对策,分析了生物柴油副产物的高值化利用策略,指出了我国生物柴油产业化面临的原料、技术和生物炼制方面的主要问题。
生物柴油,原料,甘油高值化利用,生物炼制
Abstract:Biodiesel is renewable and environmentally friendly; however, there are still many challenges for its commercial production as an alternative of petroleum-based transportation fuels, particularly in China with very limited resources for its biofuels development.In this article, the update progress of biodiesel R & D and production is reviewed, with a focus on its feedstock supply,manufacturing processes, quality control and byproduct utilization.It is concluded that the strategy of biorefinery to ultimately explore feedstock potentials will make biodiesel production more economically competitive.
Keywords:biodiesel, feedstock, high value-added utilization of glycerol, biorefinery
1 国内外概况
生物柴油是指短链一元烷醇的脂肪酸酯。由于甲醇价格便宜、易回收、易纯化,大多数生物柴油标准(如欧盟标准 EN 14214、美国标准 ASTM D6751)定义生物柴油为来源于动植物油脂的脂肪酸甲酯。生物柴油的动力、效率、托力和爬坡能力与普通柴油相当,其他性能二者也相近,如十六烷值、粘度、燃烧热、倾点等。生物柴油具有环境友好的特点,体现在生产、燃烧过程的各个层面。生物柴油的生产可减少石化能源的开采和消耗,燃烧排放的CO2远低于植物生长过程吸收的CO2,可缓解因 CO2积累造成的全球气候变暖;生物柴油含硫量低,可使二氧化硫和硫化物的排放减少约30%,且不含造成环境污染的芳香烃,其废气排放可满足欧洲Ⅲ号排放标准[1]。
近十几年来,生物柴油受到世界各国的普遍关注。为了抑制气候变暖、减少环境污染、增加就业和收入、保证能源供应安全,欧盟、美国、加拿大、澳大利亚和亚洲的一些国家的政府、科研机构和企业共同努力,不断加大生物柴油的生产和推广力度,许多国家已经进入实用化阶段。图1为 2000−2006年世界生物柴油产量分布,从图中可以看出欧盟的生物柴油产量一直遥遥领先,其次是美国[2]。
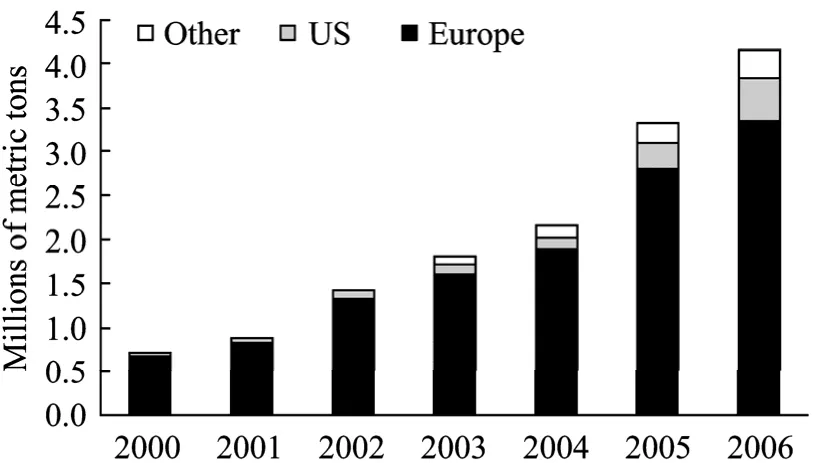
图1 世界生物柴油产量[2]Fig.1 World capacity of biodiesel[2].
欧盟:各成员国制定的生物能源指导性文件和财税优惠政策极大地促进了欧盟生物柴油的生产。根据欧洲生物柴油委员会(European Biodiesel Board,EBB)的统计,2009年欧盟已有276个生物柴油生产厂,最近15年生物柴油的产量不断增加(图2)。其中,德国的生物柴油产量远远领先于其他成员国,2008年产量约为530万t,其次是法国(200万t)、意大利(150万t)和西班牙(120万t)。
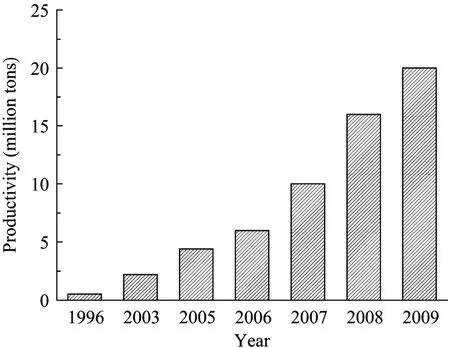
图2 欧盟近15年的生物柴油产量[2]Fig.2 Biodiesel productivity of the European Union in the last 15 years[2].
美国:截止2006年4月,美国有65家生物柴油生产工厂,年产量达137万t。另有8个工厂在扩建,50个工厂在建设中,在建产量为 248万 t。拟建生物柴油项目36个,产量约262万t。2007年底,生物柴油年产量达380万t以上。
澳大利亚:近几年政府非常重视生物燃料的应用,于2003年底提出了发展生物燃料的具体建议。2004年澳大利亚有3家企业生产生物柴油,年产量为 4.8万 t。目前可能有 10家左右(包括在建生产线),产量达8.8万t/年。
马来西亚:第一大棕榈油生产国。2004年和2005年政府分别批准了50万t、150万t棕榈油用于生产生物柴油,目前已批准35个生物柴油生产项目,产量达 300万 t/年。计划用于生产生物柴油的棕榈油达600万t/年[3]。
日本:1999年建立了用煎炸废油为原料生产生物柴油的工业化试验基地。目前日本生物柴油的年产量达40万t左右。
韩国:自2006年7月起,加油站供应的柴油中添加了0.1%~5%的生物柴油(BD5),政府对添加的生物柴油部分免征税收。
印度:能源需求列世界第六,占世界总需求量的3.5%,且以每年6%的速度增加,进口原油约为70%。印度每年进口40%的食用油,生物柴油的原料只能是非食用的树果油类,其中麻风树Jatropha curcas和水黄皮属卡兰贾Karanja受到关注[4]。
中国:世界第二大石油消费国,对外依存度接近50%。2010年柴油需求量约1亿t,2015年将达到1.3亿t。另一方面,我国大气污染趋于恶化,2005年二氧化硫排放量达2 549万t,居世界首位,较 2000年增加 27%。节能减排、保障能源和环境安全是我国长期面对的难题,发展环保、可再生的生物燃料成为国家的战略需求。
我国在“九五”期间就制定了可再生能源中长期发展规划,2005年又出台了《可再生能源法》。2005年生物柴油的产量为10万t左右,2007年产量达100万t左右。国家规划2010年生物燃料(包括生物柴油)将替代石油200万t,2020年生物燃料年替代石油1 000万t,占交通燃料的15%左右。
2 油脂原料的多样性
油脂原料是生物柴油价格的主要决定因素,占总成本的 70%以上[5]。世界各国根据本国国情选择合适的油脂原料,如美国主要利用高产转基因大豆为原料,欧洲各国以菜籽油为原料,东南亚地区利用棕榈油生产生物柴油,日本则以餐饮废油为主要原料。本着不与人争粮油、不与粮油争地的原则,我国积极开发多样化的非粮油原料供应途径,为包括生物柴油在内的生物能源产品生产积蓄来源充足的廉价原料。
2.1 木本油料植物
我国有着丰富的木本油料资源,已建立起规模化的良种供应基地的油料植物有10种左右[6]。目前可开发作为能源树种的有麻疯树、黄连木、文冠果、光皮树、乌桕和油桐等,表1比较了这6个树种可开发为生物柴油原料的潜力[7]。初步统计,上述6个树种现有相对成片面积超过135万hm2,果实产量在100万t以上,如能收集其中50%进行加工利用,可获得 20余万 t生物柴油[8]。国家林业部门将林业生物柴油列为重点发展项目,提出“十一五”期间将发展生物柴油能源林83万hm2,其中麻疯树40万hm2,黄连木25万hm2,文冠果13万hm2,光皮树5万hm2;到2020年定向培育能源林1 333万hm2,满足年产600万t生物柴油和1 500万kW发电量的原料供应[9]。优良品种与丰产栽培技术是当前能源林种植中亟待解决的突出问题。
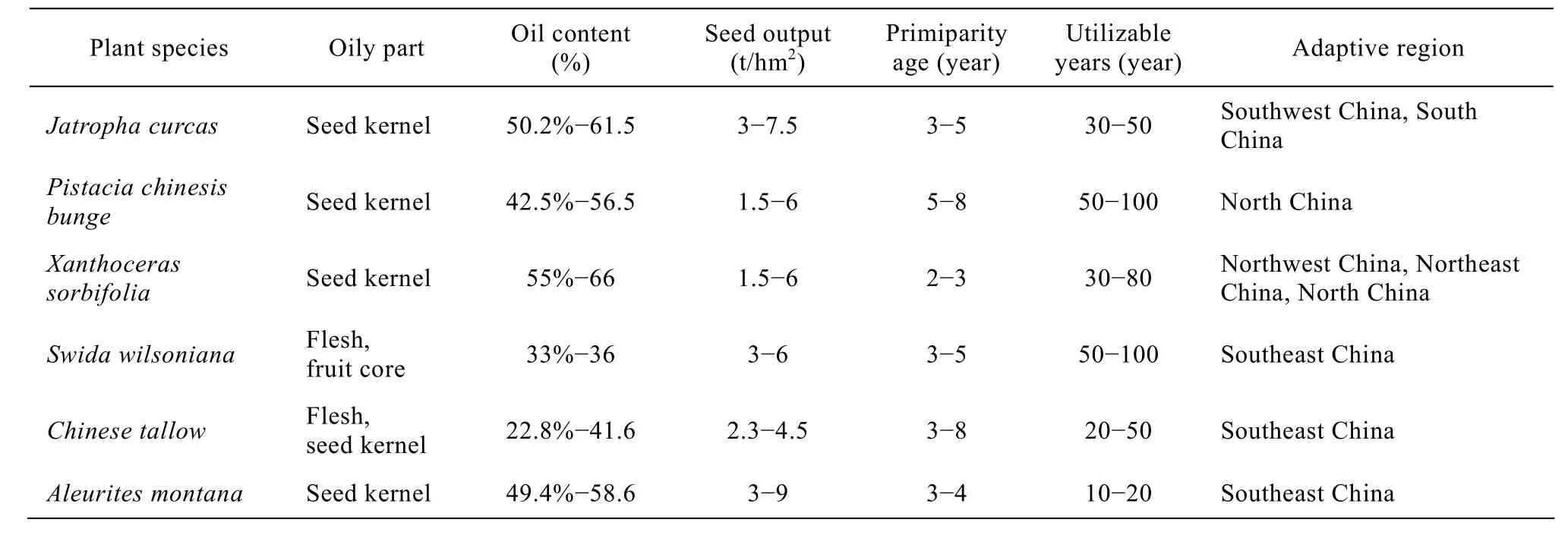
表1 几种重点开发的生物柴油木本植物原料的比较[7]Table 1 Comparison of the main woody oil plants in China[7]
2.2 转基因油料作物
通过转基因技术可以使传统油料作物(如油菜、棉花、大豆等)的产量和出油率得到极大提高,例如中国农业科学院油料作物研究所培育成功的“中油-0361”高蓄能油菜新品系种籽含油率高达54.72%[10],较长江中下游大面积推广的一般油菜品种提高25%以上,亩产达到180 kg。我国长江流域和黄淮地区有2 670万hm2冬闲耕地,如用来种植能源油菜,按当前平均菜籽产量1.6 t/hm2,含油率40%计,每年可为1 700万t生物柴油提供原料。如果种植高产和含油量高的转基因油菜,则可提供的生物柴油原料达3 900万t[11]。转基因食品的安全性尚存在争议,种植这类油料作物需要严格的安全评估。
2.3 废弃油脂
废弃油脂是目前我国生物柴油生产的主要原料,包括餐饮废油、地沟油、煎炸废油等。但废弃油脂资源总量有限、供应不稳定,原料组成及性能变化较大,只能是生物柴油产业发展的有限资源[12]。杜绝废油脂重回餐桌是开发生物柴油资源的基本前提。
2.4 微生物油脂
微生物油脂又称单细胞油脂,是由酵母、霉菌、细菌等微生物在一定的条件下产生的,其脂肪酸组成与一般植物油相近,以C16和C18系脂肪酸如油酸、棕榈酸、亚油酸和硬脂酸为主。常见的产油酵母有浅白色隐球酵母Cryptococcus albidus、弯隐球酵母Cryptococcus albidun、斯达氏油脂酵母Lipomyces、茁芽丝孢酵母Trichospiron pullulans、产油油脂酵母Lipomy slipofer、胶粘红酵母Rhodotorulaglutinis、类酵母红冬孢Rhodosporidium toruloides等。常见的产油霉菌有:土霉菌Asoergullus terreus、紫癜麦角菌Claviceps purpurea、高梁褶孢黑粉菌Tolyposporium、高山被孢霉Mortierella alpina、深黄被孢霉Mortierella isabellina等[13]。一些产油酵母菌能高效利用木质纤维素水解得到的各种碳水化合物,包括五碳糖和六碳糖,胞内产生的油脂可达到细胞干重的70%以上[13]。
2.5 微藻油脂
藻类光合作用转化效率可达10%以上,含油量可达 50%以上[14]。美国的研究人员从海洋和湖泊中分离得到3 000株微藻,并从中筛选出300多株生长速度快、脂质含量较高的微藻。在各种藻类中,金藻纲、黄藻纲、硅藻纲、绿藻纲、隐藻纲和甲藻纲中的藻类都能产生大量不饱和脂肪酸。小球藻为绿藻门小球藻属Chlorella单细胞绿藻,生态分布广、易于培养、生长速度快、应用价值高。小球藻细胞除了可在自养条件下利用光能和二氧化碳进行正常的生长外,还可以在异养条件下利用有机碳源进行生长繁殖,可以获得含油量高达细胞干重55%的异养藻细胞[15]。
微藻生物柴油受到广泛关注,图3给出了其开发的基本流程。
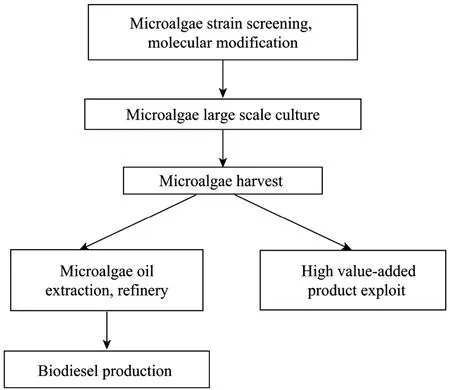
图3 微藻生物柴油技术流程Fig.3 Technical process of biodiesel from microalgae.
微藻生物柴油的商业化运行尚需解决如下关键问题:
1)传统的光合自养培养难以在单位时间内获取高生物量,大规模高密度培养仍然是微藻细胞培养的核心难题;另外开放式培养易导致微藻被污染,培养早期添加的矿物质和营养物易使水体富营养化等问题也值得关注。
2)从水中采收微藻,提取、精炼藻油都需要消耗大量能量或电量。
3 生产与制备方法
酯交换法是目前生产生物柴油最普遍的方法,即油脂在催化剂作用下与短链醇作用形成长链脂肪酸单酯。该反应需要催化剂(如酸或碱)分裂甘油三酯与短链醇重新结合为单酯,同时副产甘油。因为甲醇成本最低,从而成为最常用的短链醇。但甲醇主要来源于不可再生的天然气或煤炭,致使第一代生物柴油多为不完全可再生。而巴西拥有丰富的甘蔗资源,生物基乙醇取代了甲醇用来生产生物柴油,成为完全可再生的绿色产品。其他短链醇,如丙醇、正丁醇、异丁醇等也有研究,但无产业化报道。目前实际应用的工业催化剂多为酸、碱和脂肪酶,其中NaOH因价格低廉、催化活性较高而被广泛使用。按照催化剂的种类可以将生物柴油的制备方法划分为:化学法(酸、碱催化法)、生物酶催化法和无需催化剂的超临界法。
3.1 化学法
目前工业化的生物柴油生产方法主要是在液体酸、碱催化剂的存在下动植物油脂与甲醇进行的酯化或/和酯交换反应。优点是反应速度快、时间短、转化率高、成本较低等,缺点是液体催化剂难以分离回收再利用,副反应较多,存在乳化现象,副产物甘油精制困难,产品后续水洗与中和产生大量的工业废水,造成环境污染等。非均相固体催化剂可以重复使用,而且反应条件温和,容易实现自动化连续生产,对设备腐蚀小,对环境污染小,成为生物柴油生产新工艺的研发热点。化学法制备生物柴油的一般流程如图4所示。
3.1.1 固体酸催化剂
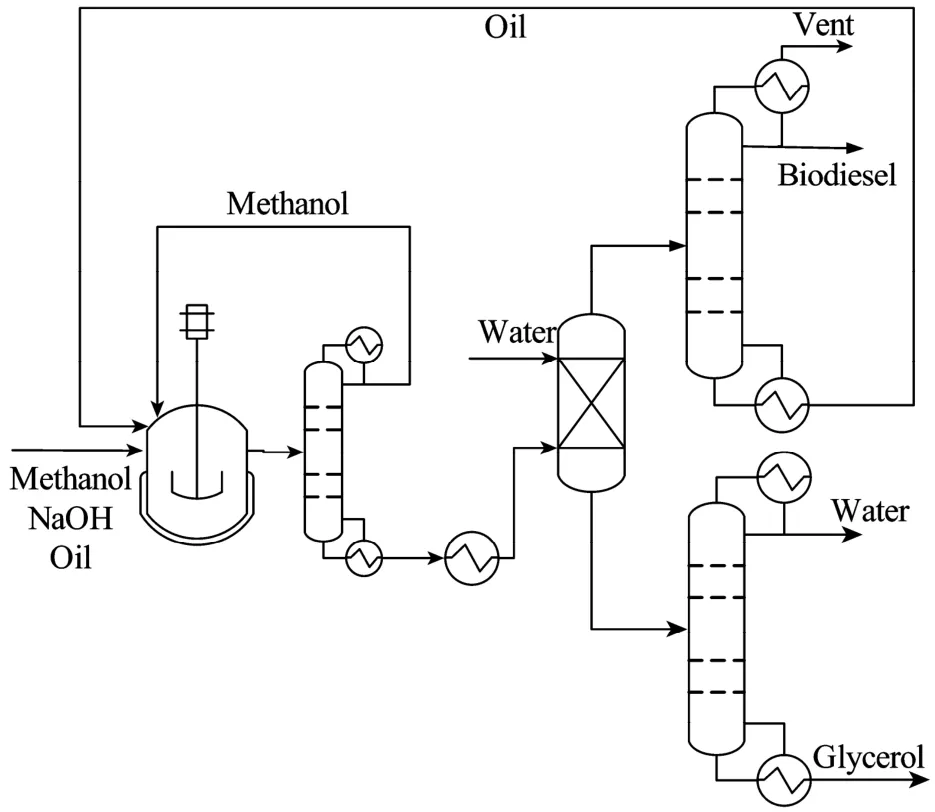
图4 生物柴油的生产流程Fig.4 Schematic diagram of biodiesel production.
固体酸催化剂是具有给出质子和接受电子对能力的固载化催化剂,同时具有 Bronsted酸和 Lewis酸活性中心。固体酸能够同时催化酯化反应和酯交换反应,相对地酯化反应的活性更高,甚至达到了液体酸的催化水平[16]。
1)阳离子交换树脂
阳离子交换树脂曾被广泛研究,因为树脂具有多孔结构,能为尺寸较大的有机物分子(脂肪酸)的渗透扩散提供方便孔道和活性表面。Vicente等[17]利用阳离子交换树脂催化葵花籽油与甲醇的酯交换反应,最终生物柴油得率接近于硫酸催化法,而生物柴油品质更优。离子交换树脂在催化的同时,还对产物起到有效分离的作用,尤其是甘油的提纯。Ramos等[18]比较了聚乙烯丁二酸酯和聚苯乙烯-二乙烯苯两种磺酸树脂,转化率在2 h后达到90%以上。但使用时间仅为几十小时,很难达到工业化生产的要求。
2)负载型固体酸
负载型固体酸的研究近年来日益增多,如将硫酸固载到氧化钛、氧化锆上得到的固体强酸催化剂SO42−/TiO2和 SO42−/ZrO2[19],将磷钨酸负载到氧化铝、氧化硅、氧化锆和活性炭上制备负载型固体酸[20-23]。这类固体酸催化剂的活性不但受到载体的影响,也受负载活性位点量及催化剂的比表面积、孔径和孔体积等因素的影响,尤其是活性位点量的影响最大。尽管负载型催化剂提高了稳定性,但反应温度较高(如200℃以上),不适合工业生产的需要。
3)炭基固体酸
炭基负载催化剂采用廉价的可再生的碳水化合物作为载体的起始材料,制备工艺简单、反应高效、产率高及应用范围广,具有极高的工业应用价值。Hara等[24]将萘添加到98%浓硫酸中,在氮气保护下进行磺酸化,得到不完全炭化和磺酸化的多芳碳环结构的固体酸催化剂。但该催化剂结构较柔软,反应温度高于100℃时SO3H发生脱落而使催化活性下降。随后,他们将葡萄糖在400℃炭化15 h,在150℃磺酸化15 h,制得了具有层状芳环碳组成的无定形炭结构催化剂,负载于其上的 SO3H提供了酸性位点。该类催化剂表现出较好的热稳定性和较高的酯化反应活性。Zong等[25]使用葡萄糖作为起始材料经相同工艺制备的炭质固体酸,催化油酸的酯化反应5 h酯化率达到95%以上,催化含27.8%游离脂肪酸的地沟油的酯交换反应,生物柴油得率在10 h后达到 90%以上。与 SO42−/ZrO2、Amberlyst-15和铌酸相比,初始反应速率更快,最终生物柴油得率更高。乌日娜等[26]在炭化-磺酸化两步法的基础上提出浓硫酸一步磺酸化木质素制备炭基固体酸催化剂的方法,大大简化了制备工艺。
3.1.2 固体碱催化剂
固体碱主要是指能向反应物提供电子的固载化催化剂,即具有Bronsted碱和Lewis碱活性中心。固体碱在有机催化中应用较广,包括酯交换反应、双键异构化反应、氧化和还原反应、Aldol缩合、Michael加成、Knoevenagel缩合等。用于制备生物柴油的固体碱催化剂包括镁铝水滑石、碱土金属氧化物、沸石分子筛、负载型催化剂等。
1)镁铝水滑石
镁铝水滑石是一种特殊的固体碱催化剂,分子式为 Mg6Al2(OH)16·4H2O,镁铝摩尔比范围为1.7~4.0。镁含量对水滑石催化酯交换反应的活性影响较大,镁含量的增加有利于提高酯交换转化率[27]。简单的煅烧制备工艺只能得到活性较低的催化剂,改进制备工艺和使用方法后,酯交换转化率可以提高到93%,甚至接近100%[28],但反应条件相对较高。
2)碱土金属氧化物
CaO是研究最多的碱土金属氧化物催化剂。与水滑石类似,CaO的低表面积影响了它的催化活性,纳米级CaO催化大豆油的酯交换反应的转化率可达到99%[29]。油脂中适量的水(2.03%)可以提高CaO的催化活性,但CaO与甲醇反应形成的甲醇钙则降低了催化活性[30]。另外CaO与甲醇钙易吸收H2O和CO2,并与产品形成粘稠物,导致产品分离困难。将CaO浸渍到碳酸铵溶液中,并在 900℃煅烧制得超强碱,在较温和的反应条件下,如醇油摩尔比9∶1、催化剂用量1.5%和反应温度70℃,生物柴油得率达到94%[31]。
3)沸石分子筛
分子筛的催化能力受其化学组成、孔径大小、孔道分布和离子交换能力的影响,而酸碱性质受离子交换类型、能力和分子筛骨架结构Si/Al摩尔比的控制。为了控制分子筛碱性,通常采取碱金属离子交换或将碱注入分子筛孔内。虽然分子筛孔道的孔径均匀、空穴排列规则、内表面积大,但纳米级的孔道会阻碍大分子甘油三酯的进入,使得内表面的活性位点无法被充分利用,很大程度上削弱了原本存在的优势,因此大孔分子筛更适合催化甘油三酯和甲醇的酯交换反应[32]。相对于均相碱催化剂,分子筛要达到类似的转化率所需的反应温度更高(150℃)、反应时间更长(15 h),其催化活性低于镁铝水滑石和碱土金属氧化物。
4)负载型催化剂
碱金属或碱土金属是负载型催化剂最常用的碱活性种源,通常将Na、K、Li、Ba、Mg和Ca等金属离子的氧化物、卤化物、氢氧化物或碳酸盐、硝酸盐等负载到Al2O3、分子筛、水滑石等载体上,如Eu2O3/Al2O3、La/β zeolite、Na/NaOH/γ-Al2O3等。此类催化剂的载体机械强度和表面积可以调节,从而获得不同碱强度和碱量的固体碱。Al2O3除了可用作载体,还可用作助催化剂或直接用作催化剂,如KI/Al2O3、KNO3/Al2O3、CaO/Al2O3、BaO/Al2O3等催化剂都具有较高的酯交换反应活性。其他负载型催化剂,如 La2O3/ZrO2、SBA-15、KOH/MgO等,也表现出高活性,甚至接近均相碱催化剂。但此类催化剂在反应过程中不稳定,主要原因是“金属-氧”键发生溶剂分解作用,而“金属-氧”键是催化剂结合到载体上的主要作用力[33]。
负载型固体碱的制备过程比较复杂,成本相对较高,易吸收H2O和CO2导致中毒,并且碱位点易脱落。因此,采用廉价的载体和相对稳定的碱源,开发简单易行的制备工艺是负载型固体碱研究开发的重点。例如,煅烧硅酸钠是一种制备方法简单、价廉效高的负载型固体碱催化剂[34]。
3.2 酶催化法
利用脂肪酶催化油脂与短链醇(主要是甲醇和乙醇)进行酯交换反应。该方法对原料品质要求低、副产物甘油易分离、耗能低,但反应时间长、酶容易失活。常用的脂肪酶包括Novozym 435脂肪酶、南极假丝酵母Candida antarctica脂肪酶、固定化假丝酵母Candidasp.99-125脂肪酶、米根霉Rhizopus oryzae脂肪酶、洋葱假单胞菌Pseudomonas cepacia脂肪酶。
固定化酶或细胞可以克服游离脂肪酶分散不均易聚集结块、不便回收重复利用等缺陷,如Novozym 435作为一种固定化脂肪酶被广泛应用于生物柴油的制备研究中[35],固定化细胞Candidasp.99-125也被北京化工大学应用于连续制备脂肪酸甲酯中,并建立了200 t/年的中试装置[36]。
提高脂肪酶对短链醇的耐受性是解决酶易失活的重要途径。采取批式流加甲醇[36]、添加惰性溶剂(如正己烷)降低醇的浓度[37]、用乙酸甲酯作为酰基受体[38]等措施可以在一定程度上减小甲醇和甘油对酶的毒性,延长酶的使用寿命。
复合脂肪酶能有效地克服单一脂肪酶的底物专一性,改善不同脂肪酶的协同催化效应,提高转酯效率。用固定化米根霉Rhizopus oryzae和玫瑰假丝酵母Candida rugosa脂肪酶作为复合酶催化植物油脂与甲醇的反应,反应 4 h后生物柴油的转化率达到了98%[39],反应时间比单一酶催化大大缩短。
3.3 超临界法
超临界甲醇可以在无催化剂的情况下与油脂反应生成脂肪酸甲酯,需要相当高的温度和压力条件(350℃,20~50 MPa)。利用共溶剂可以改善超临界的工艺条件,但不能将温度降到临界点附近。少量碱性催化剂可以减少甲醇的用量,也能降低反应温度和压力,从而大大降低该方法的成本[40]。
3.4 其他
乙醇取代甲醇用来生产生物柴油引起人们的关注[41],乙醇无毒,脂肪酸乙酯的热值和十六烷值相应增加,浊点和倾点比甲酯要低,而且是完全可再生的。另外微波加热可以大大缩短酯交换反应时间,降低醇油摩尔比,明显提高固体酸的催化效率[42]。超声波也能显著减少酯交换反应的时间[43]。
4 品质与改性对策
各国对生物柴油都制定了相应的标准,如欧盟标准EN14214规定生物柴油中甲醇质量含量不能超过0.2%,游离甘油不能超过0.02%,甘油、甘油一酯、甘油二酯的含量应低于0.1%等等,以确保生物柴油在运输、储存和使用过程中的优良品质。
生物柴油的低温流动性是其品质的重要指标,与碳链长度、不饱和度和支链有密切关系。碳链越长,脂肪酸甲酯的熔点越高;不饱和度越大,熔点越低;支链多熔点相对低。如硬脂酸甲酯和油酸甲酯的熔点分别为39.1℃和−19.8℃,两者相差59℃。但不饱和键的存在也会影响生物柴油储存时的氧化安定性。
为改善生物柴油的抗氧化稳定性和低温流动性,可以采取如下对策:1)添加抗氧化剂和降凝剂,如叔丁基氢醌(TBHQ)是一种有效的抗氧化剂;2)引入支链,如短链仲醇(异丙醇、仲丁醇等)与油脂形成的酯能干扰生物柴油的结晶;3)双键环氧化,与醇作用形成含支链羟基和醚基生物柴油[44],如9-乙氧基-10-羟基-硬脂酸异丙醇酯的浊点和倾点分别是−23℃和−24℃;4)在双键的邻位上接入烷基支链,如油酸甲酯与格里雅试剂反应生成8(1)-甲基或正丁基支链油酸甲酯,熔点较油酸甲酯分别降低52.6℃、62.1℃[45];5)脂肪酸碳链异构化[46-47],但商业化应用还有一些技术瓶颈需要解决,如提高支链产物比率、选择性加成多不饱和碳链、延长催化剂的使用寿命等。
5 副产物的高值化利用
5.1 甘油的生物转化
生物柴油的生产过程中副产10%的粗甘油。有效地利用甘油是降低生物柴油的生产成本和解决环境污染问题的基本要求。甘油可以通过化学法转化为环氧氯丙烷、1,2-丙二醇等,也可以通过微生物发酵转化为1,3-丙二醇(1,3-PD)、二羟基丙酮、丙酸、乙醇和氢气等高附加值产品。
1,3-PD是一种重要的化工原料,最主要的用途是作为合成聚酯和聚氨酯的单体,尤其是作为新型聚酯——聚对苯二甲酸丙二酯(PTT)的单体。PTT在地毯、服装和工程热塑料等领域具有广阔的发展前景,被誉为新一代聚酯材料。微生物发酵法生产1,3-PD所用原料可再生,操作简便、安全性高、环境污染小。碱法制备生物柴油时副产的粗甘油可以直接被克雷伯氏杆菌利用转化为1,3-PD[48],用中空纤维膜可将脂肪酶催化制备生物柴油与微生物转化甘油为1,3-PD两个过程耦联起来(图5)[49]。
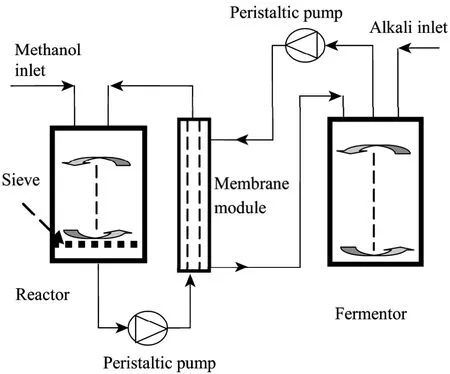
图5 生物柴油和1,3-丙二醇联产示意图Fig.5 Schematic diagram of coproduction of biodiesel with 1,3-propanediol.
甘油生物转化为二羟基丙酮可以通过醋酸杆菌和葡萄糖酸杆菌Gluconobacter suboxydans来实现。产丙酸的微生物包括特氏丙酸杆菌Propionibacteria thoenii、谢氏丙酸杆菌Propionibaeteria shermanii、费氏丙酸杆菌Prorionibacteria frudenreichii和产酸丙酸杆菌prorionibaeteria acidiprorionici等。以甘油为底物发酵生产丙酸有一些实验室探索工作[50]。能够利用甘油发酵生产乙醇的菌种较少,但可通过筛选和基因工程等手段获得合适的菌种。产气肠道杆菌Enterbacter aerogenes可以将生物柴油副产的甘油转化为乙醇,同时获得氢气[51]。
5.2 油料植物中的皂苷和蛋白
许多木本油料植物是药用树种,含有丰富的药用成分和极具开发价值的蛋白质。如文冠果种仁中含 26.1%蛋白质,还有药用皂苷成分,可以开发用于治疗遗尿症、智力低下和老年痴呆症的药物;麻疯树种子中富含蛋白质(约占干重19%~27%),且蛋白具有生物活性,从麻疯树中分离出的生物碱类成分具有较强的抗微生物、抗寄生虫、抗肿瘤等药理作用[52];黄连木种子经榨取油脂后的渣粕含有蛋白质和大量粗纤维是优良的动物饲料,同时油粕中含有的植物多酚具有抗氧化、止血消炎、解毒抗病毒等作用[53];油桐种仁榨油后的桐饼含粗蛋白28.9%,是一种很好的饲料蛋白和氨基酸资源,也可用作农用有机肥[54]。
5.3 微藻高值化利用
微藻中存在着许多结构独特、作用各异的初级和次级代谢产物,除了甘油三酯外,其他活性物质还有蛋白质、多不饱和脂肪酸、色素及生物活性物质等。
微藻中含有丰富的多不饱和脂肪酸(PUFA),如二十碳五烯酸(EPA)、二十二碳六烯酸(DHA)和花生四烯酸等,具有抗血栓、降血脂、防止血小板聚结、舒张血管等功能;此外,DHA还能促进脑细胞的生长发育,改善大脑机能。
微藻中的蛋白和油脂可以相互转换,当微藻处于氮饥饿条件下,蛋白质含量减少,而油脂含量增加。小球藻和螺旋藻是饲料添加剂和健康食品研究开发最多的藻种,小球藻中蛋白质的含量在 20%~70%之间,螺旋藻的蛋白质含量可达60%~70%。
微藻合成的色素除叶绿素以外主要有类胡萝卜素、叶黄素和虾青素等具有较高生理活性的色素[55]。红球藻Haematococcus的虾黄素 Astaxanthin、盐藻的类胡萝卜素、螺旋藻的藻兰蛋白、紫球藻Porphyridium的B2藻红蛋白以及卤腥藻和念球藻的C2藻蓝蛋白等藻类色素都具有商业开发价值。
微藻中还有抗生素、毒素和药理活性物质等。
6 产业化面临的突出问题
降低生产成本是实现生物柴油产业化的关键,这需要从原料、生产技术、副产物的高值化利用和生产规模等几个方面来考虑。
6.1 原料
原料成本占生物柴油总成本的 70%~80%。美国以转基因大豆为主要原料,欧洲国家则以油菜籽为原料,而我们国家目前只能以废弃油(地沟油、餐饮业废油等)为原料,难以实现到2020年产1 200万t生物柴油的目标。
原料是限制我国生物柴油产业化的瓶颈。尽管已对黄连木、麻疯树、文冠果、油桐、续随子等非粮油料植物开展了研究,但无论是高含油率的耐旱树种,还是规模化种植技术与规范化的推广体系都满足不了大规模生产生物柴油的需求。微藻作为生物柴油的原料具有陆生油料植物无可比拟的优势,如含油量高、生长周期短、油脂的单位面积产率高,且不占耕地。微藻的大规模、高效、低成本培养是产业化的关键技术,不仅包含通过筛选、诱变、基因工程等手段获得产油率高、生长快速的优良微藻品种,而且还涉及微藻培养的光生物反应器研制、微藻采集、油脂分离和提取等多种过程工程技术。
6.2 生产技术
均相酸、碱催化法是目前生物柴油产业化的主要生产方法,存在的主要问题是过量的醇必须回收,废酸/碱液造成环境污染。以地沟油为原料,酸催化的酯化率和碱催化的转酯率均需提高,并需避免皂化现象发生,而且产品往往需要脱色。固体酸碱催化剂能克服液体酸碱催化剂面临的困境,如催化剂可循环使用、产生的废液减少、对设备的腐蚀性降低、操作安全性提高、产品质量提高等。随着环保、廉价、高效、稳定的固体催化剂的研制,连续生产生物柴油的新工艺必将走向产业化。
生物酶法和超临界法都是相对绿色的生产方法。目前生物酶法产业化面临的主要问题是:1)酶易中毒,催化活性不稳定;2)脂肪酶的价格昂贵,造成生产成本较高。超临界甲醇能与油脂均匀混合,改善了传质性能,提高了反应速率,能获得优质产品。添加少量催化剂可以显著降低操作温度和压力,将脂肪酶与超(亚)临界相结合是一项极具挑战性的研究课题,将超临界二氧化碳应用于生物柴油制备也是值得探索的课题。
6.3 生物炼制
将油料植物、微藻等原料中的蛋白、有效药用成分等分离出来,并将纤维素成分酶解成单糖再生物利用,通过生物炼制实现资源最大化的利用,同时将生物柴油副产的甘油生物转化为 1,3-PD、二羟基丙酮等高附加值的产品。
生物炼制既有与石油炼制相类似的方面,如充分利用原料(吃干榨净),又有其独特复杂的另一面。各种有效成分的性质、含量存在明显差异,提取方法不尽相同,有些成分还需进一步生物转化,这样就需要将不同的分离方法、预处理方法和转化方法集成为一个级联、耦合的复杂工艺系统,形成一个涉及能量、物流、设备、控制等多方面的系统生物过程工程。图6给出了利用文冠果生产生物柴油的生物炼制工艺。
生物柴油的效益既包括生产过程中有价的原料、设备、人力、能耗、销售、规模等经济方面,又涉及到生物柴油生命周期内的环境因素,从油料作物的种植到生物柴油被消耗的整个过程对环境的影响,尤其是对能量和物质的利用进行评价,力求实现生物柴油具有环境友好的生命周期。
7 总结
石油资源的日益减少和价格的剧烈波动是困扰21世纪人类社会发展的一个现实问题,生物柴油是解决全球能源危机最有潜力的一种柴油替代品。从我国地少人多的国情出发,大力发展非粮油料植物或微生物是解决生物柴油生产原料的重要途径。同时,充分利用生物质原料进行生物炼制,实现生物柴油生产过程中资源的最大化利用,是实现生物柴油产业化的必然选择。当然,开发高效、环保、价廉的催化剂和绿色的生产工艺也是生物柴油产业化面临的技术挑战。致谢:感谢研究生郭峰、杨柳、王元好、宋志远、梁志霞、毛羽同学提供的素材。
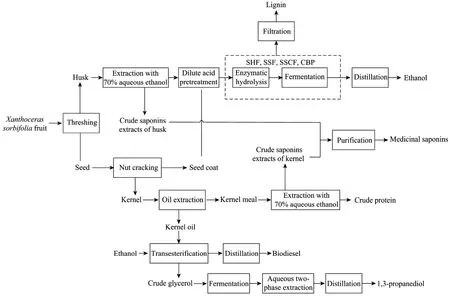
图6 以文冠果为原料的生物炼制流程图Fig.6 Schematic diagram of biorefinery forXanthoceras sorbifolia.
REFERENCES
[1]Ma FR, Hanna MA.Biodiesel production: a review.Bioresour Technol, 1999, 70: 1−15.
[2]Greg P.Biodiesel: Growing New Energy Economy.2nd ed.Vermont, USA: Chelsea Green Publishing Company,2008: 77−79.
[3]Subramanian KA, Singal SK, Saxena M,et al.Utilization of liquid biofuels in automotive diesel engines: an Indian perspective.Biomass Bioenerg, 2005, 29: 65−72.
[4]Kalam MA, Masjuki HH.Recent development on biodiesel in Malaysia.J Sci Ind Res, 2005, 64(11): 920−927.
[5]Gerpen JV.Business management for biodiesel producers.NREL Technical Report, 2004, NREL/SR-510-36342.
[6]Wang T.A survey of the woody plant resources for biomass fuel oil in China.Sci Technol Rev, 2005, 23(5): 12−14.王涛.中国主要生物质燃料油木本能源植物资源概况与展望.科技导报, 2005, 23(5): 12−14.
[7]Hou YK, Liu SY.Selection and evaluation of bio-diesel tree species in China.Forest Res, 2009, 22(1): 7−13.侯元凯, 刘松杨.我国生物柴油树种选择与评价.林业科学研究, 2009, 22(1): 7−13.
[8]Zhao JH.The survey and considerations of forest bioenergy in China.Forestry Economics, 2009,(3): 13−16.赵江红.中国林业生物质能源开发利用的调查思考.林业经济, 2009,(3): 13−16.
[9]Wu WG, Li NY.Forest-based bio-diesel development:target, current status and challenges.Sci Sil Sin, 2009,45(11): 141−147.吴伟光, 李怒云.我国林业生物柴油的发展目标、现状及面临的挑战.林业科学, 2009, 45(11): 141−147.
[10]Chen YM, Lu JD, Xiao B,et al.Exploitation and utilization of material resource of biodiesel.Energ Eng,2007,(1): 33−37.陈英明, 陆继东, 肖波, 等.生物柴油原料资源利用与开发.能源工程, 2007,(1): 33−37.
[11]Xie LH, Li PW, Zhang W,et al.A review on the development potential of bioenergy rapeseed.Chin J Biopro Eng, 2005, 3(1): 28−31.谢立华, 李培武, 张文, 等.油菜作为优势能源作物的发展潜力与展望.生物加工过程, 2005, 3(1): 28−31.
[12]Zhao ZB, Hua YY, Liu B,et al.How to secure triacylglycerol supply for Chinese biodiesel industry.China Biotechnol, 2005, 25(11): 1−6.赵宗保, 华艳艳, 刘波, 等.中国如何突破生物柴油产业的原料瓶颈.中国生物工程杂志, 2005, 25(11): 1−6.
[13]Pu HY.Research survey on functional fats and oils from microorganisms.Cereal Oil, 2003,(11): 12−14.蒲海燕.微生物功能性油脂研究概况.粮食与油脂,2003,(11): 12−14.
[14]Stephens E, Ross IL, King Z,et al.An economic and technical evaluation of microalgal biofuels.Nat Biotechnol, 2010, 28(2): 126−128.
[15]Xu H, Miao XL, Wu QY.High quality biodiesel production from heterotrophic growth ofChlorella protothecoidesin fermenters by using starch//2005 Symposium of China Bioresource Energy and Sustainable Development, 2005: 269−276.徐瀚, 缪晓玲, 吴庆余.利用淀粉水解液发酵生产工程小球藻制备生物柴油//2005年中国生物质能技术与可持续发展研讨会论文集, 2005: 269−276.
[16]Harmer MA, Sun Q, Farneth WE.High-surface-area Nafion resin/silica nanocomposites-a new class of solid acid catalyst.J Am Oil Chem Soc, 1996, 118(33): 7708−7715.
[17]Vicente G, Coteron A, Martinez M,et al.Application of the factorial design of experiments and response surface methodology to optimize biodiesel production.Ind Crop Prod, 1998, 8(1): 29−35.
[18]Ramos AM, Vital J, Castanheiro JE.Esterification of fatty acids to biodiesel over polymers with sulfonic acid groups.Appl Catal A-Gen, 2009, 359(1/2): 41−46.
[19]Chen H, Wang JF.Biodiesel preparation from transesterification of cotton seed oil by solid acids catalysis.Chin J Process Eng, 2006, 6(4): 571−575.陈和, 王金福.固体酸催化棉籽油酯交换制备生物柴油.过程工程学报, 2006, 6(4): 571−575.
[20]Kulkarni MG, Gopinath R, Meher LC,et al.Solid acid catalyzed biodiesel production by simultaneous esterification and transesterification.Green Chem, 2006,12(8): 1056−1062.
[21]Jacobson K,Gopinath R,Meher LC,et al.Solid acid catalyzed biodiesel production from waste cooking oil.Appl Catal B-Environ, 2008, 85(1/2): 86−91.
[22]Wang JH, Chen Y, Wang XH,et al.Aluminumdo decatungstophosphate(Al0.9H0.3PW12O40)nanotube as a solid catalyst one-pot production of biodiesel from waste cooking oil.Bioresour, 2009, 4(4): 1477−1486.
[23]Katad N, Hatanaka T, Ota M,et al.Biodiesel production using heteropoly acid-derived solid acid catalyst H4PNbW11O40/WO3−Nb2O5.Appl Catal A-Gen, 2009,363(1/2): 164−168.
[24]Hara M, Yoshida T, Takagaki A,et al.A carbon material as a strong protonic acid.Angew Chem Int Edit, 2004,43(22): 2955−2958.
[25]Zong MH, Duan ZQ, Lou WY,et al.Preparation of a sugar catalyst and its use for highly efficient production of biodiesel.Green Chem, 2007, 9(5): 434−437.
[26]Wu RN, Wang TH, Xiu ZL,et al.Preparation of a biomass carbon-based solid acid catalyst.Chin J Catal, 2009,30(12): 1203−1208.乌日娜, 王同华, 修志龙, 等.生物质炭基催化剂的制备.催化学报, 2009, 30(12): 1203−1208.
[27]Cantrell DG, Gillie LJ, Lee AF,et al.Structure-reactivity correlations in MgAl hydrotalcite catalysts for biodiesel synthesis.Appl Catal A-Gen, 2005, 287(2): 183−190.
[28]Brito A, Borges ME, Garin M,et al.Biodiesel production from waste oil using Mg-Al layered double hydroxide catalysts.Energ Fuel, 2009, 23: 2952−2958.
[29]Liu XJ, Piao XL, Wang YJ,et al.Calcium methoxide as a solid base catalyst for the transesterification of soybean oil to biodiesel with methanol.Fuel, 2008, 87(7): 1076−1082.
[30]Watkings RS, Lee AF, Wilson K.Li-CaO catalysed tri-glyceride transesterification for biodiesel applications.Green Chem, 2004, 6(7): 335−340.
[31]Lee DW, Park YM, Lee KY.Heterogeneous base catalysts for transesterification in biodiesel synthesis.Catal Surv Asia, 2009, 13(2): 63−77.
[32]Suppes GJ, Dasri MA, Doskocil EJ,etal.Transesterification of soybean oil with zeolite and metal catalysts.Appl Catal A-Gen, 2004, 257(2): 213−223.
[33]Aends IWCE, Sheldon RA.Activities and stabilities of heterogeneous catalysts in selective liquid phase oxidations: recent developments.Appl Catal A-Gen, 2001,212(1/2): 175−187.
[34]Guo F, Peng Z, Dai J,et al.Calcined sodium silicate as solid basic catalyst for biodiesel production.Fuel Proc Technol, 2010, 91: 322−328.
[35]Ognjanovic N, Bezbradica D, Knezevic-Jugovic Z.Enzymatic conversion of sunflower oil to biodiesel in a solvent-free system: process optimization and the immobilized system stability.Biores Technol, 2009,100(21): 5146−5154.
[36]Deng L, Nie KL, Wang F,et al.Studies on production of biodiesel by esterification of fatty acids by a lipase preparation from Candida sp.99-125.Chin J Chem Eng,2005, 13(4): 529−534.
[37]Nelson LA, Foglia TA, Marmer WN.Lipase-catalyzed production of biodiesel.J Am Oil Chem Soc, 1996, 73(9):1191−1195.
[38]Du W, Xu YY, Liu DH,et al.Comparative study on lipase-catalyzed transformation of soybean oil for biodiesel production with different acyl acceptors.J Mol Catal B-Enzym, 2004, 30(3/4): 125−129.
[39]Lee JH.Optimization of the process for biodiesel production using a mixture of immobilizedRhizopus oryzaeandCandida rugosalipases.Appl Microbiol Biot,2008, 18(12): 1927−1931.
[40]Yin JZ, Xiao M, Wang AQ,et al.Synthesis of biodiesel from soybean oil by coupling catalysis with subcritical methanol.Energ Convers Manage, 2008, 49: 3512−3516.
[41]Cavalcante-Kiany SB, Penha-Maria NC, Mendonça-Karlene KM.Optimization of transesterification of castor oil with ethanol using a central composite rotatable design(CCRD).Fuel, 2010, 89: 1172−1176.
[42]Yuan H, Yang BL, Zhu GL.Synthesis of biodiesel using microwave absorption catalysts.Energ Fuel, 2009, 23(1):548−552.
[43]Teixeira LSG, Assis JCR, Mendonca DR,et al.Comparison between conventional and ultrasonic preparation of beef tallow biodiesel.Fuel Proc Technol, 2009, 90(9): 1164−1166.
[44]Moser BR, Erhan SZ.Branched chain derivatives of alkyl oleates: tribological, rheological, oxidation, and low temperature properties.Fuel, 2008, 87: 2253−2257.
[45]Dailey ODJr, Prevost NT.Conversion of methyl oleate to branched-chain derivatives.J Am Oil Chem Soc, 2007, 84:565−571.
[46]Yoshio N, Foglia TA, Gerhard M,et al.Process for the preparation of branched chain fatty acids and esters: US,4371469.1983-02-01.
[47]Michael N, Horst E.Process for the production of branched fatty acids and esters thereof: US, 5364949.1994-11-15.
[48]Mu Y, Teng H, Zhang D,et al.Microbial production of 1,3-propanediol byKlebsiella pneumoniaeusing crude glycerol from biodiesel preparation.Biotechnol Lett, 2006,28: 1755−1759.
[49]Mu Y, Xiu ZL, Zhang DJ.A combined bioprocess of biodiesel production by lipase with microbial production of 1,3-propanediol byKlebsiella pneumoniae.Biochem Eng J, 2008, 40(3): 537−541.
[50]Himmi EH, Bories A, Boussaid L.Propionic acid fermentation of glycerol and glucose byPropionibacterium acidipropioniciandPropionibacterium freudenreichiissp.Appl Microbiol Biotechnol, 2000, 53: 435−440.
[51]Ito T, Nakashimada Y, Kakizono T,et al.High-yield production of hydrogen byEnterobacter aerogenesmutants with decreased α-acetolactate synthase activity.J Biosci Bioeng, 2004,(97): 227−232.
[52]Yang SL, Fan YQ, Sha YC,et al.Distribution and integration exploitation utilize foreground ofJatroph curcasL.resource.Southwest China J Agr Sci, 2006, 19:447−452.杨顺林, 范月清, 沙毓沧, 等.麻疯树资源的分布及综合开发利用前景.西南农业学报, 2006, 19: 447−452.
[53]Wang R, Su WB, Wang CM,et al.Optimization of extraction conditions of polyphenol from Chinese Pistache meal using response surface methodology.Food Sci, 2008,29(7): 160−165.王如, 宿文斌, 王承明, 等.黄连木饼粕粗多酚提取的响应曲面优化研究.食品科学, 2008, 29(7): 160−165.
[54]Sun Y, Lu ZX, Li JA.Literature review of researches on cultivation, utilization and basic application of Tung oil tree.Nonwood Forest Research, 2007, 25(2): 84−87.孙颖, 卢彰显, 李建安.中国油桐栽培利用与应用基础研究进展.经济林研究, 2007, 25(2): 84−87.
[55]Garcia-Gonzalez M, Moreno J, Manzano JC,et al.Production ofDunaliella salinabiomass rich in 9-cis-β-carotene and lutein in a closed tubular photobioreactor.J Biotechnol, 2005, 115(1): 81−90.
Advances in biodiesel research
Hu Teng, Ying Mu, Tiankui Yang, and Zhilong Xiu
School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, China
Received:May 30, 2010;Accepted:June 18, 2010
Supported by:National High Technology Research and Development Program of China(863 Program)(No.2007AA02Z208), National Basic Research and Development Program of China(973 Program)(No.2007CB714306).
Corresponding author:Zhilong Xiu.Tel: +86-411-84706369; E-mail: zhlxiu@dlut.edu.cn Tiankui Yang.Tel: +86-411-84708691; E-mail: tkyang@dlut.edu.cn国家高技术研究发展计划(863计划)(No.2007AA02Z208),国家重点基础研究发展计划(973计划)(No.2007CB714306)资助。

