圆红冬孢酵母两阶段培养法生产微生物油脂
林金涛,沈宏伟,张泽会,胡翠敏,靳国杰,谭海东,赵宗保,2
1 中国科学院大连化学物理研究所,大连 116023 2 大连洁净能源国家实验室(筹),大连 116023 3 中国科学院研究生院,北京 100049
圆红冬孢酵母两阶段培养法生产微生物油脂
林金涛1,3,沈宏伟1,张泽会1,3,胡翠敏1,3,靳国杰1,3,谭海东1,赵宗保1,2
1 中国科学院大连化学物理研究所,大连 116023 2 大连洁净能源国家实验室(筹),大连 116023 3 中国科学院研究生院,北京 100049
为缩短发酵时间,减少原料消耗,采用细胞增殖和油脂积累分离的两阶段模式,培养圆红冬孢酵母Rhodosporidium toruloidesAS 2.1389生产微生物油脂。结果表明,细胞增殖阶段获得的R.toruloidesAS 2.1389细胞,重悬接种在葡萄糖溶液中,可快速积累油脂,菌体油脂含量超过自身干重的55%。增殖阶段细胞的菌龄越高,产油能力越强。油脂积累阶段使用高浓度葡萄糖溶液或未灭菌的葡萄糖溶液,油脂合成可以有效进行。油脂中脂肪酸成分以含16和18个碳原子的长链脂肪酸为主,可作为制备生物柴油的新型原料。
产油酵母,两阶段培养,微生物油脂,生物柴油
Abstract:To shorten the cultivation time and reduce the consumption of raw materials for microbial lipid production, oleaginous yeastRhodosporidium toruloidesAS 2.1389 was cultivated using a two-stage culture mode, in which the cell propagation and lipid accumulation were separated.The yeast cells recovered from the propagation culture were re-suspended in glucose solution for lipid accumulation, through which lipid content over 55% of the dry cell weight was achieved, the longer the propagation stage was, the higher the lipid content.Analysis of the lipid indicated that the long-chain fatty acids with 16 and 18 carbon atoms were major components, suggesting that the lipid can be an alternative feedstock for biodiesel production.
Keywords:oleaginous yeast, two-stage culture, microbial lipid, biodiesel
当前化石资源日益枯竭,社会经济可持续发展面临能源和环境的双重压力,世界各国大力发展可再生燃料。生物柴油具有与普通柴油相近的性质,受到高度关注,在国外已有一定规模的应用。目前用于生物柴油生产的原料主要是动植物油脂。但以动植物油脂生产生物柴油面临成本高、原料总量缺口大、供给季节性强等不利于规模化生产的突出问题[1-2]。
微生物油脂,又称单细胞油脂,是由酵母、霉菌和细菌等微生物在一定的条件下,利用碳水化合物、碳氢化合物和普通油脂作为碳源,在菌体内产生的油脂[3]。自然界中一些产油微生物在碳源充足而其他营养成分(通常为氮源)缺乏情况下,可以在胞内大量积累油脂,甚至达到自身干重60%以上[4]。产油真菌积累油脂过程中可在胞内形成一个或多个油脂颗粒[4-6]。与传统油脂生产相比,微生物油脂生产有许多优点:能连续规模化生产;周期短;所需原料丰富、价格便宜、并可利用工农业废弃物;不受季节、气候变化限制;可利用细胞诱变、融合及基因工程等技术改良菌种等[7]。
在以往的实验中,产油微生物培养通常采用一步法,即细胞增殖和油脂积累在同一醪液中进行。在培养初期阶段,细胞快速增殖;中期及后期细胞增殖减慢,油脂合成仍然活跃,导致胞内油脂过量积累。Hall等[8]报道了一种两阶段培养方法,但第一阶段得到的产油酵母Candida107菌液按37.5%(V/V)的比例直接泵入第二阶段,大量残余营养成分、无机盐(尤其是 NH4+)及代谢产物带入到第二阶段。因此,细胞在第二阶段经历的生长环境变化仍然类似于常见的一步法,即细胞增殖和油脂积累过程伴随进行。
本文采用细胞增殖和油脂积累分离的两阶段模式,培养圆红冬孢酵母Rhodosporidium toruloidesAS 2.1389,生产微生物油脂。细胞增殖阶段,使用营养丰富的培养基,快速扩增菌体;油脂积累阶段,使用无额外营养物的葡萄糖溶液,在胞内积累油脂。
1 材料与方法
1.1 菌株
圆红冬孢酵母菌Rhodosporidium toruloidesAS 2.1389购自中国普通微生物菌种保藏管理中心(CGMCC)。
1.2 培养基
YEPD液体培养基组成(g/L):葡萄糖20,酵母粉10,蛋白胨20,调pH 6.0;斜面培养基在YEPD基础上加入琼脂粉20 g/L;油脂合成培养基:不同浓度的葡萄糖溶液。
1.3 培养方法
采用两阶段发酵模式:第一阶段于YEPD液体培养基中培养,以菌体生长为主;第二阶段于葡萄糖溶液中,进行油脂合成。
1)菌体生长阶段:将新鲜斜面上的圆红冬孢酵母菌接种于含50 mL YEPD液体培养基的摇瓶中,于30℃、200 r/min摇床培养。
2)菌体收集:取 0.5 mL菌液用血球记数板记数(包括芽体)。取含 5×109个细胞的菌液离心,弃上清。其中2份样品离心洗涤2次。
3)油脂合成阶段:将菌体用葡萄糖溶液重悬,接种于葡萄糖溶液中培养,温度30℃,转速200 r/min。
如无特别说明实验在250 mL摇瓶中进行,第一阶段培养36 h,第二阶段在40 g/L葡萄糖溶液中培养48 h。所有数据均为2个平行样的均值。
1.4 分析方法
1.4.1 生物量测定
发酵液离心去上清,收集沉淀,加入蒸馏水离心洗涤2次,于105℃烘至恒重,以g干菌体/L发酵液表示菌体生物量[9]。
1.4.2 油脂提取
采用酸热法,以g油/L发酵液表示油脂量,油脂含量为油脂量占生物量的质量百分数[2]。
1.4.3 残糖测定
采用山东省科学院生产的SBA-50B生物传感分析仪进行葡萄糖测定[9]。
1.4.4 油脂脂肪酸组成分析
按文献报道的方法对油脂脂肪酸进行甲酯化[9]。得到的样品利用GC 7890型气相色谱仪进行分析。色谱条件为:FFAP石英毛细管柱(30 m×0.32 mm×0.4 μm);进样器温度 250℃;进样量 0.2 μL;载气N241 mL/min,检测器(FID)温度 280℃;H233 mL/min,空气100 mL/min;柱温190℃;分流进样。脂肪酸通过对照标准样品定性,采用面积归一法确定相对含量。
2 结果与讨论
2.1 两阶段培养法生产油脂
R.toruloidesAS 2.1389在YEPD培养基培养36 h后,离心收集细胞,其中2个样品加入5 mL蒸馏水离心洗涤 2次,重悬后,于葡萄糖溶液中培养48 h。结果离心洗涤样品的耗糖量、生物量和菌体油脂含量分别为21.0 g/L、9.1 g/L和58.6%;未离心洗涤的对照组耗糖量、生物量和菌体油脂含量分别为26.5 g/L、11.0 g/L和59.0%。离心洗涤组的耗糖量和生物量明显低于对照组;但两者油脂含量相差很小。因此,推测离心洗涤样品的油脂合成能力与对照组相当,只是离心洗涤操作时由于反复离心、重悬过程中细胞有所损失,导致耗糖量和生物量偏低。
在营养缺乏的情况下,细胞通过自体吞噬将细胞内的大分子降解为游离态的核苷酸、氨基酸和脂肪酸等。氮源匮乏而葡萄糖存在的条件下,酵母细胞发生强烈的自体吞噬,细胞质及细胞器均可被降解成小分子,用于提供能量或/和维持必要的大分子合成[10]。可见脂肪合成的限氮条件也可能诱导细胞自体吞噬。并且圆红冬孢酵母可以积累超过自身干重70%以上的油脂,并形成2个或多个油脂颗粒[11];油脂颗粒几乎可以占据整个细胞,而胞质的其他部分则很少。显然,油脂颗粒形成的过程中,需要大规模的细胞质重构。最近对脂肪细胞和肝细胞的研究表明,自体吞噬缺陷导致脂肪合成及脂肪颗粒形成均被强烈抑制[12]。当多次离心洗涤后,发酵液中所含有的营养物质及其他复杂成分几乎都被去除,所以细胞需要靠自体吞噬分解部分细胞质成分,为油脂合成提供必要的中间分子,从而保证了油脂合成的进行;与此同时可以为油脂颗粒形成提供足够的空间。
尽管产油酵母细胞均可合成油脂,但是其合成过程、调节机制、油脂颗粒的形成以及与其他细胞器相互关系所知甚少[13-14]。理想的研究油脂合成的模型是用不含有细胞的酶反应系统。另一个较好的模型是用重悬的细胞体系[15],即细胞经过离心洗涤、重悬在葡萄糖溶液中进行油脂合成的两阶段培养法可成为研究油脂合成的模型。
2.2 菌龄对油脂积累的影响
细胞在YEPD培养基中分别培养24、30、36 h。细胞收集后,于40 g/L葡萄糖溶液中培养48 h。结果显示:生物量、油脂含量随菌龄的增大而增加,残糖量随菌龄的增大而降低(表 1),表明菌龄越大细胞利用葡萄糖合成油脂的能力越强。但不同菌龄细胞油脂含量没有明显差别均超过 52%。研究发现随着菌龄增加,酿酒酵母细胞的大小也随之增大[16-17]。我们对油脂积累之前样品的生物量测定也发现随着菌龄的增大,细胞生物量(5×109个细胞)也随之增加。因此不同菌龄的细胞可能具有不同的细胞大小,导致底物消耗量和油脂积累量不同。
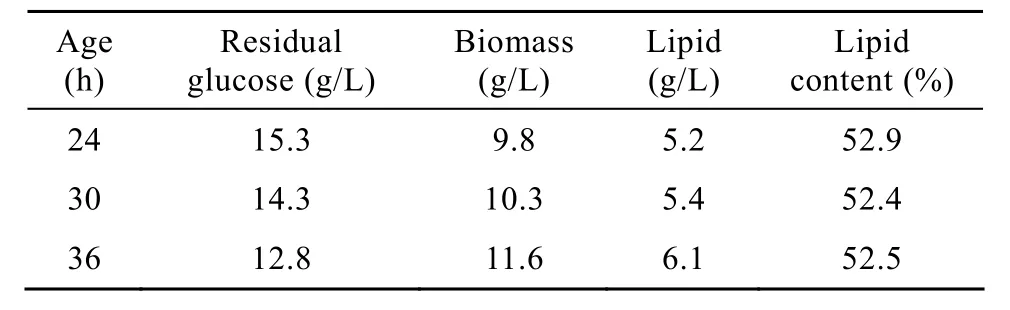
表1 菌龄对R.toruloides AS 2.1389积累油脂的影响Table 1 Effects of cell age on lipid accumulation by R.toruloides AS 2.1389
2.3 葡萄糖溶液中R.toruloides AS 2.1389油脂积累的动力学
菌龄36 h的R.toruloidesAS 2.1389细胞于40 g/L葡萄糖溶液中培养。残糖量随时间下降,生物量、油脂量、含油量随时间增加。84 h后葡萄糖耗尽,生物量、油脂量和菌体油脂含量均达到最高值,分别为13.5 g/L、8.2 g/L和60.5%(图1)。可见,底物平均消耗速率为0.476 g/(L·h),油脂平均生产速率为0.097 g/(L·h)。葡萄糖消耗曲线和油脂积累曲线近似成直线,说明整个过程中细胞利用葡萄糖和积累油脂的能力并没有发生明显降低。
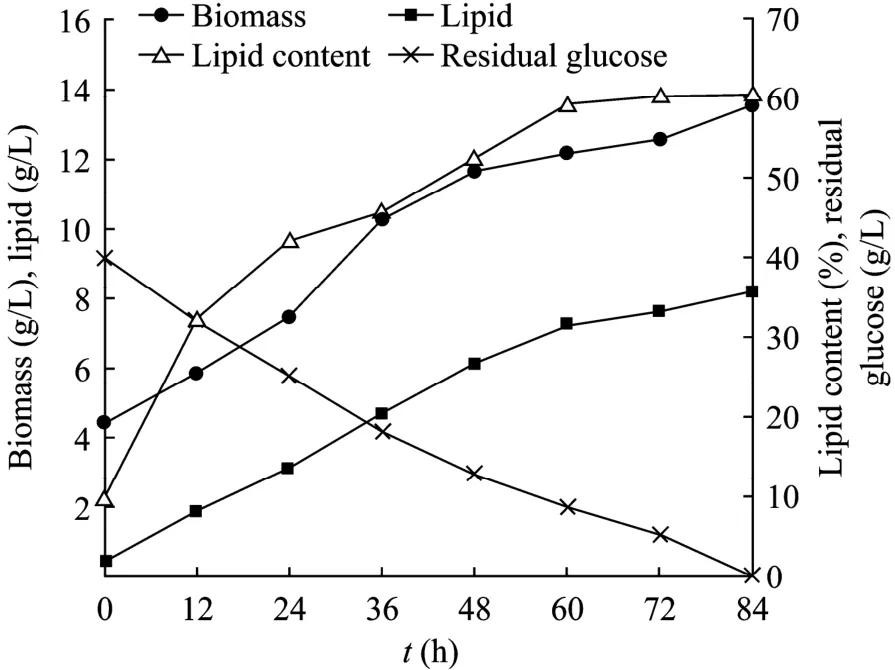
图1 葡萄糖溶液中R.toruloides AS 2.1389积累油脂的动力学曲线Fig.1 Time courses of lipid accumulation byR.toruloidesAS 2.1389 in glucose solution.
2.4 初始糖浓度对油脂积累的影响
为了揭示初始糖浓度对油脂积累的影响,在初始葡萄糖浓度为 40、60、80、100、120、150及180 g/L的溶液中培养R.toruloidesAS 2.138。48 h后,实验结果如图2所示。生物量、油脂量、菌体油脂含量随糖浓度的增加而缓慢减少。在40 g/L葡萄糖溶液中生物量、油脂量最高,分别达到11.6 g/L和6.1 g/L;在120 g/L葡萄糖溶液中生物量、油脂量分别为10.2 g/L,5.3 g/L;而在180 g/L葡萄糖溶液中生物量、油脂量最低,分别为8.3 g/L和4.2 g/L。结果表明在高糖溶液中仍然能够快速积累油脂。但当糖浓度过高时抑制作用比较明显,与以前的研究结果一致[9]。值得一提的是在深黄被孢霉、发酵性丝孢酵母的研究中也发现了高糖抑制油脂积累的现象[18-19]。其可能的原因是高浓度的糖导致高渗透压和低水活度,从而抑制细胞油脂合成[19]。
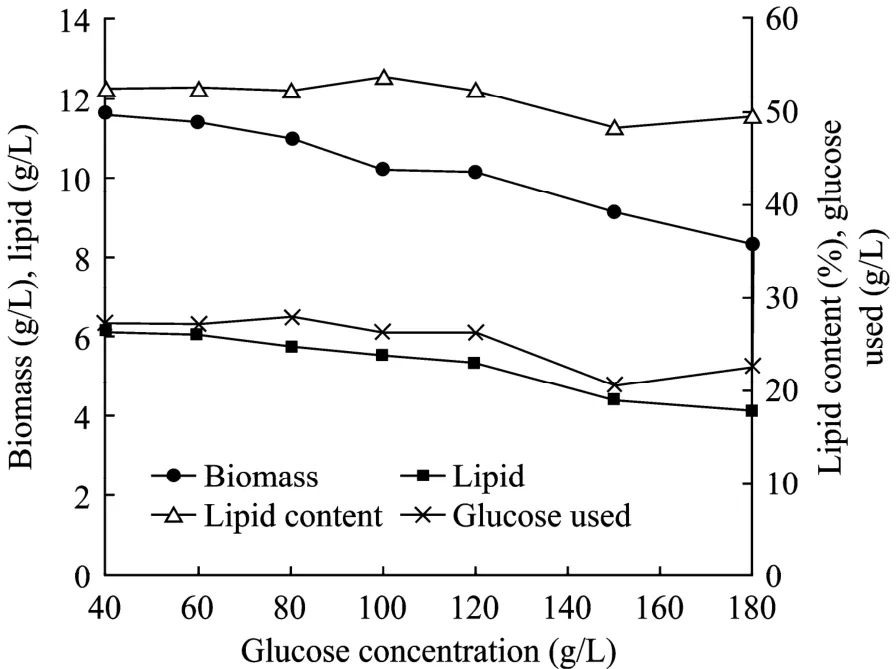
图2 糖浓度对R.toruloides AS 2.1389油脂积累的影响Fig.2 Effects of initial glucose concentration on lipid accumulation byR.toruloidesAS 2.1389.
2.5 在未灭菌的葡萄糖溶液中积累油脂
在未灭菌的葡萄糖溶液中培养48 h,细胞的生物量、油脂量和菌体油脂含量分别为 11.0 g/L、6.1 g/L和55.4%,与对照组相当(表2)。结果说明在重悬培养条件下,培养基中所含微生物细胞对油脂合成的影响不明显。
在发酵生产中染菌可能降低总体生产水平,严重时使发酵陷于瘫痪。同时染菌还对环境造成污染。防止杂菌污染是发酵过程中的一项重要工作内容[20]。采用两阶段培养模式,由于菌体增殖阶段得到的细胞经过了离心分离,细胞接种到无额外营养物的葡萄糖溶液中,环境中营养成分贫乏,杂菌难以生长。在乙醇发酵研究中发现,当酿酒酵母接种量达到3×107个/mL时,不论是否感染杂菌,对发酵产乙醇的影响都不大。提高酵母菌接种量,可以有效抑制其他杂菌的生长和代谢[21]。在我们的实验中R.toruloidesAS 2.1389细胞接种浓度高达1×108个/mL,故可以有效降低杂菌影响。因此可以降低染菌危害,节省灭菌所消耗的能量。
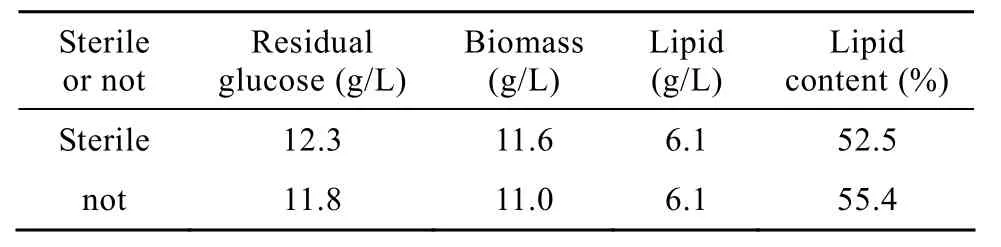
表2 在未灭菌的葡萄糖溶液中R.toruloides AS 2.1389积累油脂Table 2 Lipid accumulation by R.toruloides AS 2.1389 in non-sterile glucose solution
2.6 细胞密度对油脂积累的影响
于40 g/L葡萄糖溶液中接种R.toruloidesAS 2.1389,至细胞密度分别达到0.5×108个/mL、1×108个/mL、2×108个 /mL、 3×108个 /mL、4×108个/mL、5×108个/mL 和6×108个/mL,培养48 h。结果显示(图3),含油量随细胞密度的增加而减少,当密度为0.5×108个/mL时含油量最高达到61.3%,当密度达到6×108个/mL时含油量最低仅为14.3%,表明油脂合成能力随细胞密度的升高而下降。
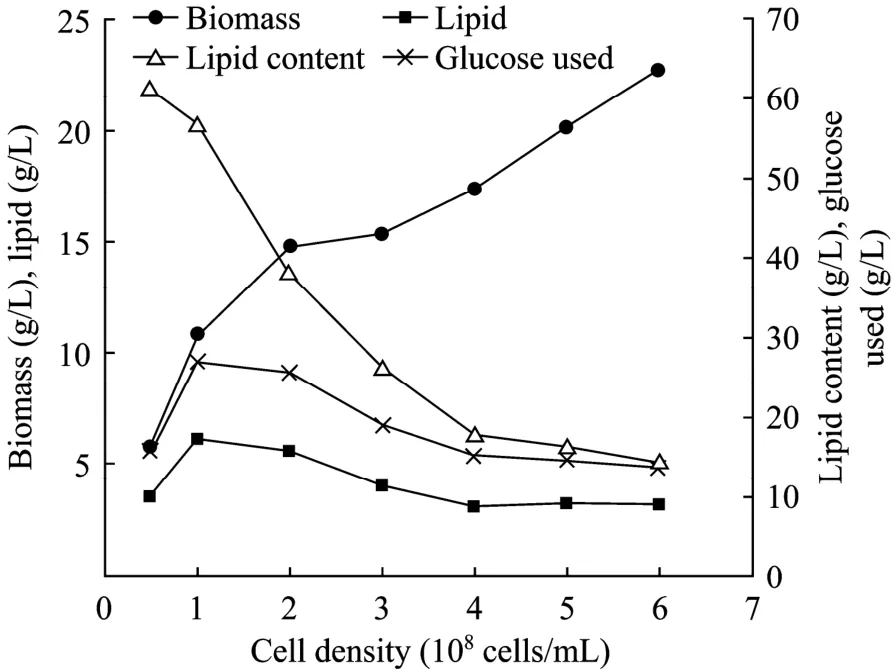
图3 细胞密度对R.toruloides AS 2.1389油脂积累的影响Fig.3 Effects of cell density on lipid accumulation byR.toruloidesAS 2.1389.
高密度培养能够提高产量,减少杂菌污染的风险。但同时也有多种缺点,如:底物抑制、代谢副产物抑制、氧气供给不足和二氧化碳的高溶解率等[22]。油脂合成需要消耗氧气,摇瓶发酵氧气传递效率低,氧气供应不足。因此,提高发酵密度后,R.toruloidesAS 2.1389细胞可能处于低氧环境,限制了油脂合成速度。
2.7 油脂脂肪酸组成分析
采用气相色谱对R.toruloidesAS 2.1389菌油的典型样品进行脂肪酸组成分析。结果表明,样品中含有棕榈酸(35.9%)、棕榈油酸(3.6%)、硬脂酸(5.5%)油酸(52.4%)、亚油酸(1.3%)及少量未知脂肪酸(1.4%)。总体上看,菌油脂肪酸组成与以前报道的结果相似,可用作生物柴油和油脂化工行业的原料[9,23]。
3 结论
发现Rhodosporidium toruloidesAS 2.1389细胞可以在无额外营养物的葡萄糖溶液保持油脂积累活性,菌体油脂含量可超过细胞干重的55%。在此基础上建立了细胞增殖和油脂积累分离的两阶段油脂生产模式。该培养模式下由于菌体生长与油脂合成分步进行,为进一步开展过程优化,降低微生物油脂生产成本提供了新方向。在油脂积累阶段,由于几乎没有菌体增殖行为,代谢活动可能主要与油脂合成相关,为研究产油微生物脂肪代谢提供很好的模型。
REFERENCES
[1]Schubert C.Can biofuels finally take center stage?Nat Biotechnol, 2006, 24(7): 777−784.
[2]Hua YY, Zhao X, Zhao J,et al.Lipid production byRhodosporidium toruloidesusing Jerusalem artichoketubers.China Biotechnol, 2007, 27(10): 59−63.华艳艳, 赵鑫, 赵金, 等.圆红冬孢酵母发酵菊芋块茎产油脂的研究.中国生物工程杂志, 2007, 27(10):59−63.
[3]Xing DH, Pan AL, Xue DH,et al.Biomass carbohydrates assimilation and lipid accumulation byMortierella isabellina.Chin J Biotech, 2010, 26(2): 189−193.邢大辉, 潘安龙, 薛冬桦, 等.深黄被孢霉利用不同碳源产油脂比较.生物工程学报, 2010, 26(2): 189−193.
[4]Meng X, Yang JM, Xu X,et al.Biodiesel production from oleaginous microorganisms.Renew Energ, 2009, 34(1):1−5.
[5]Kamisaka Y, Noda N, Sakai T,et al.Lipid bodies and lipid body formation in an oleaginous fungus,Mortierella ramannianavar.angulispora.Biochim Biophys Acta,1999, 1438(2): 185−198.
[6]Murphy DJ, Vance J.Mechanisms of lipid body formation.Trends Biochem Sci, 1999, 24(3): 109−115.
[7]Xue FY, Zhang X, Tan TW.Research advance and prospect in microbial oils.Chin J Bioproc Eng, 2005, 3(1):23−27.薛飞燕, 张栩, 谭天伟.微生物油脂的研究进展及展望.生物加工过程, 2005, 3(1): 23−27.
[8]Hall MJ, Ratledge C.Lipid-accumulation in an oleaginous yeast(Candida-107)growing on glucose under various conditions in a one-stage and 2-stage continuous culture.Appl Environ Microbiol, 1977, 33(3): 577−584.
[9]Li YH, Zhao ZB, Bai FW.High-density cultivation of oleaginous yeastRhodosporidium toruloidesY4 in fed-batch culture.Enzyme Microb Technol, 2007, 41(3):312−317.
[10] Hamasaki M, Noda T, Baba M,et al.Starvation triggers the delivery of the endoplasmic reticulum to the vacuole via autophagy in yeast.Traffic, 2005, 6(1): 56−65.
[11]Li YH, Liu B, Zhao ZK,et al.Optimization of culture conditions for lipid production byRhodospridium toruloides.Chin J Biotech, 2006, 22(4): 650−656.李永红, 刘波, 赵宗保, 等.圆红冬孢酵母菌发酵产油脂培养基及发酵条件的优化研究.生物工程学报, 2006,22(4): 650−656.
[12]Shibata M, Yoshimura K, Furuya N,et al.The MAP1-LC3 conjugation system is involved in lipid droplet formation.Biochem Biophys Res Commun, 2009, 382(2): 419−423.
[13]Czabany T, Athenstaedt K, Daum G.Synthesis, storage and degradation of neutral lipids in yeast.Biochim Biophys Acta, 2007, 1771(3): 299−309.
[14]Beopoulos A, Cescut J, Haddouche R,et al.Yarrowria lipolyticaas a model for bio-oil production.Prog Lipid Res, 2009, 48(6): 375−387.
[15]Bajpai P, Agrawala PK, Vishwanathan L.Production of kojic acid by resuspended mycelia ofAspergillus flavus.Can J Microbiol.1982, 28(12): 1340−1346.
[16]Barker MG, Smart KA.Morphological changes associated with the cellular aging of a brewing yeast strain.J Am Soc Brew Chem, 1996, 54(2): 121−126.
[17]Verbelen PJ, Dekoninck TML, Van Mulders SE,et al.Stability of high cell density brewery fermentations during serial repitching.Biotechnol Lett, 2009, 31(11):1729−1737.
[18] Papanikolaou S, Komaitis M, Aggelis G.Single cell oil(SCO)production byMortierella isabellinagrown on high-sugar content media.Bioresour Technol, 2004, 95(3):287−291.
[19]Zhu LY, Zong MH, Wu H.Efficient lipid production withTrichosporon fermentansand its use for biodiesel preparation.Bioresour Technol, 2008, 99(16): 7881−7885.
[20]Bischoff KM, Liu SQ, Leathers TD,et al.Modeling bacterial contamination of fuel ethanol fermentation.Biotechnol Bioeng, 2009, 103(1): 117−122.
[21]Narendranath NV, Power R.Effect of yeast inoculation rate on the metabolism of contaminating lactobacilli during fermentation of corn mash.J Ind Microbiol Biotechnol, 2004, 31(12): 581−584.
[22]Ordaz L, Lopez R, Melchy O,et al.Effect of high-cell-density fermentation ofCandida utilison kinetic parameters and the shift to respiro-fermentative metabolism.Appl Microbiol Biotechnol, 2001, 57(3):374−378.
[23]Liu B, Zhao ZK.Biodiesel production by direct methanolysis of oleaginous microbial biomass.J Chem Technol Biotechnol, 2007, 82(8): 775−780.
科学出版社科学出版中心生命科学分社新书推介
基因克隆与操作
(生命科学前沿丛书)(原书第二版)
(英)克里斯托弗·豪 著 李慎涛 等译
978-7-03-027438-0 ¥55.00 2010年5月
内容简介
本书作者克里斯托弗·豪是剑桥大学植物与微生物生物化学专业的教授,教授分子生物学达20年。本书是对第一版的完全更新,反映了基因克隆和操作领域最新的进展,对重组DNA技术进行了全面而简洁的介绍:首先阐释了生物化学的基本原理;然后介绍了PCR以及使用大肠杆菌宿主和质粒、噬菌体和杂合载体进行克隆;之后介绍了文库的构建和筛选,以及如何对克隆化序列进行改造、灭活和表达;最后讨论了在许多其他生物中进行的遗传操作,包括细菌、真菌、藻类,以及植物、昆虫和哺乳动物。
本书是为要使用重组DNA技术的高年级本科生、研究生和科研工作者而作,重点放在特定类型克隆载体上,以帮助读者理解并能够在新的实验状态下提出适当的策略。本书还介绍了一系列“现实的” 生物学问题,以使读者能够评估自己对知识的理解并准备考试。

欢迎各界人士邮购科学出版社各类图书(免邮费)
邮购地址:北京东黄城根北街16号 科学出版社 科学出版中心 生命科学分社 邮编:100717
联系人:周文宇(010-64031535)
网上订购:www.dangdang.com www.joy.com www.amazon.cn www.beifabook.com
更多精彩图书请登陆网站http://www.lifescience.com.cn,欢迎致电索要书目
Journals.im.ac.cn
Microbial lipid production by Rhodosporidium toruloides in a two-stage culture mode
Jintao Lin1,3, Hongwei Shen1, Zehui Zhang1,3, Cuimin Hu1,3, Guojie Jin1,3, Haidong Tan1,and Zongbao K.Zhao1,2
1 Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China 2 Dalian National Laboratory for Clean Energy, Dalian 116023, China 3 Graduate University of Chinese Academy of Sciences, Beijing 100049, China
Received:May 21, 2010;Accepted:June 18, 2010
Corresponding author:Zongbao K.Zhao.Tel/Fax: +86-411-84379211; E-mail: zhaozb@dicp.ac.cn

