丙酮丁醇梭菌发酵菊芋汁生产丁醇
陈丽杰,辛程勋,邓攀,任剑刚,梁环环,白凤武
1 大连理工大学生命科学与技术学院,大连 116024 2 大庆九环生物新能源有限公司,大庆 163511
丙酮丁醇梭菌发酵菊芋汁生产丁醇
陈丽杰1,辛程勋2,邓攀1,任剑刚1,梁环环1,白凤武1
1 大连理工大学生命科学与技术学院,大连 116024 2 大庆九环生物新能源有限公司,大庆 163511
对丙酮丁醇梭菌Clostridium acetobutylicumL7发酵菊芋汁酸水解液生产丁醇进行了初步研究。实验结果表明,以该水解液为底物生产丁醇,不需要添加氮源和生长因子。当水解液初始糖浓度为48.36 g/L时,其发酵性能与以果糖为碳源的对照组基本相同,发酵终点丁醇浓度为8.67 g/L,丁醇、丙酮和乙醇的比例为0.58∶0.36∶0.06,但与以葡萄糖为碳源的对照组相比,发酵时间明显延长,表明该菌株葡萄糖转运能力强于果糖。当水解液初始糖浓度提高到62.87 g/L时,发酵终点残糖浓度从3.09 g/L增加到3.26 g/L,但丁醇浓度却提高到11.21 g/L,丁醇、丙酮和乙醇的比例相应为0.64∶0.29∶0.05,表明适量糖过剩有助于C.acetobutylicumL7胞内代谢从丙酮合成向丁醇合成途径调节;继续提高水解液初始糖浓度,发酵终点残糖浓度迅速升高,丁醇生产的技术经济指标受到明显影响。
丙酮丁醇梭菌,菊芋汁水解液,丁醇发酵
Abstract:Butanol production from acid hydrolysate of Jerusalem artichoke juice byClostridium acetobutylicumL7 was investigated, and it was found that natural components of the hydrolysate were suitable for solvent production with the species.With batch fermentation using the medium containing 48.36 g/L total sugars, 8.67 g/L butanol was produced at 60 h, and the ratio of butanol to acetone to ethanol was 0.58:0.36:0.06, which were similar to the fermentation with fructose as carbon source, but both of these two fermentations were slower than that with glucose as carbon source, indicating the fructose transport of the species might not be effective as that for glucose.When the total sugars of the medium were increased to 62.87 g/L, the residual sugars increased slightly from 3.09 g/L to 3.26 g/L, but butanol production of the fermentation system was improved significantly, with 11.21 g/L butanol produced and the ratio of butanol to acetone to ethanol at 0.64:0.29:0.05, which illustrated that an excess in sugars enhanced the butanol biosynthesis of the species by compromising its acetone production.When the sugar concentration of the medium was further increased, much more sugars were remained unconsumed, making the process economically unfavourable.
Keywords:Clostridium acetobutylicum, hydrolysate of Jerusalem artichoke juice, butanol fermentation
与乙醇相比,丁醇具有能量密度高、亲水性弱、腐蚀性小、更易与汽油或柴油混合等优点,更适宜于作为发动机燃料,因此被认为是第 2代生物燃料[1]。目前丁醇主要以淀粉质原料如玉米、小麦、黍米等和糖质原料如糖蜜生产[2],原料成本高的问题十分突出。此外,与燃料乙醇一样,以粮食类淀粉质原料大规模生产丁醇作为燃料,也会产生影响粮食安全的社会问题。开发廉价的、非粮生物质原料,是发展丁醇作为生物燃料的必然出路。
菊芋Jerusalem artichoke,又名洋姜或鬼子姜,为菊科向日葵属多年生宿根性草本植物,其生态适应性强,耐旱、耐寒、耐盐碱,能够在不适宜于粮食和经济作物生长的盐碱地、滩涂地等边际土地上种植,生物量产量高[3]。鲜菊芋块茎中含水70%~80%,碳水化合物15%~20%,以菊粉的形式存在。菊粉(Inulin),又称菊糖,是由D-果糖经β-2,1糖苷键连接的聚合度不高的聚果糖,末端为一个葡萄糖残基[4]。与目前国内外普遍关注的以农作物秸秆为代表的木质纤维素类生物质原料相比,菊芋易被酸或菊粉酶水解而生成果糖和葡萄糖的混合物,是生产果糖、果糖基产品和微生物发酵生产生物燃料和生物基化学品等的良好原料[5]。
以菊芋块茎为原料生产乙醇的研究工作在国内外均有报道[6-7],然而鲜菊芋块茎含水量高,直接水解获得的糖难以满足乙醇发酵对高浓度底物的要求,但却可以很好地满足丁醇发酵的要求。由于丁醇发酵梭菌没有菊粉酶生产能力,不能水解菊芋中的菊粉多糖,因此生产丁醇时需要对菊芋原料进行水解。本文以菊芋汁稀酸水解糖为底物,研究其发酵生产丁醇的可行性,为第 2代生物燃料丁醇生产开辟新的原料来源。
1 材料与方法
1.1 实验材料
1.1.1 菌种
本实验室驯化保存的丙酮丁醇梭状芽胞杆菌Clostridium acetobutylicumL7。
1.1.2 实验原料
菊芋汁:鲜菊芋块茎直接压榨,由中国科学院大连化学物理研究所杜昱光教授提供。
1.2 实验方法
1.2.1 培养基配制
葡萄糖培养基(g/L):葡萄糖50,乙酸铵2.3,K2HPO40.5,KH2PO40.5,MgSO4·7H2O 0.2,邻氨基苯甲酸0.01,生物素0.01,初始pH 5.5。
果糖培养基(g/L):果糖 50,乙酸铵 2.3,K2HPO40.5,KH2PO40.5,MgSO4·7H2O 0.2,邻氨基苯甲酸0.01,生物素0.01,初始pH 5.5。
菊芋汁用硫酸调节至 pH值2.0~3.0,沸水浴保温维持60 min使菊粉水解,用NaOH调节水解液至pH 6.0,即得菊芋汁水解液(Hydrolysate of Jerusalem artichoke juice,HJA),于121℃蒸汽灭菌20 min,冷却后保存备用。将准备好的菊芋汁水解液稀释到所需的糖浓度,添加对照培养基中除碳源外的其他成分,用少量硫酸调节其初始pH 5.5。
以上培养基接种前均在 121℃下蒸汽灭菌15 min。
1.2.2 培养方法
菌种活化培养:将1 mL冷冻保藏的菌种接种于20 mL玉米醪试管培养基中,沸水浴下处理1~2 min,在温度37.5℃下厌氧活化培养,自然pH值。
摇瓶培养:将活化好菌种以体积比10%的接种量接种于100 mL发酵培养基中,充无菌氮气10 min,于温度37.5℃,150 r/min摇床培养,初始pH为5.5。
发酵罐培养:在2.5 L发酵罐(KF-2.5)中进行,装液量为1 L,接种量10%(V/V),搅拌转速150 r/min,发酵温度37.5℃,初始pH 5.5。接种后向发酵罐中通入无菌氮气30 min,以保证发酵罐内的厌氧环境。
1.2.3 糖的测定
糖浓度测定采用DNS法[8]。对葡萄糖为碳源的培养基和发酵液,其标准曲线使用葡萄糖标准溶液绘制;以果糖和菊芋汁水解液为碳源的培养基和发酵液,其标准曲线使用果糖标准溶液绘制。样品离心处理后,取适当稀释的上清液1 mL,加入1 mL水,再加入1.5 mL DNS试剂,摇匀,沸水浴5 min,立即冷却至室温,加蒸馏水至25 mL,摇匀,540 nm测吸光度,根据相应的标准曲线计算样品糖浓度。
接种后立即取样,测定初始糖浓度;发酵过程中或发酵结束后取样,测定发酵液中残糖浓度。
1.2.4 生物量的测定
摇瓶发酵由于菌体浓度低,且发酵液中含有的少量固形物对生物量测定干扰严重,因此严格控制实验组与对照组接种量和其他实验条件,比较添加氮源和维生素对溶剂生产的影响。发酵罐培养过程生物量测定方法如下:取2.5 mL发酵液离心,12 000 r/min离心5 min后,用去离子水洗涤2次,在85℃下干燥至恒重。
1.2.5 溶剂测定方法
用气相色谱 HP-INNOWAX(19091N-233)测定溶剂各组分,FID检测器。色谱条件:毛细管色谱柱(30 m×0.25 mm×0.50 µm),柱温 100℃;进样温度250℃;FID检测器温度300℃,H2流速40 mL/min,空气流速400 mL/min;载气N2流速30 mL/min;进样量0.2 µL,分流比50∶1。采用内标法定量,内标物为异丁醇。
2 结果与讨论
发酵培养基组成对C.acetobutylicum生长和溶剂生产各个环节的调控至关重要。目前以玉米为原料生产丁醇,按照发酵要求浓度调配的粉浆蒸煮后,冷却到发酵温度即可使用,无需添加任何营养组分。与玉米原料相比,菊芋块茎灰分偏高,磷含量足以满足需求,但蛋白含量很低,因此以菊芋汁为发酵底物是否需要补充氮源,需要通过实验来确定。此外,已有研究工作表明生物素和氨基苯甲酸是C.acetobutylicum菌体生长和溶剂生产必需的维生素[9],但菊芋汁水解液作为发酵底物是否需要添加这两种维生素尚未见报道。
2.1 氮源对菊芋汁丁醇生产的影响
添加乙酸盐有助于溶剂生产[10],因此乙酸铵是C.acetobutylicum培养的良好氮源。表1所示为向培养基中添加2.3 g/L乙酸铵时批式发酵的实验结果。可见,与对照组相比,添加乙酸铵没有明显促进溶剂,特别是丁醇的生产,表明菊芋汁水解液作为底物培养C.acetobutylicumL7生产丁醇不需要添加氮源。
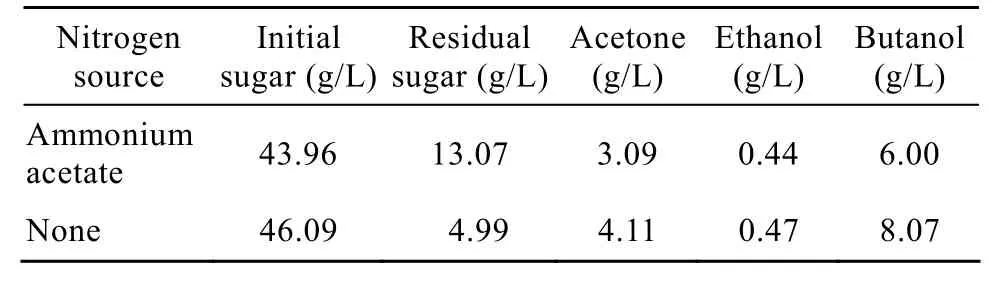
表1 培养基中氮源对菊芋汁丁醇发酵的影响Table 1 Effect of nitrogen sources on butanol production from Jerusalem artichoke juice hydrolysate by C.acetobutylicum L7
2.2 邻氨基苯甲酸和生物素对菊芋汁水解液丁醇生产的影响
表2所示为菊芋汁酸水解液中添加邻氨基苯甲酸和生物素对溶剂生产的影响。可见,与未添加这两种维生素的对照组相比,不论是单独添加还是混合添加,均没有显著影响,表明菊芋汁水解液作为底物培养C.acetobutylicumL7生产丁醇不需要添加这两种维生素。
可见,尽管菊芋块茎的营养组份不如玉米丰富,但足以满足C.acetobutylicumL7培养生产丁醇的需要,这对降低丁醇生产成本十分有利。
2.3 菊芋汁水解液为底物发酵生产丁醇
菊芋汁水解液是以果糖和葡萄糖为主要成分的混合糖,其发酵过程糖消耗、菌体生长和溶剂各组分生成情况图1~5所示。
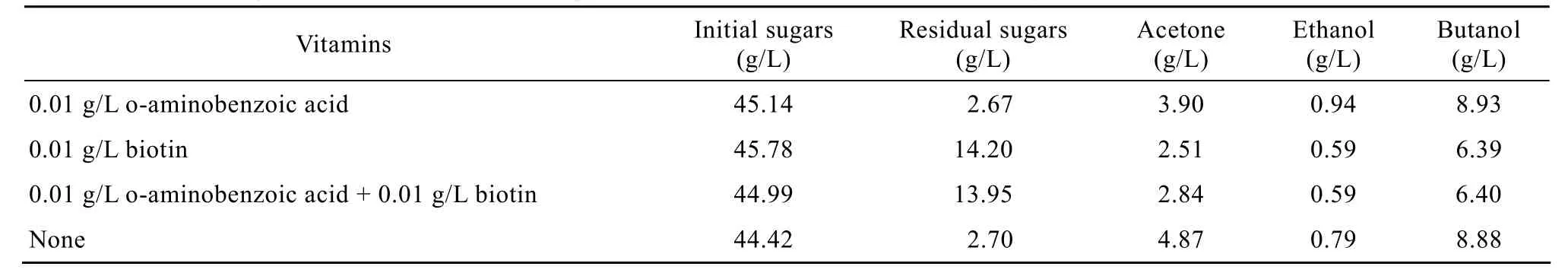
表2 培养基中生长因子对菊芋汁丁醇发酵的影响Table 2 Effect of growth factors on butanol production from Jerusalem artichoke juice hydrolysate by C.acetobutylicum L7
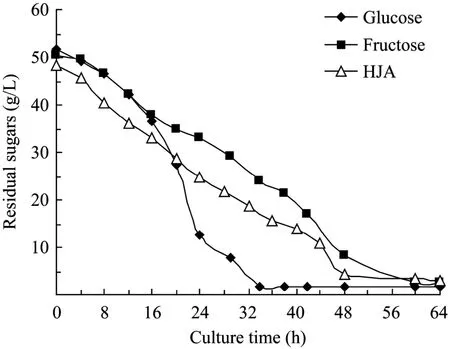
图1 丙酮丁醇梭菌发酵过程残糖浓度的变化Fig.1 Time course of residual sugars during butanol production byC.acetobutylicumL7.
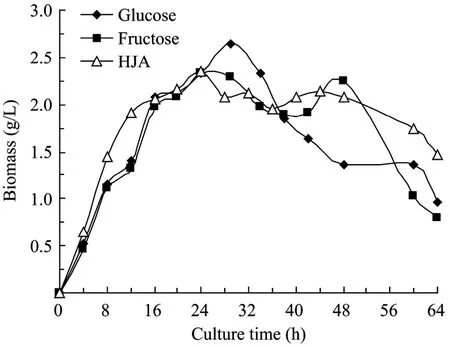
图2 丙酮丁醇梭菌发酵过程生物量浓度的变化Fig.2 Time course of biomass during butanol production byC.acetobutylicumL7.
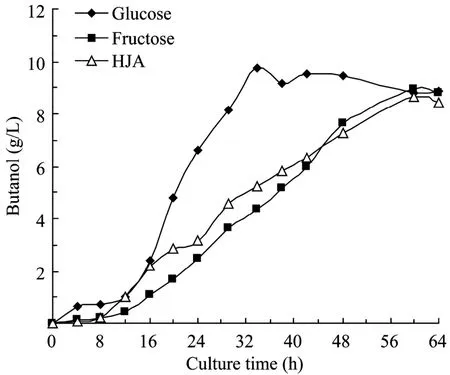
图3 丙酮丁醇梭菌发酵生产丁醇Fig.3 Time course of butanol production byC.acetobutylicumL7.
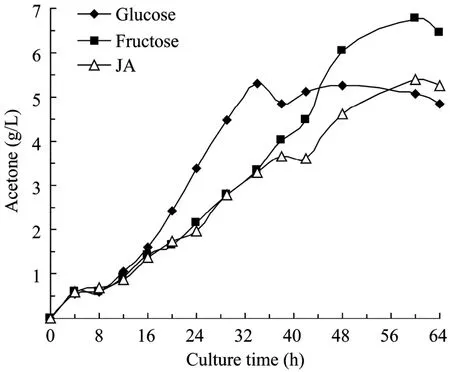
图4 丙酮丁醇梭菌发酵生产丙酮Fig.4 Time course of acetone production byC.acetobutylicumL7.
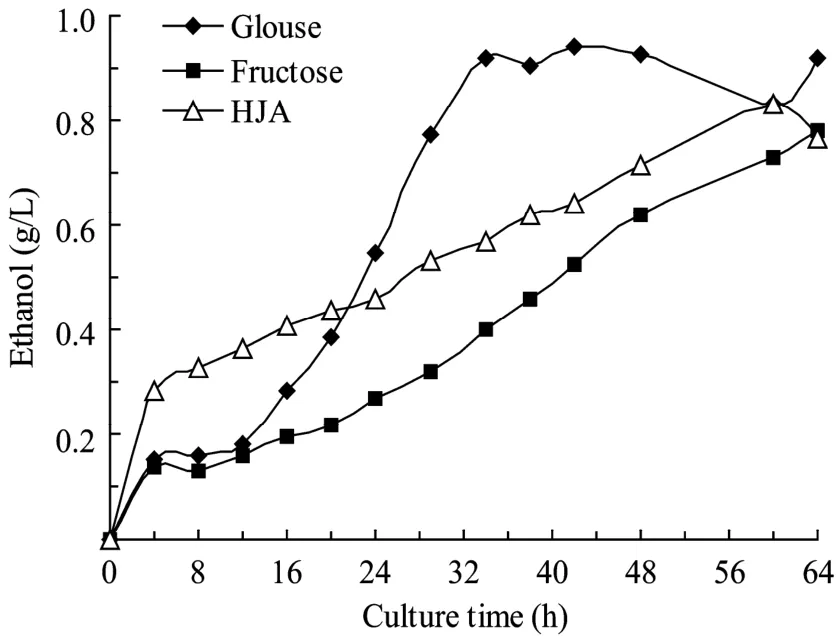
图5 丙酮丁醇梭菌发酵生产乙醇Fig.5 Time course of ethanol production byC.acetobutylicumL7.
从图1可见,以菊芋汁水解液为底物时,糖消耗进程与以果糖为碳源的培养基一致,因为菊芋汁水解液混合糖的主要组分是果糖,但在培养进入到约16 h时,菌体生长开始进入静止期(图2),以葡萄糖为碳源的培养基糖消耗速率比果糖和菊芋汁水解液为碳源的培养基快,而此时产物丁醇开始大量合成,如图3所示,至34 h丁醇浓度到最大值9.73 g/L;而以果糖和菊芋汁酸水解液为碳源的培养基,丁醇生成相对缓慢,发酵至60 h丁醇浓度分别达到最大值8.93 g/L和8.67 g/L,表明C.acetobutylicum在丁醇合成阶段葡萄糖代谢速率比果糖快,但其机理有待建立胞内代谢网络,分析相关代谢途径通量分布来阐明。
丙酮和乙醇是C.acetobutylicum丁醇发酵的共生产物。图4和图5的实验结果表明,丙酮和乙醇与丁醇生成同步。以葡萄糖为底物时,其最高浓度分别为7.32 g/L和0.92 g/L,而以果糖为底物时,分别为6.75 g/L和0.73 g/L,当以菊芋汁水解液为底物时,分别为5.41 g/L和0.83 g/L。
丁醇、丙酮和乙醇的比例是衡量丁醇发酵水平的主要指标之一,发酵终点丁醇的比例越高,其生产的技术经济指标就越好。目前国内外实验室研究普遍使用的C.acetobutylicum菌株,其发酵终点丁醇、丙酮和乙醇的比例一般在 6∶3∶1的水平,而生产上使用的工业菌株可以使丁醇、丙酮和乙醇的比例维持在 7∶2∶1的水平。菊芋汁水解液发酵溶剂各组分的比例如表 3所示,可见与果糖为碳源的培养基相比基本相同,但与葡萄糖为碳源相比,丁醇比例略低,而丙酮比例有所提高。值得注意的是,这3种不同碳源培养基发酵结束时,乙醇生成比例基本相同,占总溶剂的比例约 5%,而以往研究工作报道乙醇占总溶剂的比例约10%,目前正在对这一现象进行分析。
2.4 高浓度菊芋汁水解液发酵生产丁醇
丁醇对菌体具有强抑制效应,导致发酵终点产物浓度低,是丁醇生产能耗高的主要原因。提高培养基初始糖浓度,是提高发酵液丁醇浓度的前提条件。表4所示为菊芋汁水解液中不同初始糖浓度发酵生产丁醇的实验结果,可见当糖浓度提高到62.87 g/L时,虽然发酵时间延长到84 h,但丁醇浓度从8.67 g/L增加到11.21 g/L,继续提高糖浓度到95.63 g/L时,虽然丁醇浓度略有增加,达到12.56 g/L,但此时发酵液残糖浓度已经高达37.00 g/L,呈严重过剩状态。另一方面,随底物初始糖浓度的提高,丁醇占总溶剂的比例增加,丙酮生成比例相应减少,表明发酵过程糖过剩有利于C.acetobutylicumL7胞内代谢从丙酮合成向丁醇合成途径调节,但糖过剩不仅导致原料的浪费,增加丁醇生产的原料消耗,而且增加发酵醪精馏操作分离丁醇的难度。因此,优化培养基初始糖浓度,使其适量过剩以提高总溶剂中丁醇的比例,对丁醇生产十分重要。
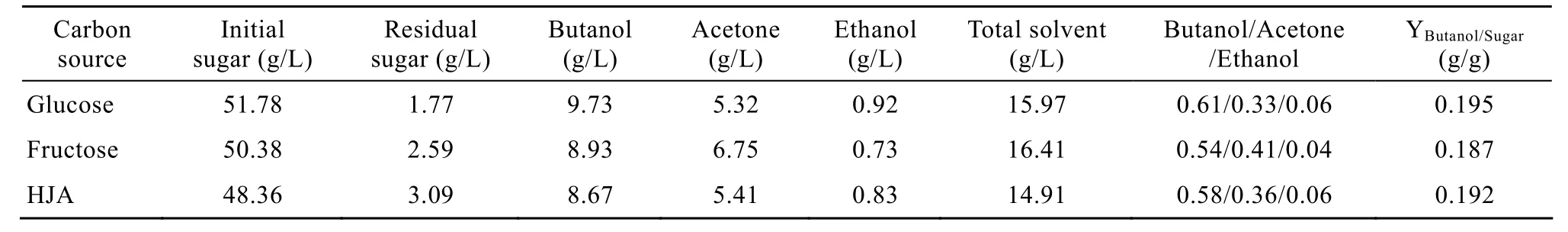
表3 菊芋汁水解液、葡萄糖和果糖作为碳源发酵丁醇性能的比较Table 3 Effect of different carbon sources on butanol production by C.acetobutylicum L7
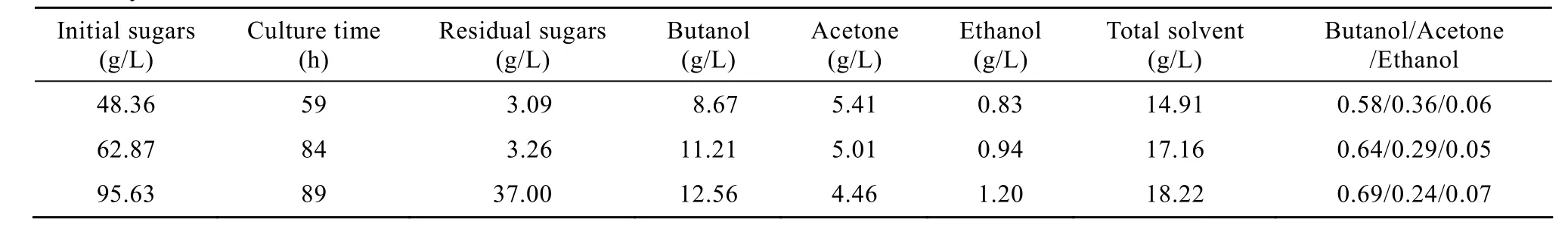
表4 C.acetobutylicum L7发酵不同糖浓度菊芋汁酸水解液生产丁醇Table 4 Effect of initial sugar concentration of Jerusalem artichoke juice hydrolysate on butanol production by C.acetobutylicum L7
3 展望
菊芋汁水解液作为C.acetobutylicumL7培养生产丁醇的底物,其发酵性能与以果糖为碳源的培养基相似,且其天然营养组分可以满足菌体生长和丁醇生产的基本要求,有助于工业生产过程节省辅助原料消耗,降低生产成本。
丁醇生产面临的最大问题是成本高。降低丁醇生产成本可以从两方面入手:一是开发高浓度发酵技术,提高发酵醪中丁醇浓度,节省能耗;二是提高总溶剂中丁醇比例,节省原料消耗。以菊芋为原料生产丁醇,不论是菊芋汁,还是直接使用菊芋块茎,围绕提高发酵终点丁醇浓度和总溶剂中丁醇比例,都有大量的研究工作需要开展,但这一原料体系与以秸秆为代表的木质纤维素类生物质相比,易于处理获得可发酵性糖,与粮食类淀粉质原料相比,其种植不挤占耕地,不会产生影响粮食安全的问题,因此菊芋原料生产丁醇的基础研究和技术开发将越来越被关注。
REFERENCES
[1]Dürre P.Biobutanol: an attractive biofuel.Biotechnol J,2007, 2: 1525−1534.
[2]Jones DT, Woods DR.Acetone-butanol fermentation revisited.Microbiol Rev, 1986, 50: 484−524.
[3]Long XH, Liu ZP, Wang L,et al.Effects of seawater irrigation on yield composition and ion distribution of different varieties of helianthus tuberosus in coastal mudflat of semiarid region.Acta Pedol Sin, 2007, 44:300−306.隆小华, 刘兆普, 王琳, 等.半干旱地区海涂海水灌溉对不同品系菊芋产量构成及离子分布的影响.土壤学报, 2007, 44: 300−306.
[4]Khodzhaeva MA, Kondratenko ES.The structure of the inulin fromInula grandis.Chem Nat Compd, 1982, 3:394−395.
[5]Denoroy P.The crop physiology ofHelianthus tuberosusL.: a model orientated view.Biomass Bioenerg, 1996, 11:11−32.
[6]Nakamura T, Ogata Y, Hamada S,et al.Ethanol production from Jerusalem artichoke tubers byAspergillus niger andSaccharomyces cerevisiae.J Ferment Bioeng,1996, 81: 564−566.
[7]Caserta G, Cervigni T.The use of Jerusalem artichoke stalks for the production of fructose or ethanol.Bioresource Technol, 1991, 35: 247−250.
[8]Miller GL.Use of dinitrosalicylic acid reagent for determination of reducing sugar.Anal Chem, 1959, 31:426−428.
[9]Soni BK, Soucaille P, Goma G.Continuous acetone-butanol fermentation: influence of vitamins on the metabolic activity ofClostridium acetobutylicum.Appl Microbiol Biotechnol, 1987, 27: 1−5.
[10]Chen CK, Blaschek HP.Acetate enhances solvent production and prevents degeneration inClostridum beijerinckiiBA101.Appl Microbiol Biotechnol, 1999, 52:170−173.
Butanol production from hydrolysate of Jerusalem artichoke juice by Clostridium acetobutylicum L7
Lijie Chen1, Chengxun Xin2, Pan Deng1, Jiangang Ren1, Huanhuan Liang1, and Fengwu Bai1
1 School of Life Science and Biotechnology, Dalian University of Technology, Dalian 116024, China 2 Daqing Nine Ring Bio New Energy Co., Ltd., Daqing 163511, China
Received:May 17, 2010;Accepted:June 13, 2010
Corresponding author:Fengwu Bai.Tel/Fax: +86-411-84706329; E-mail: fwbai@dlut.edu.cn

