生物丁醇制造技术现状和展望
顾阳,蒋宇,,吴辉,刘旭东,李治林,李键,肖晗,沈兆兵,赵静波,杨蕴刘,姜卫红,,杨晟,
1 中国科学院上海生命科学研究院植物生理生态研究所,上海 200032 2 上海工业生物技术研发中心,上海 201201
生物丁醇制造技术现状和展望
顾阳1,蒋宇1,2,吴辉1,刘旭东1,李治林1,李键1,肖晗1,沈兆兵2,赵静波1,杨蕴刘1,姜卫红1,2,杨晟1,2
1 中国科学院上海生命科学研究院植物生理生态研究所,上海 200032 2 上海工业生物技术研发中心,上海 201201
丁醇是大宗基础化工原料,并有望成为新一代生物燃料。利用可再生原料通过微生物发酵生产丁醇受到人们的很大关注。然而,与石油原料制造丁醇相比,目前生物丁醇的制造成本偏高。生物丁醇制造技术按重要性排序:在廉价原料替代、低丁醇浓度及存在丙酮、乙醇低值副产物 3个方面有改进空间。上海生物丁醇协作组设定了由易到难的技术路线图:通过代谢工程提高丁醇比例;在丁醇高耐受菌株中导入和优化丁醇合成途径;去除葡萄糖阻遏效应使之可利用复杂原料。协作组相信,通过与国内外广泛的产学研合作,应可在不远的将来开发出有经济竞争力并可持续发展的生物丁醇生产工艺。
生物丁醇,生物燃料,丙丁梭菌,代谢工程
Abstract:Butanol is not only an important chemical feedstock but also expected to become a new generation biofuel.Thus,biological butanol production using renewable feedstocks has attracted renewed attention due to the worries of global oil supply and its impact on social and economic development.However, compared with petrochemical-derived butanol, biological butanol production is still not economically competition, because of its major drawbacks: high cost of the feedstocks, low butanol concentration in the fermentation broth and the co-production of low-value byproducts acetone and ethanol.Recently, Shanghai cooperative bio-butanol group(SCBG)developed a simple-to-complex technical route to improve bio-butanol production with a focus on: increasing butanol ratio in the solvent through metabolic engineering ofClostridiaspp.; introducing and optimizing the butanol synthetic pathway in the species with high butanol tolerance; overcoming the glucose repression effect to utilize low-costnon-grain based feedstocks.SCBG believes that, through extensive domestic and international industry-university-research cooperation, a sustainable and economically viable process for biological butanol production can be established in the near future.
Keywords:biobutanol, biofuel,Clostridia, metabolic engineering
丁醇既是重要的大宗化工原料,又是继乙醇后的一种极具发展前景的新一代液体燃料,通过产溶剂梭菌Clostridia的厌氧发酵,可将合适的碳水化合物转化为丙酮(Acetone)、丁醇(Butanol)和乙醇(Ethanol)等溶剂,此类溶剂生产技术因而也被简称为ABE发酵。
1 生物丁醇制造的历史和现状
生物法制备丁醇可追溯到第一次世界大战期间,以产溶剂梭菌厌氧发酵产生的丁醇为起始原料合成丁二烯橡胶是当时生产合成橡胶的最理想路线。因此,在合成橡胶大规模生产的同时,以玉米粉等碳水化合物为底物的溶剂发酵得到快速发展,一度发展为仅次于酒精发酵的世界第二大发酵工业。但是,从20世纪50年代开始,由于受到石油工业的冲击,ABE发酵逐渐衰落,在欧洲、北美和日本等地逐步停止了生产。而中国,由于当时特殊的经济和政治环境,是少数几个仍然进行ABE发酵生产的国家之一。
1955年,中国第一家ABE发酵工厂——上海溶剂厂开始使用玉米发酵生产ABE。随后的二、三十年间,在北京、江苏、天津、云南、山西、浙江、河北、山东、吉林等省市,又陆续建立了约30家规模在年产3 000~10 000 t的ABE发酵工厂,使得国内ABE年生产能力达到17万t[1-2]。然而,随着石油合成化工的蓬勃兴起,发酵法生产ABE在生产成本上越来越没有竞争优势,国内ABE发酵企业自上世纪90年代开始逐步关闭。
近年来,随着国际石油价格的剧烈波动以及基于石油资源不可再生性的共识,发酵法生产ABE技术重新引起了广泛关注[2-3]。近几年,国内已有 11家ABE发酵企业建成或恢复生产,另有5家还在筹建中(表1),预计投产后,国内ABE发酵生产将达到年产100万t的规模[2]。尽管2008年底的金融危机使得丁醇价格从每吨1.3万元下跌到5 000元,丙酮从每吨 9 000元下跌到 4 000元(http://www.bioindustry.cn/info/view/13122),迫使这些工厂停产,但随着近期丁醇市场价格的回升,目前吉安生化、江苏联化和江苏联海的丁醇装置均已复产,河南天冠的丁醇装置也将于年底建成投产。
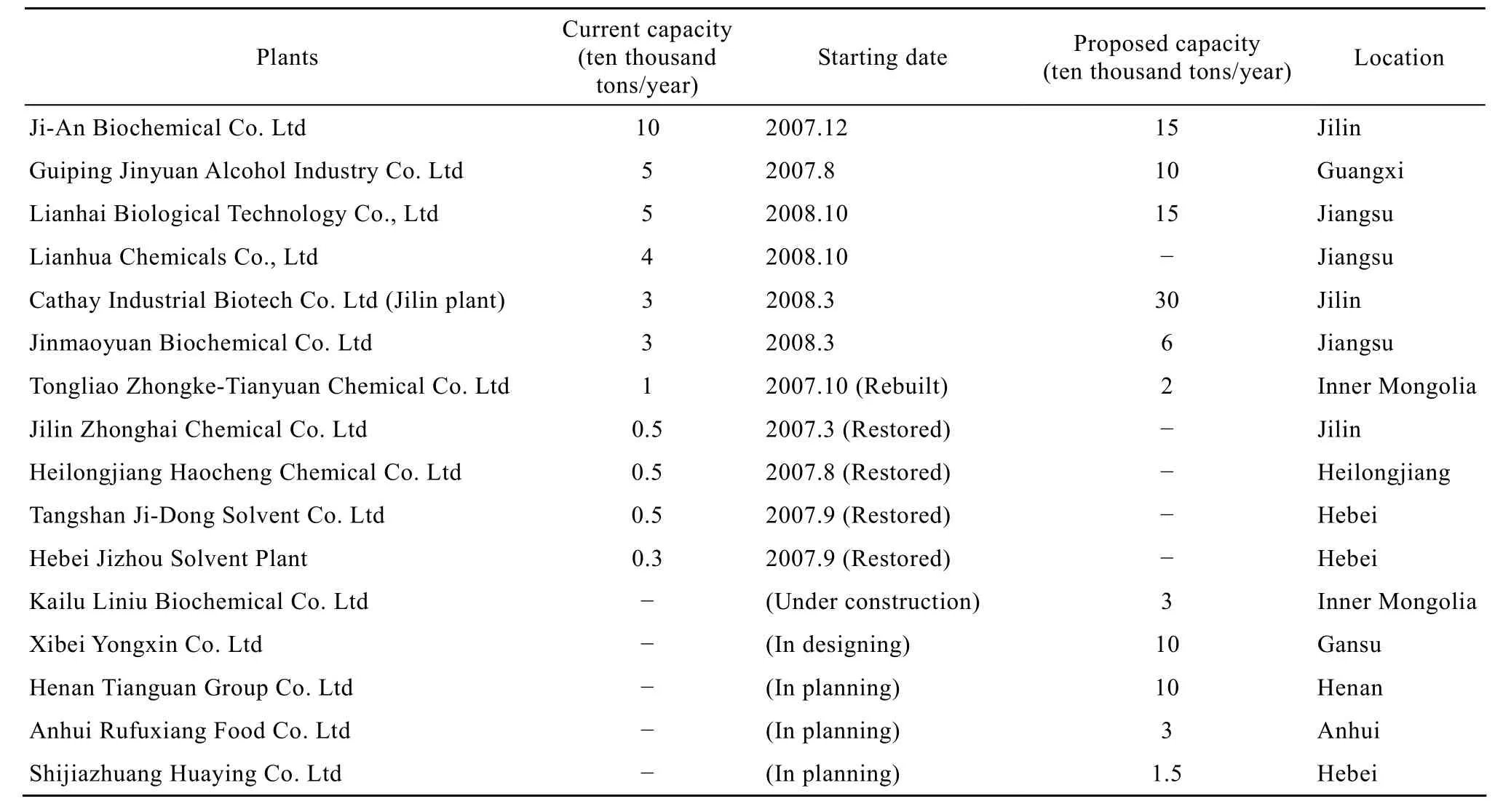
表1 中国ABE发酵企业[2](产能数据统计截止日期为2008年6月)Table 1 Summary of some ABE plants in China(capacity data updated to June, 2008)
梭状芽胞杆菌Clostridia是产溶剂工业菌种的唯一来源,传统的ABE发酵中使用的工业菌种名目繁多,有关产溶剂梭菌的分类学和系统发育相关性含糊不清,比较混乱。近年来,通过系统学[4-5]、基因组DNA/DNA杂交和DNA指纹图谱[4]以及发酵性能[6]等方面的比较研究和分析认为,工业用的产溶剂梭菌归为 4个“种”(Species),所有原来的淀粉发酵型菌株属于单独一个种,即丙酮丁醇梭菌Clostridium acetobutylicum。该类菌呈现较强的淀粉酶活力,适用于发酵玉米和谷类等淀粉质原料,同时具有独特的系统发育特性,与其他3个紧密相关的种,即拜氏梭菌Clostridium beijerinckii、糖丁酸梭菌Clostridium Saccharobutylicum和糖乙酸多丁醇梭菌Clostridium saccharoperbutylacetonicum的亲缘关系较远。已被鉴定的糖-发酵菌株大多数属于拜氏梭菌。除了南方少数企业外,针对我国以谷、薯类为主的农业生产状况,溶剂发酵菌种多为丙酮丁醇梭菌,且由国内的研究所或工厂自行选育驯养而来,如中国科学院微生物研究所的AS 1.70,上海溶剂厂的具有抗噬菌体能力的新抗-2号。这些菌种所产溶剂中3种组分丁醇∶丙酮∶乙醇均为6∶3∶1。“七五”期间,中国科学院上海植物生理生态研究所的焦瑞身、杨蕴刘研究员等通过土样分离和诱变筛选获得到了高丁醇比例菌株EA 2018,其溶剂中3种组分丁醇:丙酮:乙醇为7∶2∶1,淀粉转化率比传统菌种高 5%[1]。此外,其他溶剂厂也结合自身特点,选育出适用于特定原料如糖蜜、水解液的菌种(表2)。
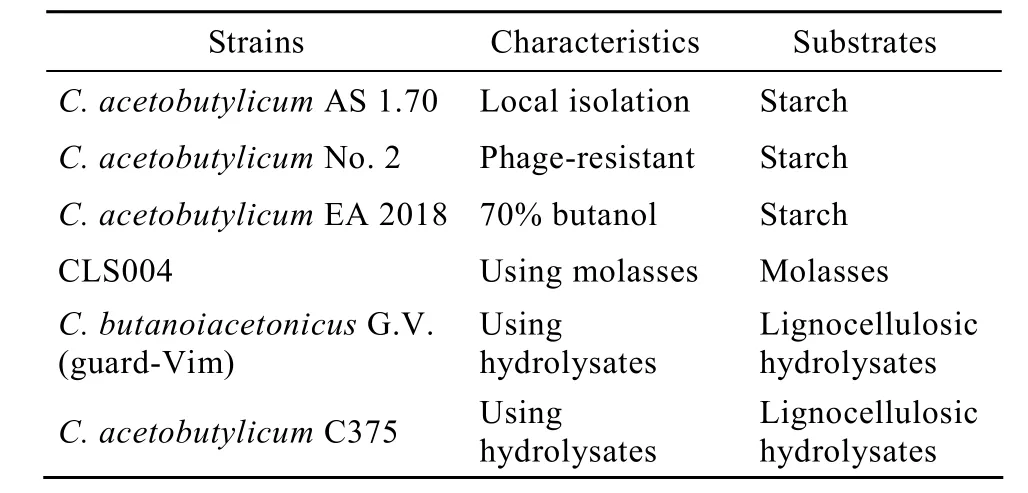
表2 中国ABE发酵所用菌种Table 2 Strains used in ABE fermentation in China
2 当前生物丁醇制造中面临的问题
如上所述,由于石油化工的快速发展,面对石油基丁醇的激烈竞争,ABE发酵产品在经济上处于不利地位。导致丁醇发酵缺乏经济竞争力的主要原因是:1)用作发酵的碳源成本偏高;2)发酵液中的丁醇浓度低;3)发酵过程中的丁醇选择性不高。现就这些问题分述如下:
2.1 粮食原料的高成本
传统发酵法生产丁醇的工艺主要包括溶剂的连续发酵、产物及副产物的蒸馏法分离提取,生产过程中的环境保护措施等等。目前,国内厌氧发酵生产生物丁醇的主要原料为玉米、谷物、薯干等淀粉质粮食资源。根据2009年的文献数据,ABE工业化发酵生产1 t溶剂需要消耗玉米约4.0~4.5 t,蒸汽约13~25 t,水约 20~30 t,电约 700~100 kw·h[2]。近年来由于国内以玉米等粮食作物为原料的生物炼制行业发展迅速,一定程度上促成了全国粮食价格的较快上升,致使生物丁醇生产成本大幅度增加。同时,国家出于维护粮价稳定和粮食安全战略的考虑,开始限制大规模使用玉米等粮食作物发展生物能源。因此,如何通过提高丁醇的原料转化率和利用廉价非粮类原料生产丁醇来降低其生产成本,成为该产业所必须直面的瓶颈问题。
2.2 丁醇毒性造成的低产物浓度
传统ABE发酵中生成的是三联产物(丙酮、丁醇和乙醇),提高溶剂三成分中主产物丁醇的浓度是降低发酵法制造丁醇成本的手段之一。据分析,如果丁醇发酵的产物浓度由12 g/L提高的19 g/L,产物分离的后续蒸馏成本将可降低一半[7]。然而,传统的丙酮丁醇梭菌发酵生产中的丁醇终浓度维持在13~14 g/L左右,难于超过这一阈值的原因在于所生成的溶剂特别是丁醇对产溶剂梭菌细胞的毒害作用[8]。研究表明丁醇的亲脂性使其比其他产物在破坏细胞膜的磷酯组分并增加膜流动性方面显示更强的作用[9]。高浓度的丁醇严重破坏细胞质膜的结构,干扰细胞膜的正常生理功能。当丙酮丁醇梭菌的生长环境中添加 1%的丁醇时,细胞膜流动性相应提高20%~30%[10],由此破坏了细胞内外的pH梯度,降低了胞内ATP水平和影响葡萄糖的吸收,继而抑制梭菌细胞的生长繁殖乃至杀死梭菌细胞[9]。虽然国外报道的拜氏梭菌C.beijerinckiiBA101在MP2培养基以及发酵调控条件下的丁醇产物浓度可达到20.9 g/L(总溶剂为32.6 g/L),是目前报道的产溶剂最高的菌株[11],但这是在特殊培养基和培养条件下得到的结果,还不具备工业应用的可能。为了提高产溶剂梭菌本身的丁醇耐受性,Tomas等在丙酮丁醇梭菌中过表达编码热激蛋白的groESL基因,使丁醇对菌体细胞的抑制作用降低了85%,并最终使产物浓度提高了 33%[12]。Borden等在丙酮丁醇梭菌中过表达来源于基因组 DNA文库中筛选过程中确定的2个与丁醇耐受性相关的基因,即可使重组菌体细胞的丁醇耐受水平分别提高了13%和81%[13]。上海丁醇协作组的赵静波与俄亥俄州立大学的杨尚天等合作,利用纤维床固定化生物反应器对丁醇生产菌株进行驯化,使固定在其中的菌体细胞不断提高在产溶剂时期对丁醇、有机酸和自溶素等抑制物的抵抗能力,最终获得了丁醇耐受性和丁醇产量均显著提高的突变株。该菌株在P2培养基中发酵的丁醇终浓度可达 21 g/L。当该突变株与纤维床反应器固定化发酵技术相结合时,在P2培养基中的丁醇发酵终浓度可达24~29 g/L[14]。总体说来,通过基因工程和代谢工程的手段虽可一定程度上提高产溶剂梭菌的丁醇耐受性,但这种“提高”很大程度上也受到菌株自身条件的限制。就目前工业规模的溶剂发酵而言,发酵液中的总溶剂达20 g/L时,梭菌细胞的代谢即刻停止[15],按丁醇比为 60%或 70%计,最终丁醇浓度在12~14 g/L之间,这是现有工业菌种很难进一步超越的丁醇耐受性水平。因此,传统ABE发酵中的低产物浓度已成为影响发酵经济性的重要因素之一。
2.3 发酵产物中的丙酮和乙醇副产物
目前传统丙酮丁醇梭菌 ABE发酵过程中,除了60%为丁醇外,同时还会有30%的丙酮和10%左右的乙醇[2]。ABE发酵的产物中丁醇的商业价值最高,现今价格维持在12 000元/t左右,副产物丙酮和乙醇属于低值产物,价格分别在8 500元/t和5 000元/t左右。同时,所产生的乙酸和丁酸既无法回收,更是降低了原料的转化效率增加了生产成本。因此,在无法进一步大幅提高发酵产物浓度的情况下,提高发酵过程中作为主发酵产物丁醇生物合成的选择性,减少副产物量来提高丁醇比例,降低粮耗不失为提升生物丁醇发酵产业经济性和竞争力的有效手段。但丁醇耐受性仍是一个不可避免而必须考虑的关键问题。中国科学院上海生命科学研究院的科研人员通过传统诱变方法,尽管获得了高丁醇比丙酮丁醇梭菌EA2018[16],产物丁醇∶丙酮∶乙醇为7∶2∶1,比传统菌种的丁醇比例提高10%,但从其发酵总溶剂浓度看,丁醇的浓度尚处在14 g/L左右,如要突破所述丁醇耐受性的阈值,还需作出更大的努力。
3 研究进展与应用
中国科学院上海植物生理生态研究所的研究人员从上世纪50年代起研究丙酮丁醇连续发酵制备技术,国家“七五”攻关期间通过诱变筛选获得了高丁醇比例的 EA2018菌株,曾在河北、山东等地成功投入工业化连续发酵生产应用,规模达到6 000 t/年。近年来,该所中国科学院合成生物学重点实验室的杨蕴刘、姜卫红、杨晟研究组协作攻关,开始进行产溶剂梭菌的遗传改造研究,并形成上海生物丁醇协作组。该协作组的主要技术思路是针对当前生物丁醇制造中面临的问题,通过产丁醇发酵菌株的遗传改造以及发酵、产品回收工艺的优化实现以下3方面目标:1)提高产品中的丁醇比例;2)寻找廉价的替代原料;3)提高发酵产物的浓度。从而克服传统发酵法制造丁醇过程中的限制性瓶颈,继而提高生物丁醇的生产经济性。
3.1 提高丁醇比例
提高丁醇比例可以通过对微生物丁醇途径的重构和优化实现。经典的丁醇代谢途径来源于产溶剂梭菌。产溶剂梭菌除生成 60%~70%的丁醇外,还有20%~30%的丙酮和10%的乙醇这2种低值副产物。通过对丁醇途径的重构和优化有可能降低丙酮和乙醇的合成量,在保持菌株原有的较高转化效率的基础上进一步提高丁醇在总溶剂中所占的比例,增强丁醇生产的经济竞争力。
为降低副产物丙酮的生物合成量,Janati-Idrissi等通过传统化学诱变手段,获得了不产丙酮的突变株C.acetobutylicum2-BrBu1,但是丁醇比例也同时降低[17]。美国Eleftherios Terry Papoutsakis实验室于2003年报道了利用反义 RNA技术抑制丙酮丁醇梭菌中的乙酰乙酸脱羧酶基因adc的转录,但丙酮浓度并未减少;接着用相同的方法抑制该菌中辅酶 A转移酶基因ctfAB的转录,虽然抑制了丙酮的产生,但该法同时抑制了和ctfAB同处一个操纵子的乙醇脱氢酶E基因adhE的转录,鉴于该酶是丁醇和乙醇合成途径的关键酶,因此几乎无乙醇和丁醇的产生[18];该项目组继而在抑制ctfAB转录基础上回补adhE,但只提高了乙醇的产量,丁醇产量没有提高,丁醇比例反而下降[19];而在丢失大质粒 pSOL的不产溶剂的丙酮丁醇梭菌退化菌株M5或DG1中通过过表达adhE基因重构丁醇途径可恢复丁醇产生,丁醇比例可达到90%以上,但是丁醇浓度为野生型的1/2[20-21]。
上海生物丁醇协作组蒋宇等通过敲除 EA2018菌株的丙酮合成途径关键酶(乙酰乙酸脱羧酶)基因,基本阻断了丙酮的产生,并经代谢流分析与发酵优化将丁醇的比例提高到85%以上[22]。尽管生物化学和分子生物学研究业已证明,丁醇/乙醇的生物合成共用醛-醇脱氢酶,但如何进一步降低乙醇比例,成功报道甚少。这是由于无法通过基因敲除的手段阻断乙醇产生而不影响丁醇生产。Papoutsakis实验室通过对在M5中过表达adhE基因的重组菌的发酵优化,使丁醇比例达到85%且浓度和野生型菌株相当,但进一步的代谢调控效果甚微[23-24]。上海生物丁醇协作组蒋宇等正在通过代谢调控和酶特异性改造,进一步提高丁醇/乙醇比例。
3.2 拓宽生物丁醇制备中的原料源
3.2.1 薯类、菊芋等非粮原料
薯类是淀粉含量很高的农作物,包括木薯、红薯、马铃薯等,在世界各地以及我国均有大量种植。薯类原料的市场价格较玉米、小麦等粮食类原料低廉,因此已被大量用于生物乙醇的生产。一些生物丁醇生产企业也在玉米原料中混入薯类原料进行发酵,以减少玉米的用量。由于薯类原料中淀粉以外的营养成分,如蛋白质等含量要明显低于玉米,因此完全以薯类原料进行发酵的丁醇产量较低,需要通过培养基和发酵条件的优化实现木薯等薯类原料对玉米的完全替代,真正实现生物丁醇的非粮发酵[25]。
菊芋是一种多年生草本植物,俗称洋姜、鬼子姜。菊芋生物量极大,每公顷可产菊芋块茎30~75 t。鲜菊芋块茎中富含多聚果糖,是一种极具开发潜力的半野生资源,是微生物发酵生产生物基化学品的良好糖源。国外以菊芋为原料发酵制备丁醇的研究多有报道。Marchal等在调控pH的条件下,使得菊汁水解液发酵的总溶剂浓度达到23~24 g/L[26]。大连化学物理研究所杜昱光研究员课题组提供的菊芋原料,经上海生物丁醇协作组试验证明,经菊粉酶处理后的水解液能被梭菌发酵产生丁醇,总溶剂浓度接近玉米原料水平。如果能够实现原料的规模化供应并进一步控制原料处理成本,相关研究成果具备工业化生产的可能。
小麦B淀粉又称尾淀粉、淤渣淀粉、刮浆淀粉或淀粉糊精,是小麦淀粉加工以及以小麦为原料发酵酒精的副产物,可用于发酵生产丁醇。国内的天冠集团受让了上海生物丁醇协作组的C.acetobutylicumEA 2018菌株,并开发了B淀粉浆和玉米的混合发酵丁醇工艺,进而实现了单独以B淀粉浆为原料进行生物丁醇的生产。
3.2.2 木质纤维原料
木质纤维素被普遍认为是一种最具应用潜力的发酵原料。近年来,国外围绕木质纤维素发酵制备 ABE溶剂的研究多有报道。Qureshi等采用C.beijerinckiiP260菌株测试了麦草水解液的溶剂发酵情况,在分步糖化发酵和同步糖化发酵2种工艺条件下,ABE产物浓度分别达到13.12、11.93 g/L[27];采用分批-补料发酵工艺时,C.beijerinckiiP260菌株的丁醇生产强度为0.36 g/(L·h),高于批式发酵的0.31 g/(L·h)[28]。C.beijerinckiiBA101 菌株也被用于玉米皮水解液的发酵测试,ABE溶剂浓度可达9.3 g/L[29]。相比较国外而言,国内的相关研究较少,早期的如陈守文等利用丙酮丁醇梭菌C.acetobutylicumC375菌株发酵稻草酶法水解液,分别研究了氮源、生长因子、pH等因素对发酵的影响,最终的总溶剂浓度为12.8 g/L,溶剂生成率为 29.9%[30];近年来中国科学院过程研究所的李冬敏等利用汽爆秸秆膜循环酶解耦合技术进行了丙酮丁醇发酵的研究,实现了酶解与发酵的同步进行[31]。国内的吉安新能源集团有限公司受让了上海生物丁醇协作组的C.acetobutylicumEA 2018菌株,并与中国科学院过程研究所的陈洪章课题组联合开发了秸秆半纤维素发酵丁醇技术,完成了年产600 t燃料丁醇的工业示范生产线(http://www.ipe.cas.cn/xwdt/ttxw/200910/t20091022_2586814.html)。
综合目前的研究进展来看,木质纤维素转化制造丁醇的工艺路线可以概括为:原料预处理和水解为单糖;糖液发酵生成丁醇;产物蒸馏回收等。尽管上述工艺路线具备可行性,但仍有诸多技术瓶颈需要克服。仅就菌种而言,纤维水解液中五碳糖和六碳糖的同等利用是迫切需要解决的难点之一。
1)五碳糖代谢
木质纤维原料中的六碳糖主要是葡萄糖(纤维素的主要组分),五碳糖主要是木糖以及阿拉伯糖(半纤维素的主要组分)[32]。其中,葡萄糖是最主要成分,其次为木糖,阿拉伯糖的含量较少。产溶剂梭菌(C.acetobutylicum,C.beijerinckii)具备天然的木糖利用能力,但与葡萄糖相比,木糖代谢能力不足,具体表现为在以木糖为唯一碳源发酵时,溶剂得率和生成速率低[33]。鉴于木糖是木质纤维原料中含量仅次于葡萄糖的最主要五碳糖,因此,开展产溶剂梭菌的木糖代谢工程研究具有重要意义。
对于大多数细菌来说,木糖被转运入细胞后首先通过木糖异构酶和木酮糖激酶两步催化反应生成5-磷酸木酮糖,随后进入磷酸戊糖途径(Pentose phosphate pathway,PPP),过程中涉及4个关键酶:转醛酶、转酮酶、5-磷酸-核糖异构酶以及 5-磷酸-核酮糖差向异构酶,最后以产物6-磷酸果糖和3-磷酸甘油醛进入糖酵解途径。Cynkin等研究者早先提出在梭菌中木糖也经由这条途径代谢[34-35],但限于基因组信息以及遗传操作手段的匮乏,在分子水平上对该途径上关键酶基因的解析工作一直未见报道,因而也就无法给菌株的木糖代谢工程改造提供相关信息。随着近年来丙酮丁醇梭菌模式菌株C.acetobutylicumATCC 824全基因组信息的公布[36],以及产溶剂梭菌遗传操作技术上的突破[37-38],上述木糖途径解析的研究工作也迎来了契机。上海生物丁醇协作组顾阳等通过比较基因组学以及分子生物学实验鉴定了C.acetobutylicumATCC 824木糖代谢途径中的木糖异构酶基因xylA和木酮糖激酶基因xylB[39],并通过在C.acetobutylicumATCC 824中过量表达E.coli来源的转醛酶基因A(talA),提高了该菌株的木糖利用率,从而证明了在丙酮丁醇梭菌C.acetobutylicum中转醛酶是PPP途径的限速酶之一[40]。由此可见,采用代谢工程实验方法增强产溶剂梭菌中木糖代谢通量是提高其木糖利用能力的有效手段。
2)葡萄糖阻遏效应(Carbon catabolite repression,CCR)的解除
微生物在利用复杂碳源过程中普遍存在CCR效应[41],即速效碳源的快速利用对非速效碳源的代谢产生抑制作用。这一现象在产溶剂梭菌发酵木质纤维素水解液过程中同样存在[42]。换言之,水解液中同时存在的葡萄糖抑制了细胞对其他糖源(木糖、阿拉伯糖等五碳糖)的有效利用,降低了物料转化效率和发酵的经济性。因此,解除产溶剂梭菌中的CCR效应、实现其对五碳糖和六碳糖的同等利用是木质纤维素制备生物丁醇中的一个关键科学问题。
在革兰氏阳性菌模式菌株枯草芽胞杆菌Bacillus subtilis中的已有研究表明,CCR效应的发生是由多效调控因子 CcpA介导的[43]。作为重要的工业菌种,有关产溶剂梭菌CCR效应的相关机理性研究极少,其中是否也存在与B.subtilis中相似的CcpA调控元件以及CCR效应的作用模式,这些问题都有待深入研究。2001年丙酮丁醇梭菌C.acetobutylicumATCC 824全基因组序列的公布为上述研究提供了信息平台[36]。英国Heriot-Watt大学的Mitchell教授等2003年通过生物信息学分析预测了C.acetobutylicumATCC 824中存在参与CCR效应的调控元件 CcpA[44]。本协作组的任聪等对C.acetobutylicumATCC 824中的CcpA蛋白作了鉴定,并证明该蛋白确实与CCR效应相关[45]。同时,通过敲除 ATCC 824中的ccpA基因,菌株固有的CCR效应得以解除,实现了对葡萄糖-木糖混合碳源的同等利用[45]。上述研究结果为通过代谢工程手段构建适用于木质纤维水解液混糖发酵的工程菌株提供了新思路。上海生物丁醇协作组现在已经获得一株能耐受玉米秸秆蒸汽爆破酶解糖液中的抑制物,并能同时利用其中葡萄糖和木糖高产丁醇的菌株(结果未发表)。
3.2.3 合成气
合成气主要是由CO、H2、CO2组成的混合气体,来源广泛,包括煤、油页岩、焦油沙、重残渣、劣质天然气以及生物质。以合成气为原料合成氨、含氧化合物和烃类等化工原料的生产技术已投入商业运行。近年来,以生物技术主导的合成气综合利用技术引起广泛关注,尤其是通过厌氧发酵方法将合成气转化成各种有用的燃料和化学品已成为新的研究热点[46]。
能够利用合成气的微生物都是厌氧菌,其可分为两种类型,一种以C1化合物(CO或CO2)作为碳源,而以氢作为能源;另一种同时利用C1化合物作为碳源和能源。大多数能够利用合成气的微生物的主要产物为乙酸、乙醇和H2[46],其中,微生物利用合成气厌氧发酵生产乙醇是迄今为止唯一成功实现产业化的技术。Clostridium ljungdahlii是目前合成气发酵产乙醇最具潜力的菌株。Phillips等[47]通过发酵条件和培养基优化,使得该菌株乙醇发酵的产物浓度上升到23 g/L。此外,Clostridium carboxidivoransP7对合成气的利用能力也受到广泛关注,该菌株发酵合成气产生的乙醇浓度可达10 g/L[48]。
目前已知的可利用合成气发酵生产丁醇的微生物菌株仅有Clostridium carboxidivoransP7(DSM15243)和Butyribacterium methylotrophicum(DSM3468),丁醇产量分别为1.776 g/L和2.7 g/L[49]。实现微生物利用合成气发酵生产丁醇的可行技术路线主要包括:1)在Clostridium ljungdahlii等乙醇生产菌株中引入乙醇到丁醇的代谢途径;2)对天然的可利用合成气发酵生产丁醇的微生物进行代谢工程改造,提高丁醇的生产强度;3)在传统的利用糖源的丁醇生产菌株中导入合成气代谢途径。上海生物丁醇协作组肖晗等已初步建立了合成气丁醇产生菌的遗传操作系统,正在尝试进行基因工程改造。
3.3 提高ABE发酵液中的丁醇浓度
3.3.1 低温发酵和产物气提回收技术
丁醇对菌体细胞具有较大毒性,通过菌株遗传改造增强其丁醇耐受性仅为提高丁醇生物合成的选择性和产物浓度创造了有利条件。为降低发酵产物丁醇对生产菌种的抑制作用,尚可通过发酵和下游工艺的改进来减轻发酵液中的丁醇毒性,进而提高发酵终点的丁醇浓度。Glassner等采用发酵温度调控的方法来提高丁醇产物浓度,取得良好的效果[50],在产溶剂阶段的发酵温度由37℃下调至30℃甚至更低,产物丁醇浓度可以达到16.5 g/L以上。本协作组刘旭东等通过变温发酵实现溶剂产量的大幅提高,丙酮丁醇梭菌 EA2018的玉米单批发酵总溶剂产量可达28.0 g/L,其中丁醇20.1 g/L、乙醇3.4 g/L、丙酮4.5 g/L(数据未发表)。不过,采用温控技术实现丁醇高产过程中,由于温度降低使得梭菌细胞代谢减缓,因此发酵周期会延长,细胞生产强度会降低;此外,降温操作从工业应用角度来说要增加能耗,并增大设备的前期投资,因此,要综合考虑丁醇产量提高和生产运行成本之间的经济平衡。
采用发酵-产物气提法回收(Gas-stripping)耦合技术也是降低溶剂毒性的有效方法[51-53]。该方法利用发酵产生的气体(H2、CO2)或者外界通入惰性气体来捕捉发酵产物,降低发酵液中的溶剂量,收集到的溶剂传送至冷凝装置回收,而气体可以回流到发酵体系中继续回收发酵产物。同一协作组的陈军等通过C.acetobutylicumEA 2018批式玉米醪发酵-气提耦合技术将 ABE发酵产物的浓度提高至30 g/L,其中丁醇20 g/L(数据未发表)。
3.3.2 在高耐丁醇菌株中构建异源丁醇途径
传统丁醇发酵中产物浓度的提高主要受制于菌株丁醇耐受性差。主要的产溶剂梭菌C.acetobutylicum的丁醇耐受极限低于2%(V/V)[54]。从菌体细胞对丁醇耐受性的研究结果来看,该表型是由多基因决定的,并且拥有十分复杂的调控网络[55],这使得对目前菌株的丁醇耐受性改造存在一定的困难。
已有的研究发现,某些菌株如Lactobacillus brevis、Lactobacillus delbrueckii[56]具有明显高于目前的产溶剂梭菌的丁醇耐受性,表明高丁醇耐受性的菌株在自然界中是存在的。协作组的李键等通过驯化及筛选等策略获得 2株丁醇耐受菌株,经鉴定均属于乳酸杆菌属Lactobacillus。在此基础上,通过对一个乳酸菌库的丁醇耐受性检测,发现其中大部分菌株具有明显高于产溶剂梭菌的丁醇耐受性,暗示了乳酸杆菌属作为一个整体,可能具有较高丁醇耐受性。同时,获得的数株丁醇耐受极限高于 3%(V/V)的菌株,有潜力成为构建丁醇途径的宿主菌。
丁醇合成途径已被成功导入Escherichia coli[57-58]、Saccharomyces cerevisiae[59]、Pseudomonas putida[60]和Bacillus subtilis[60]、Lactobacillus brevis[61]中,并用于丁醇生物合成的研究,所有上述菌株发酵后都能够获得微量的丁醇,证明由非自然宿主生产丁醇是可行的。当然,异源丁醇合成也存在诸多困难,如:酶蛋白编码基因的合理选择,基因的有效表达,代谢中间产物的平衡以及完全敲除竞争性途径等,未来仍然需要合成生物学、代谢工程、蛋白质工程等手段来提高丁醇的产物浓度。
4 展望
丁醇作为一种重要的化学品和新一代的生物燃料,其生物法制备方法已逐渐成为世界范围内的研究热点。当前迫切需要解决的是进一步降低生物丁醇的制造成本,以获得相对于石化合成路线的市场竞争优势。
根据我国农产品种植结构,传统ABE发酵中最常用的底物主要是玉米、薯干、谷物等淀粉质原料,这些农产品一定程度上可作为日常口粮,也用作禽畜饲料和工业用粮。考虑到国家的粮食安全问题,生物丁醇产业发展的出路在于非粮类底物的高效利用以及木质纤维素用于溶剂发酵并达到工业化规模生产的水平。在纤维丁醇生产工艺处于尚难产业化,有待完善的条件下,以木薯、菊芋等非粮作物替代玉米进行溶剂发酵也是一条可供选择的措施。但是随着人们对木质纤维素水解研究的深入和纤维素酶成本的下降,此类可再生资源用于丁醇的发酵生产将成为必然的发展趋势。
为增强丁醇发酵的经济竞争力,除了采用廉价原料及其相适应的生产菌外,不论是提高发酵的丁醇浓度(Concentration)、底物转化效率(Yield)还是生产强度(Productivity),培育和构建新型生产菌种至关重要,而基因工程和代谢工程等近代分子生物学技术为此目标的实现提供了可能性。
致谢:江南大学的孙志浩教授和倪晔副教授为本文提供了数据支持,在此表示感谢。
REFERENCES
[1]Chiao JS, Sun ZH.History of the acetone-butanol-ethanol fermentation industry in China: development of continuous production technology.J Mol Microbiol Biotechnol, 2007, 13(1/3): 12−14.
[2]Ni Y, Sun ZH. Recent progress on industrial fermentative production of acetone-butanol-ethanol byClostridium acetobutylicumin China.Appl Microbiol Biotechnol,2009, 83(3): 415−423.
[3]Lee SY, Park JH, Jang SH,et al. Fermentative butanol production byClostridia.Biotechnol Bioeng, 2008,101(2): 209−228.
[4]Keis S, Bennett CF, Ward VK,et al. Taxonomy and phylogeny of industrial solvent-producing clostridia.Int J Syst Bacteriol, 1995, 45(4): 693−705.
[5]Johnson JL, Toth J, Santiwatanakul S,et al. Cultures of“Clostridium acetobutylicum” from various collections compriseClostridiumacetobutylicum,Clostridium beijerinckii, and two other distinct types based on DNA-DNA reassociation.Int J Syst Bacteriol, 1997,47(2): 420−424.
[6]Shaheen R, Shirley M, Jones DT. Comparative fermentation studies of industrial strains belonging to four species of solvent-producing clostridia.J Mol Microbiol Biotechnol, 2000, 2(1): 115−124.
[7]Papoutsakis ET. Engineering solventogenic clostridia.Curr Opin Biotechnol, 2008, 19(5): 420−429.
[8]Vollherbst-Schneck K, Sands JA, Montenecourt BS. Effect of butanol on lipid composition and fluidity ofClostridium acetobutylicumATCC 824.Appl Environ Microbiol, 1984, 47(1): 193−194.
[9]Bowles LK, Ellefson WL. Effects of butanol onClostridium acetobutylicum.Appl Environ Microbiol,1985, 50(5): 1165−1170.
[10]Liu SQ, Qureshi N. How microbes tolerate ethanol and butanol.New Biotechnol, 2009, 26(3/4): 117−121.
[11]Chen CK, Blaschek HP. Acetate enhances solvent production and prevents degeneration inClostridium beijerinckiiBA101.Appl Microbiol Biotechnol, 1999,52(2): 170−173.
[12]Tomas CA, Welker NE, Papoutsakis ET. Overexpression ofgroESLinClostridium acetobutylicumresults in increased solvent production and tolerance, prolonged metabolism, and changes in the cell's transcriptional program.Appl Environ Microbiol, 2003, 69(8): 4951−4965.
[13]Borden JR, Papoutsakis ET. Dynamics of genomic-library enrichment and identification of solvent tolerance genes forClostridium acetobutylicum.Appl Environ Microbiol,2007, 73(9): 3061−3068.
[14]Zhao J, Yang S, Jiang W,et al. High titer butanol production using a mutantClostridium beijerinckiiachieved by adaptation in fibrous bed bioreactor.American Institute of Chemical Engineering(AIChE)National Meeting, 2009.
[15]Woods DR. The genetic engineering of microbial solvent production.Trends Biotechnol, 1995, 13(7): 259−264.
[16]Zhang YF, Chen J, Yang YL,et al. Breeding of high−ratio butanol strains ofClostridicum acetobutylicumand application to industrial production.Ind Microbiol, 1996,26(4): 1−6.张益 棻 , 陈军, 杨蕴刘, 等.高丁醇比丙酮丁醇梭菌的选育与应用.工业微生物, 1996, 26(4): 1−6.
[17]Janati-Idrissi R, Junelles AM, el Kanouni A,et al.Selection of mutants ofClostridium acetobutylicumdefective in production of acetone.Ann Inst Pasteur Microbiol, 1987, 138(3): 313−323.
[18]Tummala SB, Welker NE, Papoutsakis ET. Design of antisense RNA constructs for downregulation of the acetone formation pathway ofClostridium acetobutylicum.J Bacteriol, 2003, 185(6): 1923−1934.
[19]Tummala SB, Junne SG, Papoutsakis ET. Antisense RNA downregulation of coenzyme A transferase combined with alcohol-aldehyde dehydrogenase overexpression leads to predominantly alcohologenicClostridium acetobutylicumfermentations.J Bacteriol, 2003, 185(12): 3644−3653.
[20]Nair RV, Papoutsakis ET. Expression of plasmid-encodedaadinClostridium acetobutylicumM5 restores vigorous butanol production.J Bacteriol, 1994, 176(18): 5843−5846.
[21]Cornillot E, Nair RV, Papoutsakis ET,et al. The genes for butanol and acetone formation inClostridium acetobutylicumATCC 824 reside on a large plasmid whose loss leads to degeneration of the strain.J Bacteriol, 1997,179(17): 5442−5447.
[22]Jiang Y, Xu C, Dong F,et al. Disruption of the acetoacetate decarboxylase gene in solvent-producingClostridium acetobutylicumincreases the butanol ratio.Metab Eng, 2009, 11(4/5): 284−291.
[23]Sillers R, Al-Hinai MA, Papoutsakis ET. Aldehydealcohol dehydrogenase and/or thiolase overexpression coupled with CoA transferase downregulation lead to higher alcohol titers and selectivity inClostridium acetobutylicumfermentations.Biotechnol Bioeng, 2009,102(1): 38−49.
[24]Sillers R, Chow A, Tracy B,et al. Metabolic engineering of the non-sporulating, non-solventogenicClostridium acetobutylicumstrain M5 to produce butanol without acetone demonstrate the robustness of the acid-formation pathways and the importance of the electron balance.Metab Eng, 2008, 10(6): 321−332.
[25]Gu Y, Hu S, Chen J,et al. Ammonium acetate enhances solvent production byClostridium acetobutylicumEA 2018 using cassava as a fermentation medium.J Ind Microbiol Biotechnol, 2009, 36(9): 1225−1232.
[26]Marchal R, Blanchet D, Vandecasteele JP. Industrial optimization of acetone-butanol fermentation - a study of the utilization of Jerusalem artichokes.Appl Microbiol Biotechnol, 1985, 23(2): 92−98.
[27]Qureshi N, Sahaa BC, Hector RE,et al. Butanol production from wheat straw by simultaneous saccharification and fermentation usingClostridium beijerinckii: Part I - Batch fermentation.Biomass Bioenerg, 2008, 32(2): 168−175.
[28]Qureshi N, Saha BC, Cotta MA. Butanol production from wheat straw by simultaneous saccharification and fermentation usingClostridium beijerinckii: Part II -Fed-batch fermentation.Biomass Bioenerg, 2008, 32(2):176−183.
[29]Qureshi N, Ezeji TC, Ebener J,et al. Butanol production byClostridium beijerinckii.Part I: use of acid and enzyme hydrolyzed corn fiber.Bioresour Technol, 2008, 99(13):5915−5922.
[30]Chen SW, Ma X, Wang LS,et al. Acetone-butanol fermentation of rice straw enzymatic hydrolysate.Ind Microbiol, 1998, 28(4): 30−34.陈守文, 马昕, 汪履绥, 等.稻草酶法水解液的丙酮丁醇发酵.工业微生物, 1998, 28(4): 30−34.
[31]Li DM, Chen HZ. Fermentation of acetone and butanol coupled with enzymatic hydrolysis of steam exploded cornstalk stover in a membrane reactor.Chin J Process Eng, 2007, 7(6): 1212−1216.李冬敏, 陈洪章.汽爆秸秆膜循环酶解耦合丙酮丁醇发酵.过程工程学报, 2007, 7(6): 1212−1216.
[32]Ho NW, Chen Z, Brainard AP. Genetically engineeredSaccharomycesyeast capable of effective cofermentation of glucose and xylose.Appl Environ Microbiol, 1998,64(5): 1852−1859.
[33]Ounine K, Petitdemange H, Raval G,et al. Acetone-Butanol Production from Pentoses byClostridium acetobutylicum.Biotechnol Lett, 1983, 5(9): 605−610.
[34]Cynkin MA, Delwiche, EA. Metabolism of pentoses by clostridia.I.Enzymes of ribose dissimilation in extracts ofClostridium perfringens.J Bacteriol, 1958, 75(3): 331−334.
[35]Cynkin MA, Gibbs M. Metabolism of pentoses by clostridia.II.The fermentation of C14-labeled pentoses byClostridium perfringens,Clostridium beijerinckii, andClostridium butylicum.J Bacteriol, 1958, 75(3): 335−338.
[36]Nolling J, Breton G, Omelchenko MV,et al. Genome sequence and comparative analysis of the solventproducing bacteriumClostridium acetobutylicum.J Bacteriol, 2001, 183(16): 4823−4838.
[37]Heap JT, Pennington OJ, Cartman ST,et al. The ClosTron:a universal gene knock-out system for the genus Clostridium.J Microbiol Methods, 2007, 70(3): 452−464.
[38]Shao L, Hu S, Yang Y,et al. Targeted gene disruption by use of a group II intron(targetron)vector inClostridium acetobutylicum.Cell Res, 2007, 17(11): 963−965.
[39]Gu Y, Ding Y, Ren C,et al. Reconstruction of xylose utilization pathway and regulons in Firmicutes.BMC Genomics, 2010, 11(1): 255−268.
[40]Gu Y, Li J, Zhang L,et al. Improvement of xylose utilization inClostridium acetobutylicumvia expression of thetalAgene encoding transaldolase fromEscherichia coli.J Biotechnol, 2009, 143(4): 284−287.
[41]Gorke B, Stulke J. Carbon catabolite repression in bacteria: many ways to make the most out of nutrients.Nat Rev Microbiol, 2008, 6(8): 613−624.
[42]Mitchell WJ. Physiology of carbohydrate to solvent conversion by clostridia.Adv Microb Physiol, 1998, 39:31−130.
[43]Kim JH, Guvener ZT, Cho JY,et al. Specificity of DNA binding activity of theBacillus subtiliscatabolite control protein CcpA.J Bacteriol, 1995, 177(17): 5129−5134.
[44]Tangney M, Galinier A, Deutscher J,et al. Analysis of the elements of catabolite repression inClostridium acetobutylicumATCC 824.J Mol Microbiol Biotechnol,2003, 6(1): 6−11.
[45]Ren C, Gu Y, Hu S,et al. Identification and inactivation of pleiotropic regulator CcpA to eliminate glucose repression of xylose utilization inClostridium acetobutylicum.Metab Eng, 2010, doi:10.1016/j.ymben.2010.05.002.
[46]Henstra AM, Sipma J, Rinzema A,et al. Microbiology of synthesis gas fermentation for biofuel production.Curr Opin Biotechnol, 2007, 18(3): 200−206.
[47]Phillips JR, Klasson KT, Clausen EC,et al. Biological production of ethanol from coal synthesis gas-medium development studies.Appl Biochem Biotechnol, 1993, 39:559−571.
[48]Liou JSC, Balkwill DL, Drake GR,et al.Clostridium carboxidivoranssp.nov., a solvent-producing clostridium isolated from an agricultural settling lagoon, and reclassification of the acetogenClostridium scatologenesstrain SL1 asClostridium drakeisp.nov.Int J Syst Evol Microbiol, 2005, 55: 2085−2091.
[49]Grethlein AJ, Jain MK. Bioprocessing of coal-derived synthesis gases by anaerobic-bacteria.Trends Biotechnol,1992, 10(12): 418−423.
[50]Glassner DA, JM Datta R. Process for the fermentative production of acetone, butanol and ethanol: US, 5063156.1991-11-05.
[51]Zheng YN, Li LZ, Xian M,et al. Problems with the microbial production of butanol.J Ind Microbiol Biotechnol, 2009, 36(9): 1127−1138.
[52]Ezeji TC, Qureshi N, Blaschek HP. Acetone butanol ethanol(ABE)production from concentrated substrate:reduction in substrate inhibition by fed-batch technique and product inhibition by gas stripping.Appl Microbiol Biotechnol, 2004, 63(6): 653−658.
[53]Jones DT, Woods DR. Acetone-butanol fermentation revisited.Microbiol Rev, 1986, 50(4): 484−524.
[54]Tomas CA, Beamish J, Papoutsakis ET. Transcriptional analysis of butanol stress and tolerance inClostridium acetobutylicum.J Bacteriol, 2004, 186(7): 2006−2018.
[55]Knoshaug EP, Zhang M. Butanol tolerance in a selection of microorganisms.Appl Biochem Biotechnol, 2009,153(1/3): 13−20.
[56]Li J, Zhao JB, Zhao M,et al. Screening and characterization of butanol-tolerant micro-organisms.Lett Appl Microbiol, 2010, 50(4): 373−379.
[57]Atsumi S, Cann AF, Connor MR,et al. Metabolic engineering ofEscherichia colifor 1-butanol production.Metab Eng, 2008, 10(6): 305−311.
[58]Inui M, Suda M, Kimura S,et al. Expression ofClostridium acetobutylicumbutanol synthetic genes inEscherichia coli.Appl Microbiol Biotechnol, 2008, 77(6):1305−1316.
[59]Steen EJ, Chan R, Prasad N,et al. Metabolic engineering ofSaccharomyces cerevisiaefor the production of n-butanol.Microb Cell Fact, 2008, 7: 36−43.
[60]Nielsen DR, Leonard E, Yoon SH,et al. Engineering alternative butanol production platforms in heterologous bacteria.Metab Eng, 2009, 11(4/5): 262−273.
[61]Berezina OV, Zakharova NV, Brandt A,et al. Reconstructing the clostridial n-butanol metabolic pathway inLactobacillus brevis.Appl Microbiol Biotechnol, 2010,87(2): 635−646.
Current status and prospects of biobutanol manufacturing technology
Yang Gu1, Yu Jiang1,2, Hui Wu1, Xudong Liu1, Zhilin Li1, Jian Li1, Han Xiao1, Zhaobing Shen2,Jingbo Zhao1, Yunliu Yang1, Weihong Jiang1,2, and Sheng Yang1,2
1 Institute of Plant Physiology and Ecology, Shanghai Institutes for Biological Sciences, Chinese Academy of Sciences, Shanghai 200032, China 2 Shanghai Research and Development Center of Industrial Biotechnology, Shanghai 201201, China
Received:May 14, 2010;Accepted:June 23, 2010
Supported by:National Basic Research Program of China(973 Program)(No.2007CB707803), National High Technology Research and Development Program of China(863 Program)(No.2007AA05Z407), Knowledge Innovation Program of the Chinese Academy of Sciences(No.KSCX2-YW-G-075),Planned Scientific Program of Science and Technology Commission of Shanghai Municipality(No.08dz1207100).
Corresponding author:Weihong Jiang.Tel: +86-21-54924172; Fax: +86-21-54924015; E-mail: whjiang@sibs.ac.cn Sheng Yang.Tel: +86-21-54924173; Fax: +86-21-54924015; E-mail: syang@sibs.ac.cn国家重点基础研究发展计划(973计划)(No.2007CB707803),国家高技术研究发展计划(863计划)(No.2007AA05Z407),中科院知识创新工程重要方向项目(No.KSCX2-YW-G-075),上海市科委科研计划项目(No.08dz1207100)资助。

