废糟液全循环对自絮凝酵母糖酵解途径关键酶、胁迫相关代谢物及胞内组分的影响
孜力汗,张春明,任剑刚,袁文杰,陈丽杰
大连理工大学生命科学与技术学院,大连 116023
废糟液全循环对自絮凝酵母糖酵解途径关键酶、胁迫相关代谢物及胞内组分的影响
孜力汗,张春明,任剑刚,袁文杰,陈丽杰
大连理工大学生命科学与技术学院,大连 116023
旨在研究废糟液直接全循环对絮凝酵母乙醇发酵、糖酵解关键酶以及细胞组成的影响。在一有效容积1.5 L的搅拌式生物反应器中,使用葡萄糖为220 g/L,添加8 g/L酵母粉和6 g/L蛋白胨的培养基,以0.04 h−1的稀释率进行自絮凝颗粒酵母乙醇连续发酵。每隔 3天将收集到的发酵液集中精馏处理,得到的废糟液用于配制发酵培养基。装置运行近20 d,实验结果表明,随着废液循环批次的增加,系统乙醇和生物量浓度明显降低,糖酵解途径3个关键限速酶:己糖激酶、6-磷酸果糖激酶和丙酮酸激酶不同程度受到抑制。为了应对废糟液中高沸点副产物积累导致的环境胁迫,维持细胞正常代谢,甘油和菌体胞内蛋白生物合成加强,碳水化合物积累减弱。这些研究结果对进一步研究高沸点副产物积累对酵母细胞乙醇发酵影响的机理和菌种的代谢工程改造,具有重要意义。
乙醇发酵,自絮凝酵母,废糟液循环,高沸点副产物
Abstract:This research aimed to study the effect of distillage recycling on ethanol fermentation, the key glycolytic enzymes and cell composition of the self-flocculating yeast.With the self-flocculating yeast SPSC01 and medium composed of 220 g/L glucose, 8 g/L yeast extract and 6 g/L peptone, continuous ethanol fermentation was carried out at the dilution rate of 0.04 h−1with a 1.5 L tank bioreactor.Fermentation broth was collected every 3 days, and ethanol and other volatile byproducts were removed by distillation, but the stillage with high boiling byproducts was recycled to prepare the medium instead of fresh water.The system was run for 20 days, during which ethanol and biomass concentrations in the effluent decreased continuously, indicating the significant inhibition of the high boiling byproducts accumulated within the system.Thus, the activities of the key enzymes of the glycolytic pathway: hexokinase, 6-phosphofructose kinase, and pyruvate kinase were analyzed, and it was observed that all of them were inhibited.Furthermore, the biosynthesis of the stress response metabolites glycerol and trehalose was investigated, and it was found that glycerol production that can protect yeast cells against osmotic pressure stress was enhanced, but trehalose biosynthesis that can protect yeast cells against ethanol inhibition was not improved, correspondingly.And in the meantime, the biosynthesis of the major intracellular components proteins and hydrocarbons was adjusted, correspondingly.
Keywords:ethanol fermentation, self-flocculating yeast, recycling of distillage, high boiling byproducts
基于生物质资源生产的燃料乙醇可与成品油以一定比例配混或直接使用,不仅可以替代等量成品油,对缓解由于石油资源短缺导致的液体燃料供应紧张具有重要意义[1]。这种混合燃料或纯乙醇可以减少发动机尾气温室气体的净排量,有助于温室气体减排[2]。国内外燃料乙醇主要以糖质原料和淀粉质原料生产,在现有技术水平下,乙醇发酵终点乙醇浓度一般可以达到12%(V/V)左右,因此1 t乙醇生产可产生10 t左右废糟液[3]。
以玉米和小麦等粮食类淀粉质原料生产燃料乙醇产生的废糟液富含蛋白,适宜于作为动物饲料。在工业生产中,废糟液经离心机分离得到的上清液约30%直接循环使用,其余部分连同得到固形物,采用全蒸发浓缩技术(Distillers dried grains with solubles,DDGS)生产蛋白饲料[4]。虽然 DDGS技术废糟液处理比较彻底,但设备投资和运行能耗都很高,提高乙醇发酵系统废糟液循环使用的比例,对降低DDGS系统的设备投资、节省运行能耗具有十分重要的意义。
基于自絮凝颗粒酵母的乙醇发酵技术,通过原料前处理综合利用及发酵后酵母从发酵液中自沉降分离进行深加工,可以使精馏系统产生的废糟液COD浓度显著降低,为其大比例乃至全循环使用创造了良好条件[5]。然而,在废糟糟液全循环使用过程中,酵母细胞乙醇发酵和发酵液精馏等生产环节产生的高沸点副产物必然在发酵系统中发生积累,对酵母细胞乙醇发酵产生一定的影响。本文在前期四级串联悬浮床生物反应器系统实现自絮凝颗粒酵母乙醇发酵耦合废糟液全循环的基础上[6],建立一套单级连续发酵系统,以葡萄糖为发酵底物,在废糟液全循环条件下使高沸点副产物快速积累,进一步考察对自絮凝颗粒酵母细胞乙醇发酵过程、糖酵解途径关键酶、酵母细胞环境胁迫应激反应代谢产物及胞内生物质组成的影响。
1 材料与方法
1.1 菌种
自絮凝颗粒酵母(SPSC01)是粟酒裂殖酵母Schizosaccharaomyces pombe和酿酒酵母Saccharomyces cerevisiae通过原生质体融合而得到的融合株。该菌株具有两亲株的优点,乙醇发酵性能优良且具有良好自絮凝特性,由大连理工大学生物工程系保藏[7]。
1.2 培养基及方法
斜面培养基(g/L):葡萄糖20,酵母粉4,蛋白胨3,琼脂15,4℃保存。
种子培养基(g/L):葡萄糖30,酵母粉4,蛋白胨3,121℃灭菌15 min。
扩大培养基(g/L):葡萄糖 100,酵母粉4,蛋白胨3,121℃灭菌15 min。
发酵培养基(g/L):葡萄糖 220,酵母粉8,蛋白胨6,115℃灭菌15 min。
1.2.1 摇瓶种子初级培养
从活化斜面种子上取一环酵母种子接入含有100 mL种子培养基250 mL锥形瓶中,于30℃、150 r/min条件下恒温培养24 h。
1.2.2 发酵罐种子扩大培养
摇瓶种子静置后弃去上清液,将酵母接入装有0.5 L扩大培养基、工作容积1.5 L的发酵罐中进行间歇扩大培养,其培养条件为:温度30℃,pH 4.5,搅拌速率150 r/min,通气量0.5 vvm。待发酵液残糖浓度降低至1 g/L以下时,切换为流加培养基,控制流加速率使残糖浓度维持在1 g/L以下,待酵母细胞浓度接近30 g/L时,扩大培养结束。
1.2.3 乙醇连续发酵
停止搅拌和通气,使絮凝酵母自行沉降,然后用泵抽出上清液,恢复搅拌和通气,随即快速流加发酵培养基1.5 L至发酵罐溢流口,使系统进入发酵状态,待发酵液残糖浓度降低至1 g/L以下时,开始流加发酵培养基进行乙醇连续发酵。乙醇连续发酵的操作条件为:稀释速率0.04 h−1,温度30℃,pH值4.2~4.5,搅拌速率150 r/min,通气量0.05 vvm,实验装置的工艺流程如图1所示。
在絮凝酵母乙醇连续发酵过程中每隔3天将收集到的发酵液进行蒸馏,得到的废糟液用于配制新鲜培养基,作为废糟液循环的一个批次,对应的时间间隔为72 h。
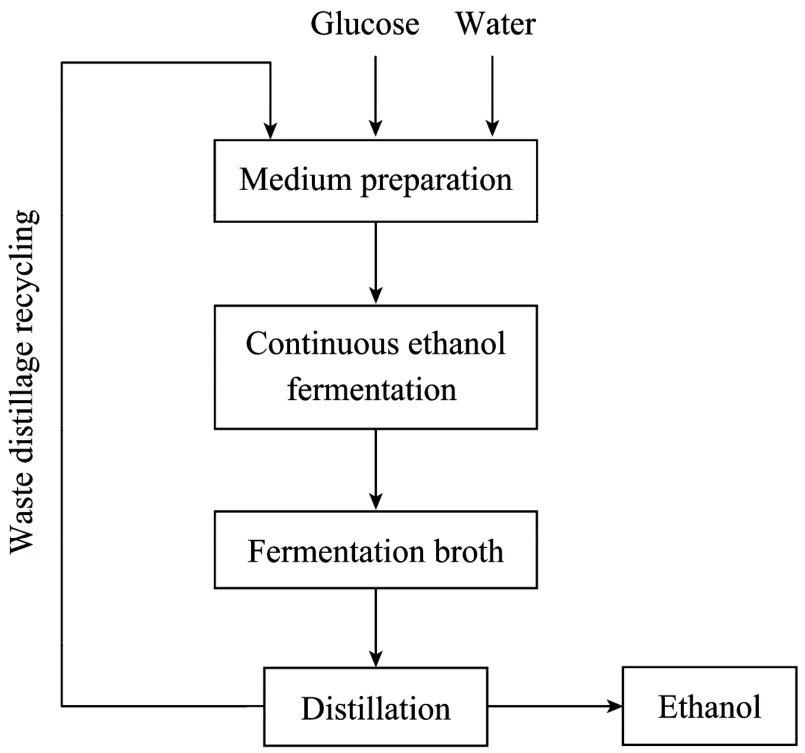
图1 废糟液全循环絮凝酵母SPSC01乙醇连续发酵工艺过程流程图Fig.1 Flow chart of continuous ethanol fermentation coupled with waste distillage using self-flocculating yeast SPSC01.
1.3 分析方法
1.3.1 生物量的测定
生物量的测定是以单位体积发酵液中菌体干重[g(d.w.)/L]表示,每次取4 mL发酵液离心后用蒸馏水重复洗涤3次,置于85℃烘箱中烘干24 h至恒重,取出后置于干燥器中冷却至室温后称重。
1.3.2 胞外代谢物分析
乙醇和葡萄糖浓度用SBA-50B生物传感分析仪(山东省生物科学研究所)分析[11]。发酵液甘油浓度利用Waters600高效液相色谱测定,色谱分离条件:离子排斥柱(Bio-Rad Aminex HPX-87H,300 mm×7.8 mm),流动相选用0.005 mol/L的H2SO4,流速为0.4 mL/min,色谱柱温度为55℃,采用Waters410示差折光检测器,温度为 50℃,并用 Waters Millennium32软件处理数据。
1.3.3 细胞组分分析
胞内海藻糖的提取参照文献[8]。胞内总糖用苯酚法测定[9],胞内总蛋白用二缩脲法测定[10]。
1.3.4 细胞酶活测定
己糖激酶、丙酮酸激酶和果糖-6-磷酸激酶的测定分别参考文献[11]、[12]和[13]。
2 结果与讨论
2.1 废液全循环条件下自絮凝酵母SPSC01乙醇连续发酵过程各参数的变化
图2所示为废液全循环条件下自絮凝酵母乙醇连续发酵过程发酵液中乙醇、残糖以及生物量浓度的变化情况,装置连续运行近400 h,5个废糟液循环批次。实验数据表明,装置运行约80 h后,发酵液中乙醇浓度逐渐降低,残糖浓度相应增高,生物量浓度也不断下降,说明废糟液中副产物积累对酵母细胞生长和乙醇发酵产生了明显影响。
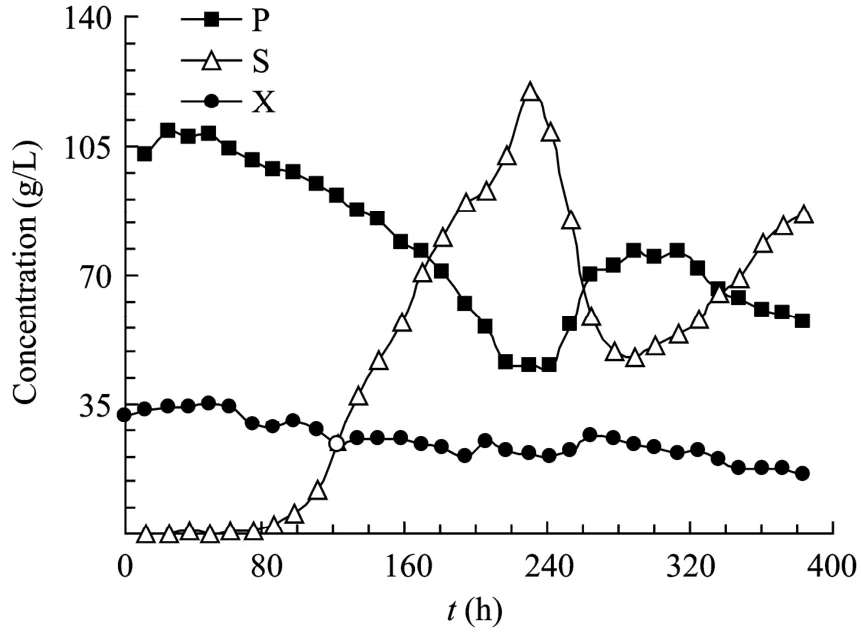
图2 废液全循环条件下自絮凝酵母乙醇连续发酵过程乙醇、残糖以及生物量的变化Fig.2 Time courses of ethanol, residual glucose and biomass of the continuous ethanol fermentation with the self-flocculating yeast and coupled with waste distillage recycling.P: ethanol; S: residual glucose; X: biomass.
废糟液中的副产物来源有 2个方面:一是酵母细胞乙醇发酵过程产生的高沸点副产物,如有机酸和甘油等[14];二是发酵液成分比较复杂,在蒸馏过程高温作用下某些组分间发生化学反应产生一些对酵母细胞产生抑制效应的物质,如残糖与氨基酸之间发生美拉德反应(Maillard reaction)生成的产物[15]。
2.2 糖酵解途径关键酶活变化
高沸点副产物积累对自絮凝颗粒酵母乙醇发酵性能的影响必然体现到糖酵解途径关键酶的活性上,图3所示为己糖激酶(Hexokinase,HK)、6-磷酸果糖激酶(6-phosphofructose kinase,PFK)和丙酮酸激酶(Pyruvate kinase,PK)活性的变化。

图3 废糟液循环对自絮凝颗粒酵母胞内己糖激酶(A)、6-磷酸果糖激酶(B)和丙酮酸激酶(C)活性的影响Fig.3 Impact of distillage recycling on enzymatic activities of hexokinase(HK, A), 6-phosphofructose kinase(PFK, B)and pyruvatekinase(PK, C)of the self-flocculating yeast.
可见随废糟液循环批次的增加,这3个激酶的酶活都有不同程度的降低。其中PFK在前3次废液循环过程中略微增加,随后迅速下降,到第6次循环结束时酶活由初始的 535.4 U/(g蛋白)降低至122.9 U/(g蛋白);PK酶活在第1次废液循环后迅速下降至最低值7.8 U/(g蛋白),到第3次循环时酶活略微增加,随后的4个循环批次酶活基本稳定在15 U/(g蛋白)左右;而HK酶活在前4次废液循环过程中基本稳定,第 5次循环开始酶活迅速下降,到第6次循环时酶活由初始的1 575.4 U/(g蛋白)降低至656.8 U/(g蛋白)。在乙醇发酵的pH条件下,废糟液循环时高沸点副产物尤其是有机酸多以分子状态存在,这样可以自由进入细胞,致使细胞质酸化[16]。研究发现,pH值对己糖激酶、6-磷酸果糖激酶和丙酮酸激酶酶活影响显著,与胞内pH 7.2时活性相比,当胞内pH为6.8或当发酵液pH 6.6乙酸浓度大于1 000 mmol/L时,己糖激酶酶活降低了50%;而pH为6.3或当发酵液pH 6.6乙酸浓度为279 mmol/L时,6-磷酸果糖激酶酶活降低了50%;胞内 pH小于 6.0或当发酵液 pH 6.6乙酸浓度为409 mmol/L时,丙酮酸激酶酶活降低了50%[17]。同时,当呋喃类化合物的浓度较高时显著抑制己糖激酶活性[18]。
2.3 酵母胞内海藻糖与胞外甘油浓度的变化
乙醇发酵过程中,甘油是产量最大的副产物,其主要作用是维持酵母细胞氧化还原平衡[19]。同时,甘油对酵母细胞具有一定的渗透压保护作用[20]。甘油-3-磷酸(G3P)经NAD依赖的甘油-3-磷酸脱氢酶(GPDH)脱磷酸后生成甘油,在酿酒酵母里GPD1和GPD2编码甘油-3-磷酸脱氢酶异构酶,研究表明GPD1的表达受渗透压调节,GPD2的表达不受外部渗透压影响,但在缺氧的条件下被启动通过提供还原力维持细胞的氧化还原平衡[21]。海藻糖是酵母细胞在胁迫条件下胞内合成的一种保护性多糖,海藻糖在胞内的含量可以直接反映细胞环境胁迫反应应激的程度[22-24]。因此,高沸点副产物积累对自絮凝颗粒酵母生长和乙醇发酵性能的影响应该在甘油和海藻糖代谢上得以体现(图4)。
可见甘油在第一个循环批次生成量稍有下降,到第二个循环批次生成量迅速增加,表明开始时甘油量随乙醇浓度的下降而略微降低,发酵液中副产物积累导致的渗透压还不足以对酵母细胞产生明显影响,但随副产物的不断积累,发酵液渗透压增加,酵母细胞增加了甘油合成,以抵抗渗透压胁迫[25]。因此,废液循环初期,甘油主要给细胞提供还原力维持细胞生长和乙醇发酵,而从第二个循环批次开始,甘油生成对酵母细胞渗透压胁迫提供保护。胞内海藻糖积累随发酵时间的延长呈明显下降的趋势,与图2所示的发酵液中乙醇浓度变化基本一致,表明胞内海藻糖积累受乙醇胁迫的影响更显著。
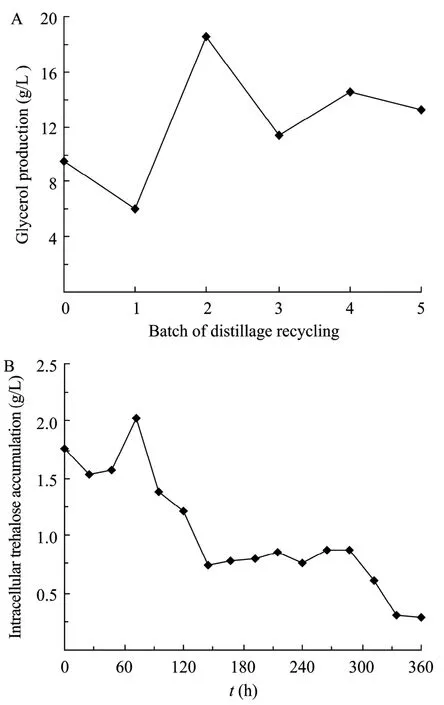
图4 自絮凝酵母乙醇连续发酵耦合废糟液全循环条件下甘油生成(A)和胞内海藻糖积累(B)Fig.4 Glycerol production(A)and intracellular trehalose accumulation(B)of the self-flocculating yeast during continuous ethanol fermentation coupled with distillage recycling.
2.4 酵母细胞组分的变化
对糖酵解途径关键酶活性和酵母细胞环境胁迫应激反应产物甘油和海藻糖的分析,能够在一定程度上揭示废糟液循环使用导致高沸点副产物积累对自絮凝颗粒酵母乙醇发酵的影响。但随发酵废液循环批次的增加,生物量浓度逐渐降低,说明对酵母生长产生了一定的影响,进一步分析胞内生理大分子的变化可以反映出对酵母基础代谢的影响。图5所示为胞内总蛋白和总糖的变化情况。
可见随着废液循环批次的增加,胞内总蛋白从36.01%增加到 59.6%,而总碳水化合物从 45.01%降低至 29.3%,表明副产物积累促进了胞内蛋白的合成,但减缓了碳水化合物的积累。胞内总蛋白合成的增加,可以提供更多的酶来弥补酶活性的降低,而碳水化合物合成的减少,可以节省能量消耗。
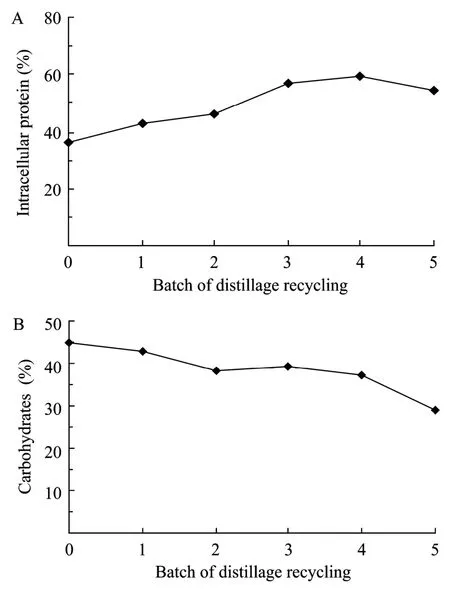
图5 自絮凝酵母乙醇连续发酵耦合废糟液全循环条件下胞内蛋白(A)和碳水化合物(B)的合成Fig.5 Intracellular protein(A)and carbohydrates(B)biosynthesis of the self-flocculating yeast during continuous ethanol fermentation coupled with distillage recycling.
3 结论与展望
对于工业生产中使用的粗原料,不论是采用前处理综合利用的清液发酵技术,还是从废糟液中分离固体糟渣的带渣发酵技术,部分废糟液将随湿渣离开系统。因此,即使废糟液全循环使用,从物料平衡的角度看,也不会导致高沸点副产物在系统中无限积累,只要这些副产物的平衡浓度低于对酵母细胞生长和乙醇发酵产生抑制效应的临界浓度,就不会对系统产生明显影响。在抑制现象发生时,酵母细胞糖酵解途径关键酶活性受到影响,同时与环境胁迫反应相关的途径也发生了相应的调节,如甘油代谢及胞内主要组分如蛋白和碳水化合物的生物合成等,这些调节作用的机理还有待于在鉴明这些环境胁迫因素的基础上,从代谢和相关酶基因表达水平上进行深入研究。
REFERENCES
[1]Yue GJ, Wu GQ, Hao XM.The status quo and prospects of fuel ethanol process technology in China.Prog Chem,2007, 19(7/8): 1084−1090.岳国君, 武国庆, 郝小明.我国燃料乙醇生产技术的现状与展望.化学进展, 2007, 19(7/8): 1084−1090.
[2]Wang DR.Market perspective of bioethanol industry.Chem Ind, 2009, 27(8): 30−36.汪多仁.生物乙醇汽油市场展望.化学工业, 2009,27(8): 30−36.
[3]Sheehan GJ, Greenfield PF.Utilisation, treatment and disposal of distillery wastewater.Water Res, 1980, 14(3):257−277.
[4]Zhao CY.Comprehensive treatment of distillers waste liquor in alcohol production,Ind Water Treatment, 2003,23(2): 62−64.赵传义.酒精废糟液综合治理工程实例.工业水处理,2003, 23(2): 62−64.
[5]Li DX, Bai FW, Song Q,et al.Effect of distilled effluent recycle on the continuous ethanol fermentation using self-flocculating yeast cells.Chin J Appl Environ Biol,1999, 5(5): 533−536.李东侠, 白凤武, 宋琪, 等.自絮凝颗粒酵母酒精连续发酵过程精馏废液循环回用工艺的研究.应用与环境生物学报, 1999, 5(5): 533−536.
[6]Yan Z, Zi LH, Li N,et al.Continuous ethanol fermentation using self-flocculating yeast in multi-stage suspended bioreactors coupled with directly recycling of waste distillage.Chin J Biotech, 2005, 21(4): 628−632.严正, 孜力汗, 李宁, 等.多级串联悬浮床反应器系统中自絮凝颗粒酵母乙醇连续发酵耦合废糟液直接全循环使用的研究.生物工程学报, 2005, 21(4): 628−632.
[7]Jin Y, Bai FW, Feng PS,et al.Studies on ethanol fermentation using a fusant SPSC fromS.cereviaeandS.pombe.Acta Microbiol Sin, 1996, 36(2): 115−120.靳艳, 白凤武, 冯朴荪, 等.融合株SPSC发酵生产酒精的工艺研究Ⅰ.絮凝速率、发酵过程的最适温度和 pH值.微生物学报, 1996, 36(2): 115−120.
[8]Sharma SC.A possible role of trehalose in osmotolerance and ethanol tolerance inSaccharomyces cerevisiae.FEMS Microbiol Lett, 1997, 152: 11−15.
[9]Verduyn C, Postma E, Scheffers WA,et al.Physiology ofSaccharomyces cerevisiaein anaerobic glucose-limited chemostat cultures.J Gen Microbiol, 1990, 136: 395−403.
[10]Herbert D, Phipps PJ, Strange RE.Methods in Microbiology.London: Academic Press, 1971: 209−344.
[11]Abrahao-Neto J, Infanti P, Vitolo M.Hexokinase production fromS.cerevisiae.culture conditions.Appl Biochem Biotechnol, 1996, 57/58: 407−412.
[12]Blumberg K, Stubbe J.Chemical specificity of pyruvate kinase from yeast.Biochim Biophys Acta, 1975, 384(1):120−126.
[13]Bergmeyer HU.Methods of Enzymatic Analysis.2nd ed.Cincinnati: Academic Press, 1974: 451.
[14]Maiorella B, Blanch HW, Wilke CR.By-product inhibition effect on ethanolic fermentation bySaccharomyces cerevisiae.Biotech Bioeng, 1983, 25: 103−121.
[15]Banerjee N, Viswanathan L.Effect of browning reaction products on the cell composition ofSaccharomyces cerevisiaeandAspergillus niger.Proc Annu Conv India:Sugar Technol Assoc, 1976, 41: G75−G80.
[16]Pampulha ME, Loureiro-Dias MC.Combined effect of acetic acid, pH and ethanol on intracellular pH of fermenting yeast.Appl Microbiol Biotechnol, 1989, 31:547−550.
[17]Pampulha ME, Loureiro-Dias MC.Activity of glycolytic enzymes ofSaccharomyces cerevisiaein the presence of acetic acid.Appl Microbiol Biotechnol, 1990, 34:375−380.
[18]Banerjee N, Bhatnagar R, Viswanathan L.Inhibition of glycolysis by furfural inSaccharomyces cerevisiae.Eur J Appl Microbiol Biotechnol, 1981, 11: 226−228.
[19]Michnick S, Roustan JL, Remize F,et al.Modulation of glycerol and ethanol yields during alcoholic fermentation inSaccharomyces cerevisiaestrains overexpressed or disrupted forGPD1encoding glycerol 3-phosphate dehydrogenase.Yeast, 1997, 13: 783−793.
[20]Blomberg A, Adler L.Physiology of osmotolerance in fungi.Adv Microbiol Physiol, 1992, 33: 145−212.
[21]Ansell R, Granath K, Hohmann S,et al.The two isoenzymes for yeast NAD+-dependent glycerol 3-phosphate dehydrogenase encoded byGPD1andGPD2have distinct roles in osmoadaptation and redox regulation.EMBO J, 1997, 16(9): 2179−2187.
[22]Sharma SC.A possible role of trehalose in osmotolerance and ethanol tolerance inSaccharomyces cerevisiae.FEMS Microbiol Lett, 1997, 152: 11−15.
[23]Hottiger T, Virgilio CD, Hall MN,et al.The role of trehalose synthesis for the acquisition of thermotolerance in yeast(II): physiological concent rations of trehalose increase the thermal stability of proteinsin vitro.FEBS J,1994, 219: 187−193.
[24]Mansure JJ, Panek AD, Crowe LM,et al.Trehalose inhibits ethanol effects on intact yeast cells and liposomes.Biochim Biophs Acta, 1994, 1191: 309−316.
[25]Blomberg A, Adler L.Roles of glycerol and glycerol-3-phosphate dehydrogenase(NAD+)in acquired osmotolerance ofSaccharomyces cerevisiae.J Bacteriol,1989, 171: 1087−1092.
Impact of distillage recycling on the glycolysis key enzymes,stress response metabolites and intracelluler components of the self-flocculating yeast
Lihan Zi, Chunming Zhang, Jiangang Ren, Wenjie Yuan, and Lijie Chen
School of Bioscience and Bioengineering, Dalian University of Technology, Dalian 116023, China
Received:May 17, 2010;Accepted:June 11, 2010
Supported by:National High Technology Research and Development Program of China(863 Program)(No.2007AA10Z358).
Corresponding author:Lihan Zi.Tel/Fax: +86-411-84706308; E-mail: lihanzi@dlut.edu.cn国家高技术研究发展计划(863计划)(No.2007AA10Z358)资助。

