亚心形四爿藻氢酶的稳定性及初步纯化
彦飞,陈兆安,曹旭鹏,陆洪斌,薛松,张卫
1 中国科学院大连化学物理研究所 海洋生物产品工程组,大连 116023 2 中国科学院研究生院,北京 100039
亚心形四爿藻氢酶的稳定性及初步纯化
彦飞1,2,陈兆安1,曹旭鹏1,陆洪斌1,薛松1,张卫1
1 中国科学院大连化学物理研究所 海洋生物产品工程组,大连 116023 2 中国科学院研究生院,北京 100039
亚心形四爿藻Tetraselmis subcordiformis是一种具有高产氢能力的海洋绿藻,在厌氧环境中经暗诱导调控,可进行一定时间的连续产氢。氢酶是亚心形四爿藻进行光合产氢的关键酶,本文研究了在厌氧环境中连二亚硫酸钠、β-巯基乙醇和丙三醇等试剂对氢酶的稳定性影响,考察了硫酸铵分级沉淀对氢酶的纯化效果及回收情况。结果表明,连二亚硫酸钠和丙三醇均能对氢酶起到较好的保护作用。60%~70%饱和度硫酸铵沉淀出的蛋白样品比酶活较高,且所含其他蛋白较少,可用于氢酶的进一步纯化。
亚心形四爿藻,氢酶稳定性,硫酸铵分级沉淀
Abstract:Tetraselmis subcordiformis, a marine green alga, can produce hydrogen by photobiologically hydrolyzing seawater with hydrogenase.In this study, the preliminary purification of the enzyme was explored by ammonium sulfate precipitation, and the impact of sodium dithionite, β-mercaptoethanol and glycerol on the enzyme stability during the process was investigated.The experimental results illustrated that sodium dithionite provided significant protection on the hydrogenase by depleting oxygen, while glycerol, a protectant against the structure instability of the enzyme, also presented protection.Crude enzyme with specific activity of 0.557 U/mg protein was extracted using 60%−70% saturated ammonium sulfate solution supplemented with 200 mmol/L sodium dithionite and 5% glycerol, and the hydrogenase recovery yield was about 30%.
Keywords:Tetraselmis subcordiformis, hydrogenase stability, ammonium sulfate precipitation
氢是一种理想的二次能源载体[1-2]。国际氢能组织预测,随着制氢、储氢和氢能使用技术的发展,到 2050年左右氢能将在全球能源构成中占据至关重要的地位。生物制氢技术由于具有低成本、可再生、清洁无污染等优点,受到了人们的关注[3-6]。
绿藻制氢是生物制氢领域中的一个重要方向[7-11]。绿藻利用可逆氢化酶产氢,催化效率高,不需要大量的 ATP,生产过程洁净,可以实现光能的自组织收集,能量的自发积累及定向快速转化,被国际能源局认为是生物制氢最有应用前景的途径之一。绿藻在光合作用Ⅱ过程中能将水分解成氧气、质子和电子,电子经过光合系统Ⅰ的电子传递链及铁氧化还原蛋白传递给氢酶,氢酶将质子还原为氢气。氢酶在这个过程中起着关键作用,但氢酶对氧气非常敏感,在有微量氧气存在时就会失活[12]。目前国内有多家科研单位对绿藻制氢进行研究,但与绿藻氢酶分离纯化相关的工作极少见到报道。
亚心形四爿藻是一种海洋单细胞产氢绿藻,其产氢能力与国际上目前研究最深入的淡水莱茵衣藻的水平相当[13-14]。为了提取亚心形四爿藻体内的可溶性氢酶,进行氢酶催化机理及失稳失活机制等方面的基础研究,本文报道了厌氧条件下几种试剂对氢酶的稳定性影响,并考察了硫酸铵分级沉淀对氢酶的纯化效果。
1 材料与方法
1.1 材料
藻种:亚心形四爿藻由辽宁省水产研究所提供,在本实验室纯化培养。
仪器:GC-960T气相色谱(上海海欣色谱仪器厂)。
1.2 方法
1.2.1 藻种的培养
采用灭菌天然海水(取自大连周边海域)加入康维方营养盐配制的培养基,每升海水培养基中各种盐含量为:NaNO3100 mg,NaHCO3168 mg,NaH2PO4·H2O 20 mg,EDTA-Na 45 mg,H3BO333.6 mg,FeCl3·6H2O 1.3 mg,MnC12·4H2O 0.36 mg,ZnC120.021 mg,CoCl2·6H2O 0.02 mg,CuSO4·5H2O 0.02 mg,(NH4)6Mo7O24·4H2O 0.009 mg。亚心形四爿藻置于25℃,日光灯光源,表面光照度为4 500 lx,光暗比为14 h∶10 h的条件下培养到对数生长后期。
1.2.2 氢酶的诱导
取3 L生长对数后期、浓度约2×106cells/mL的亚心形四爿藻,1 500 r/min离心2 min。倒掉海水后,取鲜重为10 g藻细胞,重新悬浮于100 mL灭菌海水中,置于密闭玻璃瓶中。通氮气10 min,排除容器中氧气后,在黑暗中诱导4 h。
1.2.3 厌氧环境的构建
氢酶对氧气非常敏感,1%左右的氧气即使其失活。因此自暗诱导开始,所有实验步骤均需在厌氧的环境中进行(图1)。将密封的样品放入厌氧袋中,反复充N2、抽真空3次后,开始纯化操作。需要离心的样品放在配有密封盖的离心管中,拿出厌氧体系离心。如无特殊说明,所使用的试剂中均加入一定浓度连二亚硫酸钠,以除去溶氧。

图1 氢酶纯化厌氧系统Fig.1 Anaerobic system used for hydrogenase isolation and purification.1: N2bottle; 2: vacuum pump; 3: manual valve; 4:vacuum bag; 5: vortex mixer.
1.2.4 细胞破碎
在厌氧环境中,将藻液分装于密封离心管中,4 000 r/min离心3 min,弃上清后重悬于 10 mL 50 mmol/L的Tris-HCl缓冲液(pH 7.9)中。在重悬液中加入10 g预冷玻璃珠(直径约1 mm),用涡旋振荡器最大强度混旋5次,每次1 min,两次之间在冰上静置1 min。13 000 r/min离心10 min,取上清弃沉淀。
1.2.5 氢酶活性检测
氢酶活性的测定在 6 mL密闭容器中进行。以50 mmol/L磷酸钾缓冲液(pH 6.8)作反应缓冲液,用被连二亚硫酸钠还原的甲基紫精作电子供体。反应系统包括终浓度为5 mmol/L甲基紫精和100 mmol/L Na2S2O4,通高纯N2排除氧气5 min后,用注射器加入0.1 mL样品。在25℃水浴中振荡孵育20 min后,用气相色谱检测氢气组分含量。
1.2.6 蛋白含量测定
使用Bradford法测定总蛋白含量。取100 µL样品,加入2 mL显色液(95%乙醇25 mL,85%磷酸50 mL,35 mg考马斯亮蓝G250,加水至500 mL),室温下反应5 min后,测定在595 nm处的光吸收值。以2 mL显色液加入 100 µL 50 mmol/L Tris-HCl缓冲液(pH 7.9)的处理作为空白对照,用牛血清白蛋白作标准蛋白。本步骤在空气环境中进行。
1.2.7 硫酸铵分级沉淀
在厌氧袋中,向上清中加入固体(NH4)2SO4,依次至 20%、30%、40%、50%、60%、70%、80%饱和度,同时磁力搅拌均匀。每次沉淀在4℃、13 000 r/min离心10 min,将沉降出的蛋白溶于1 mL 50 mmol/L Tris-HCl(pH 7.9)中,上清继续进行硫酸铵沉淀。
1.2.8 聚丙烯酰胺凝胶电泳
聚丙烯酰胺凝胶电泳方法参见文献[15]。分离胶浓度为15%,用考马斯亮蓝R-250染色。本步骤在空气环境中进行。
2 结果与讨论
2.1 氢酶的稳定性研究
为了能够在氢酶纯化过程中进行活性跟踪,保证氢酶稳定性是非常重要的。针对其特性,考察了几种试剂对氢酶的保护效果。
2.1.1 连二亚硫酸钠对氢酶的影响
即使放在厌氧袋中,试剂中仍有溶氧存在,这将严重影响氢酶的稳定性。为了消除溶氧,应在所有试剂中加入强还原剂连二亚硫酸钠。考察了不同浓度连二亚硫酸钠对藻细胞破碎液上清液中氢酶活性的影响,结果如图2所示。若不加连二亚硫酸钠,上清液的氢酶活性仅为0.0024 U/mg 蛋白。将连二亚硫酸钠浓度增加到10 mmol/L 和20 mmol/L时,氢酶活性均有大幅度提高,分别达到0.091 U/mg 蛋白和0.169 U/mg 蛋白。此后再增加连二亚硫酸钠则没有明显效果。
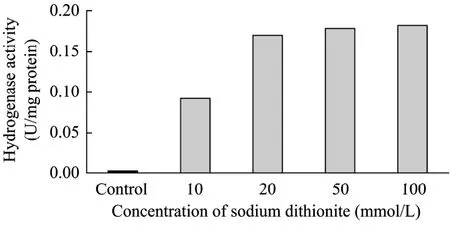
图2 不同浓度连二亚硫酸钠对溶液中氢酶活性的影响Fig.2 Effects of sodium dithionite on hydrogenase activity in solution.
氢酶的硫酸铵沉淀过程中,在缓冲液中含有20 mmol/L连二亚硫酸钠的条件下,氢酶活性损失现象仍然十分严重。这可能是因为在系统中加入大量硫酸铵的同时也带入了氧气。因此,需要增加缓冲液中的连二亚硫酸钠浓度。图3显示了以80%饱和度硫酸铵沉淀时,连二亚硫酸钠浓度对氢酶活性的影响。可以看出,连二亚硫酸钠浓度需达到200 mmol/L,方可有效保护氢酶活性,再增加则没有明显效果。
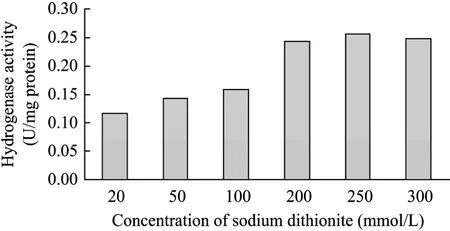
图3 不同浓度连二亚硫酸钠对硫酸铵沉淀时氢酶活性的影响Fig. 3 Effects of sodium dithionite on hydrogenase activity during ammonium sulfate fractionation.
2.1.2 β-巯基乙醇对氢酶的影响
β-巯基乙醇是提取蛋白时常用的保护剂,也是一种还原剂,其作用是保护蛋白质上自由的巯基不被氧化,从而避免蛋白的聚集或变性。分别考察了细胞破碎后上清液中不含连二亚硫酸钠和含20 mmol/L连二亚硫酸钠时,不同浓度β-巯基乙醇对氢酶活性的影响。如图4所示,在上清液中不含连二亚硫酸钠时,随β-巯基乙醇浓度的增大,氢酶活性也随之增大,但加入20 mmol/L β-巯基乙醇尚不能完全消除体系中的溶氧,上清液的氢酶活性仅达0.005 U/mg蛋白。这说明β-巯基乙醇的还原性远低于连二亚硫酸钠,不适宜用于建立厌氧环境。当上清液含20 mmol/L连二亚硫酸钠时,溶氧被消除干净,氢酶活性达到0.17 U/mg蛋白左右(图5),这时加入各浓度β-巯基乙醇对氢酶活性均没有影响。

图4 溶液不含连二亚硫酸钠时不同浓度 β-巯基乙醇对氢酶活性的影响Fig.4 Effects of β-mercaptoethanol on hydrogenase activity with no sodium dithionite in solution.
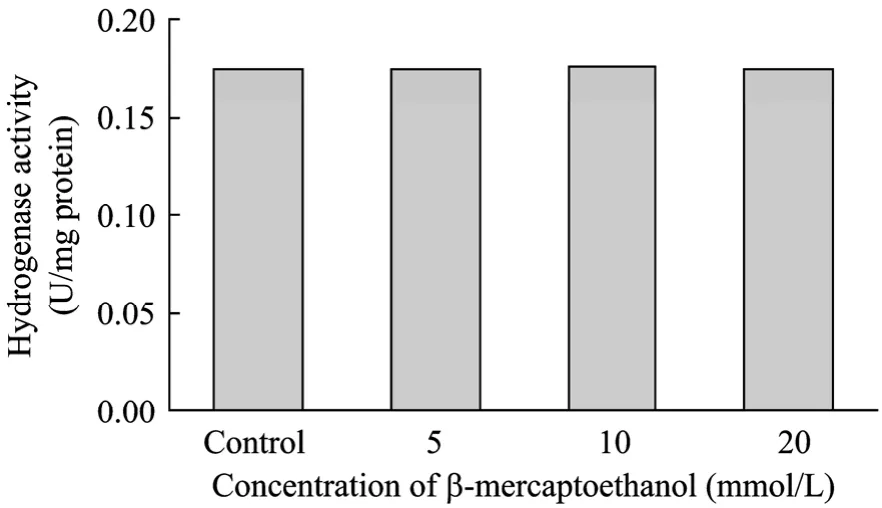
图5 溶液中含20 mmol/L连二亚硫酸钠时不同浓度 β-巯基乙醇对氢酶活性的影响Fig.5 Effects of β-mercaptoethanol on hydrogenase activity with 20 mmol/L sodium dithionite in solution.
2.1.3 丙三醇对氢酶的影响
由于实验条件限制,很难将整个厌氧纯化系统放置于4℃环境中,因此氢酶的硫酸铵分级沉淀步骤是在室温下进行的。为保证氢酶的稳定性,考虑在缓冲溶液中加入一定浓度的丙三醇。丙三醇能提供极性环境,维持蛋白质离子键的稳定;且丙三醇的羟基能与蛋白质的极性氨基酸残基形成氢键,从而使蛋白质的结构得到加固,增强蛋白质功能的稳定性。破碎细胞后,在上清液中加入10%丙三醇,静置12 h,每隔2 h检测氢酶活性。如图6所示,与对照组相比,加入丙三醇的样品氢酶活性随时间的延长下降较为缓慢,室温放置12 h后氢酶活性为原来的71%,而未添加丙三醇的对照组12 h后活性仅剩下55%。

图6 10%丙三醇对氢酶的保护作用Fig.6 Protection effect of 10% glycerin to hydrogenase.1:buffer is 50 mmol/L Tris-HCl(pH 7.9)containing 20 mmol/L Na2S2O4and 10%(V/V)glycerin; 2: control group, buffer is 50 mmol/L Tris-HCl(pH 7.9)containing 20 mmol/L Na2S2O4.
此后考察了硫酸铵沉淀过程中不同浓度丙三醇对氢酶的影响。在蛋白溶液中分别加入3%、5%、10%、15%丙三醇(V/V),并以 80%饱和度硫酸铵沉淀,13 000 r/min离心10 min。将获得的蛋白溶于1 mL相应缓冲液中,检测其氢酶活性及蛋白含量。结果如表1所示,缓冲液加入丙三醇的样品沉淀出的蛋白比酶活均高于对照组,加入 5%、10%浓度丙三醇的效果尤其明显。加入15%丙三醇的样品离心后没有蛋白沉淀出来,这是因为加入高浓度丙三醇导致溶液密度增大,影响蛋白析出。加入10%丙三醇的样品离心后沉淀出的蛋白在离心过后有小部分悬浮起来,也是溶液密度增大所致。因此,在硫酸铵沉淀过程中加入5%丙三醇可以起到最佳效果。
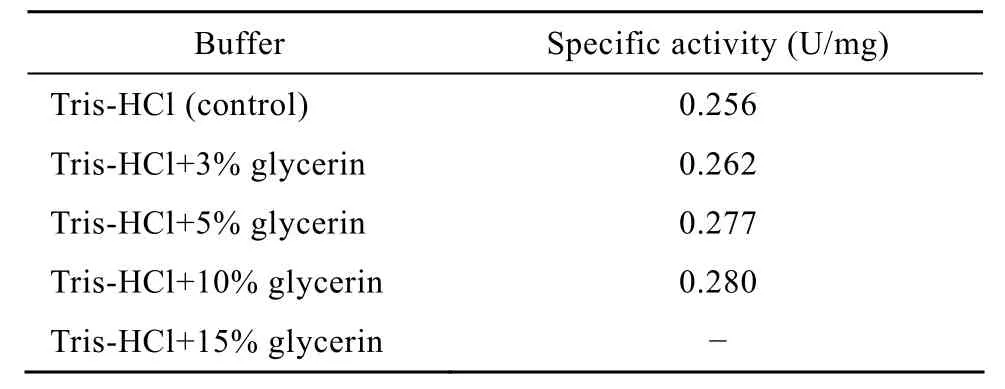
表1 不同浓度丙三醇对氢酶的保护作用Table 1 Protection effect of different concentration glycerin
2.2 硫酸铵分级沉淀对氢酶的纯化
在采用优化的氢酶稳定性条件基础上进行了硫酸铵分级沉淀,所用粗酶液的总酶活为17.28 U,总蛋白含量为97.65 mg,比酶活为0.176 U/mg蛋白。实验结果表明,各饱和度沉淀出的蛋白样品均具有一定的氢酶活性。其中 50%~60%、60%~70%、70%~80%饱和度沉淀出的蛋白,氢酶活性远高于其余组分,三者回收的氢酶占上清中氢酶总量的68%。其中 60%~70%饱和度沉淀获得的样品具有最高活性,占总量的30%(图7)。对氢酶活性最高的几个组分进行分析,检测蛋白含量,计算蛋白比酶活,结果如表 2所示。60%~70%饱和度沉淀样品比酶活最高,为0.557 U/mg蛋白;与上清液相比,氢酶被纯化了3.16倍,适合用于进一步纯化。
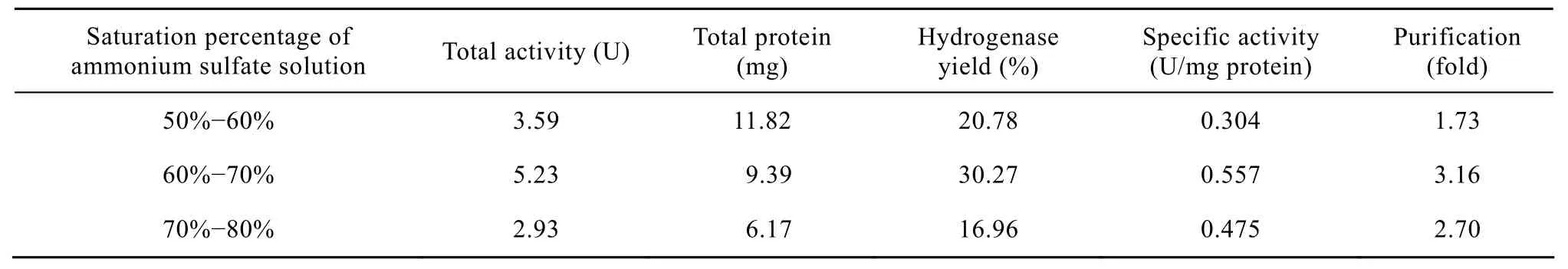
表2 硫酸铵沉淀对氢酶的纯化Table 2 Purification of hydrogenase with ammonium sulfate precipitation
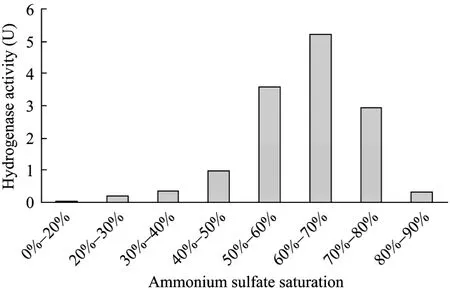
图7 不同饱和度硫酸铵沉淀回收氢酶量Fig.7 Hydrogenase recovery of different ammonium sulfate saturation.
3 结论
本文首先考察了不同试剂对氢酶的稳定性影响。结果表明,20 mmol/L和200 mmol/L连二亚硫酸钠能消除系统中的溶氧,分别对溶液中氢酶和硫酸铵沉淀过程中氢酶具有较好的保护作用;各浓度β-巯基乙醇对氢酶活性均没有明显影响;5%(V/V)丙三醇能在硫酸铵沉淀过程中增加氢酶的稳定性。然后用硫酸铵分级沉淀法,在厌氧环境中对亚心形四爿藻氢酶进行了初步纯化。60%~70%饱和度硫酸铵沉淀出的蛋白具有较高比酶活,且所含其他蛋白较少,可用于氢酶的进一步纯化。
REFERENCES
[1]Wunschiers R, Lindblad P.Hydrogen in education-a biological approach.Int J Hydrogen Energy, 2002,27(11/12): 1131−1140.
[2]Kruse O, Rupprecht J, Mussgnug JH,et al.Photosynthesis:a blueprint for solar energy capture and biohydrogen production technologies.Photoch Photobiol Sci, 2005, 4:957−970.
[3]Weaver PF, Lien S, Seibert M.Photobiological production of hydrogen.Sol Energy, 1980, 24(1): 3−45.
[4]Mitsui A, Philips EJ, Kumazawa S,et al.Progress in research toward outdoor biological hydrogen production using solar energy, sea water, and marine photosynthetic microorganisms.Ann New York Acad Sci, 1983, 413:514−530.
[5]Miyake J.Biological solar energy conversion-hydrogen generation.J Fibre, 1992, 48(1): 33−37.
[6]Zajic JE, Margaritis A, Brossenu JD.Microbial hydrogen production from replenishable resources.Int J Hydrogen Ener, 1979, 4(5): 385−402.
[7]Melis A, Zhang LP, Forestier M,et al.Sustained photobiological hydrogen gas production upon reversible inactivation of oxygen evolution in the green algaChlamydomanas reinhardtii.Plant Physiol, 2000, 122(1):127−136.
[8]Florin L, Tsokoglou A, Happe T.A novel type of iron hydrogenase in the green algaScenedesmus obliquusislinked to the photosynthetic electron transport chain.J Biol Chem, 2001, 276(9): 6125−6132.
[9]Winkler M, Heil B, Happe T.Isolation and molecular characterization of the [Fe]-hydrogenase from the unicellular green algaChlorella fusca.Biochim Biophys Acta, 2002, 1576(3): 330−334.
[10]Uenoa Y, Kuranoa N, Miyachib S.Purification and characterization of hydrogenase from the marine green alga,Chlorococcumlittorale.FEBSLett, 1999,443(2):144−148.
[11]Guan YF, Deng MC, Yu XJ,et al.Two-stage photo-biological production of hydrogen by marine green algaPlatymonas subcordiformis.Biochem Eng J, 2004,19(1): 69−73.
[12]Happe T, Hemschemeier A, Winkler M,et al.Hydrogenase in green algae: do they save the algae’s life and solve our energy problem?Trends Plant Sci, 2002,7(6): 246−250.
[13]Guan YF, Zhang W, Deng MC,et al.Significant enhancement of photobiological H2evolution by carbonylcyanidem-chlorophenylhydrazone in the marine green algaPlatymonas subcordiformis.Biotechnol Lett,2004, 26(13): 1031−1035.
[14]Ran CQ, Yu XJ, Mei FJ,et al.Role of carbonyl cyanide m-chlorophenylhydrazone in enhancing photobiological hydrogen production by marine green algaPlatymonas subcordiformis.Biotechnol Prog, 2006, 22(2): 1−6.
[15]Sambrook J, Fritsch EF, Maniatis T.Molecular Cloning: A Laboratory Manual.2nd ed.New York: Cold Spring Harbor Laboratory Press, 1989.
Stability of the hydrogenase from Tetraselmis subcordiformis and its preliminary purification
Fei Yan1,2, Zhao’an Chen1, Xupeng Cao1, Hongbin Lu1, Song Xue1, and Wei Zhang1
1 Marine Bioproducts Engineering Group, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, China 2 Graduate School of Chinese Academy of Sciences, Beijing 100039, China
Received:May 20, 2010;Accepted:June 23, 2010
Supported by:National Key Basic Research Program of China(973 Program)(No.2009CB220004), National High Technology Research and Development Program of China(863 Program)(No.2006AA05Z106), National Natural Science Foundation of China(No.20806081), Knowledge Innovation Program of the Chinese Academy of Sciences(Nos.KSCX2-YW-G-073, KSCX2-YW-373-2, KGCX2-YW-223, KSCX2-YW-G-002),Natural Science Foundation of Liaoning Province(No.20082152).
Corresponding author:Wei Zhang.Tel/Fax: +86-411-84379069; E-mail: weizhang@dicp.ac.cn国家重点基础研究发展规划(973计划)(No.2009CB220004),国家高技术研究发展计划(863计划)(No.2006AA05Z106),国家自然科学基金(No.20806081),中科院知识创新工程重要方向项目(Nos.KSCX2-YW-G-073, KSCX2-YW-373-2, KGCX2-YW-223, KSCX2-YW-G-002),辽宁省自然科学基金(No.20082152)资助。

