絮凝酵母海藻糖合成酶基因TPS1启动子区的克隆和乙醇胁迫下启动子活性的变化
林贝,赵心清,张秋美,马黎明,白凤武
1 大连理工大学生命科学与技术学院,大连 116024 2 北京化工大学北方学院理工院,廊坊 065201
絮凝酵母海藻糖合成酶基因TPS1启动子区的克隆和乙醇胁迫下启动子活性的变化
林贝1,2,赵心清1,张秋美1,马黎明1,白凤武1
1 大连理工大学生命科学与技术学院,大连 116024 2 北京化工大学北方学院理工院,廊坊 065201
提高生物能源生产菌株对各种胁迫因素的耐受性对于提高生产过程的经济性和高效生产生物能源具有重要的意义。对酿酒酵母乙醇耐性的分子机制的研究,可揭示影响其耐受性的关键基因,并通过代谢工程操作定向提高酵母菌的乙醇耐受性,从而提高燃料乙醇的生产效率。海藻糖对酵母菌在多种环境胁迫下的细胞活性具有保护作用,但其对乙醇耐性分子机制的研究还不够深入。克隆了自絮凝酵母Saccharomyces cerevisiaeflo的海藻糖-6-磷酸合成酶基因TPS1的启动子区域,利用pYES2.0载体骨架,构建了PTPS1启动绿色荧光蛋白EGFP标记基因的报告载体,并转化酿酒酵母ATCC4126。对酵母转化子在含有7%和10%乙醇的生长培养基中的EGFP的表达情况进行相对荧光定量分析,发现PTPS1活性在7%乙醇存在下受到强烈诱导。EGFP表达量对高温和高糖胁迫无明显差别,显示了TPS1启动子对乙醇浓度的特异响应。研究结果表明,絮凝酵母海藻糖的合成是对乙醇胁迫的保护性反应。
自絮凝酵母,海藻糖-6-磷酸合成酶TPS1,绿色荧光蛋白,报告载体,乙醇胁迫
Abstract:Improving stress tolerance of the microbial producers is of great importance for the process economy and efficiency of bioenergy production.Key genes influencing ethanol tolerance of brewing yeast can be revealed by studies on the molecular mechanisms which can lead to the further metabolic engineering manipulations for the improvement of ethanol tolerance and ethanol productivity.Trahalose shows protective effect on the cell viability of yeast against multiple environmental stress factors, however,further research is needed for the exploration of the underlying molecular mechanisms.In this study, the promoter region of the trehalose-6-phosphate synthase geneTPS1was cloned from the self-flocculating yeastSaccharomyces cerevisiae flo,and a reporterplasmid based on the expression vector pYES2.0 on which the green fluorescence protein EGFP was directed by theTPS1promoter was constructed and transformed to industrial yeast strainSaccharomyces cerevisiaeATCC4126.Analysis of the EGFP expression of the yeast transformants in presence of 7% and 10% ethanol revealed that thePTPS1activity was strongly induced by 7% ethanol,showing specific response to ethanol stress.The results of this study indicate that trehalose biosynthesis in self-flocculating yeast is a protective response against ethanol stress.
Keywords:self-flocculating yeast, trehalose-6-phosphate synthase, green fluorescence protein, report vector, ethanol stress
提高生物能源生产菌株对各种胁迫因素的耐受性对于高效生产生物能源具有重要的意义,这些胁迫因素包括高温、高渗透压、低pH以及各种毒性代谢物或原料水解产物等。对于利用酿酒酵母生产燃料乙醇,尤其是超高浓度乙醇发酵的过程,酵母菌对高浓度乙醇的耐受性是提高发酵终点乙醇浓度的重要前提,但是目前为止对影响酵母菌乙醇耐受性的因素还不够深入。研究酵母菌乙醇耐性的分子机制,有助于揭示影响其耐受性的关键基因,并通过代谢工程操作定向提高酵母菌的乙醇耐受性,从而提高燃料乙醇的生产效率[1]。
海藻糖对酵母菌在多种环境胁迫条件下的细胞活性具有保护作用,这些胁迫因素包括乙醇冲击、热冲击、冷冻、氧化胁迫等[2-4]。与海藻糖合成相关的基因包括TPS1(海藻糖-6-磷酸合成酶)、TPS2(海藻糖-6-磷酸酶)和TSL1/TPS3(海藻糖-6-磷酸合成酶的调节亚基),其中TPS1负责催化海藻糖合成的第一步反应,对海藻糖的合成具有重要作用[5]。各国学者对于海藻糖在不同酵母中的抗逆境胁迫作用进行了大量研究,得到的结论却不完全一致,如对酿酒酵母菌株Saccharomyces cerevisiaeXQ1的研究发现,海藻糖在热胁迫下明显积累,但在乙醇和高渗胁迫下其含量没有明显变化[6],而对酵母Saccharomycopsis fibuligera的研究表明,乙醇的胁迫对海藻糖的合成没有影响[7]。近期有学者对S.cerevisiaeBY4742的研究发现,海藻糖对致死乙醇浓度的胁迫有保护作用,而对半致死浓度的乙醇胁迫没有作用[8],这些研究结果提示了海藻糖对酿酒酵母的胁迫保护作用可能与菌种的遗传背景和乙醇胁迫的程度有关。
利用启动子构建报告载体可通过报告基因的表达检测外界环境对启动子活性的影响。Karreman等构建了GFP报告基因表达载体,利用热击蛋白基因Hsp12启动子驱动GFP的表达,结果证明该启动子可以响应乙醇、高温、高渗透压等多种胁迫环境[9]。本实验室前期对絮凝酵母乙醇耐性的生化机理研究表明,不同絮凝颗粒大小的絮凝酵母群体的海藻糖合成具有明显差别,其乙醇耐受性也有所差别,提示了海藻糖的生物合成与乙醇耐受性的关系。本文通过构建基于绿色荧光蛋白的报告载体进一步研究了海藻糖合成酶基因TPS1在不同浓度乙醇胁迫条件下的反应,发现TPS1启动子活性受一定乙醇浓度的诱导,进一步证明了海藻糖的生物合成与絮凝酵母乙醇耐受性的关系,为深入研究絮凝酵母乙醇耐性的分子机理奠定了基础。
1 材料与方法
1.1 微生物菌种和培养基
絮凝酵母Saccharomyces cerevisiaeflo以及酿酒酵母S.cerevisiaeATCC4126为本实验室保存。
斜面培养基(g/L):葡萄糖 20,酵母粉 4,蛋白胨 3;
生长培养基(g/L):葡萄糖 30,酵母粉 4,蛋白胨 3。
1.2 实验方法
1.2.1 酿酒酵母TPS1启动子报告载体的构建
pGEX-2T-EGFP质粒(大连理工大学李文利老师惠赠)含有EGFP基因片段,利用BamH I/EcoR I双酶切pYES2.0质粒和pGEX-2T-EGFP质粒,获得质粒 pQZ01。按照参考文献[10]中的方法提取絮凝酵母基因组 DNA作为模板,利用自行设计的引物TPS1-F(5′-GGAGGAACCGGT AGAGGACGGTTG CTGAA-3′)和 TPS1-R(5′-ATCGGTACC GATTGTC ACGGGAAGCC-3′)扩增TPS1启动子区,引物两端分别引入AgeI和KpnI酶切位点,PCR产物连接pQZ01,得到质粒pQZ02。由于酿酒酵母ATCC4126不是URA缺陷型,因此将pQZ02中的URA基因用EcoR I和NotI切除,将来自pFA6A-KanMX4的抗性基因盒用同样2种酶消化,得到质粒pQZ03。该质粒含有G418抗性基因用于酵母转化子的选择,并含有在TPS1启动子引导下的EGFP基因,因此可通过检测EGFP的表达来获得TPS1启动子对外界环境的响应情况。
1.2.2 报告载体的转化和转化子的验证
报告载体利用电击法转化工业酿酒酵母菌株S.cerevisiaeATCC4126,转化子的筛选利用G418的抗性,浓度为300 μg/mL。将抗性平板上长出的转化子提取质粒,并转化大肠杆菌E.coliXL1-Blue,将获得的大肠杆菌转化子提取质粒,以自行设计的引物KanF(5′-ATGCGCGCGCGCGCCAGATCTGTTTA GC-3′)和KanR(5′-GCGAGCTCAGCTCGTTTTC GACACTGGA-3′)扩增Kan抗性基因,并通过EcoR I和NotI双酶切质粒进一步验证。
1.2.3 报告载体转化子的荧光检测
荧光相对定量通过流式细胞仪进行(FACSCantoTM,美国DB公司)。挑取单个酿酒酵母4126转化子,接种于5 mL含有100 μg/mL G418的YPD培养基中,160 r/min、30℃振荡培养24 h,取其中的200 μL接种于50 mL含有100 μg/mL G418的YPD培养基中,30℃振荡培养至菌体进入对数前期,OD600约为0.5。取4瓶44 mL的上述对数期细胞,分别向培养基中加入0、1、3.5、6 mL无水乙醇,为控制各实验组保持相同的体积,最后用无菌水补至总体积50 mL,得到乙醇终浓度分别为0(对照组)、2%、7%、12%的培养基,于160 r/min、30℃振荡培养,分别在 0、20、40、60、90、180、360、1 320 min取样测其OD值,同时取样1 mL,8 000 r/min离心2 min,用蒸馏水洗涤2次,最后将样品稀释至细胞浓度小于106/mL,利用流式细胞仪对GFP进行荧光定量分析。
2 结果与讨论
2.1 絮凝酵母TPS1启动子区的克隆和序列分析
利用酿酒酵母S288c的TPS1启动子区序列设计引物,以絮凝酵母的基因组序列为模板,扩增出了预期大小的片段。对该扩增片段进行测序,并与模式菌株 S288c的序列进行比对分析发现,絮凝酵母TPS1启动子区除了有个别碱基存在差异,序列中部还多了一段21 bp的插入序列(图1),是一个新的启动子,该启动子序列已登录 GenBank(登录号FJ536256)。
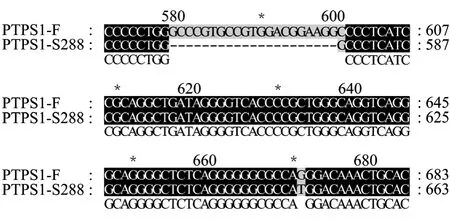
图1 絮凝酵母TPS1启动子区(PTPS1-F)与S288cTPS1启动子区(PTPS1-S288)差异序列的同源比对Fig.1 Alignment of the differential sequence of the promoter region ofTPS1from self-flocculating yeast and S288c.
2.2 报告载体对乙醇浓度的响应
由于表达载体中,EGFP融合蛋白基因的表达由TPS1启动子驱动,因此通过EGFP蛋白荧光强度来分析EGFP报告基因的表达水平,可以间接地反应出TPS1启动子的表达水平。利用7%和12%的乙醇冲击后,在 7%乙醇的实验组中绿色荧光蛋白强度明显提高(图2A),显示了TPS1启动子的活性在7%乙醇中明显提高,而且其高活性从60 min开始到 1 320 min(22 h)逐渐提高(图2A)。7%(V/V)乙醇胁迫时GFP荧光强度达到最高为11 036(A.U),是无乙醇胁迫时GFP荧光强度的7.3倍。但是由于酿酒酵母抗乙醇胁迫的能力有限,因此随着乙醇胁迫浓度的进一步加大,即达到 12%(V/V)时,细胞开始死亡,无法启动GFP基因的表达。本文也尝试了用 2%(V/V)的乙醇胁迫酵母转化子,但绿色荧光蛋白的表达与对照没有明显差别(数据未显示)。
由于细胞的生长时期和生理状态的不均一性,TPS1启动子活性的诱导在细胞群体中的不同个体可能存在差异。添加 7%乙醇后,有荧光活性的细胞数(阳性率)也明显提高(图2B),说明更多细胞表达了绿色荧光蛋白。荧光显微镜观察发现,在无乙醇胁迫以及12%(V/V)乙醇胁迫时,GFP的表达量均很低,荧光显微镜下观察到的荧光十分微弱,7%(V/V)胁迫后,GFP荧光强度很强(图3)。以上结果可以充分说明,在乙醇胁迫处理条件下,酵母菌内的TPS1启动子的表达明显强于未经胁迫处理的酵母菌,且PTPS1spsc在一定程度上是受乙醇胁迫调控的诱导型启动子。
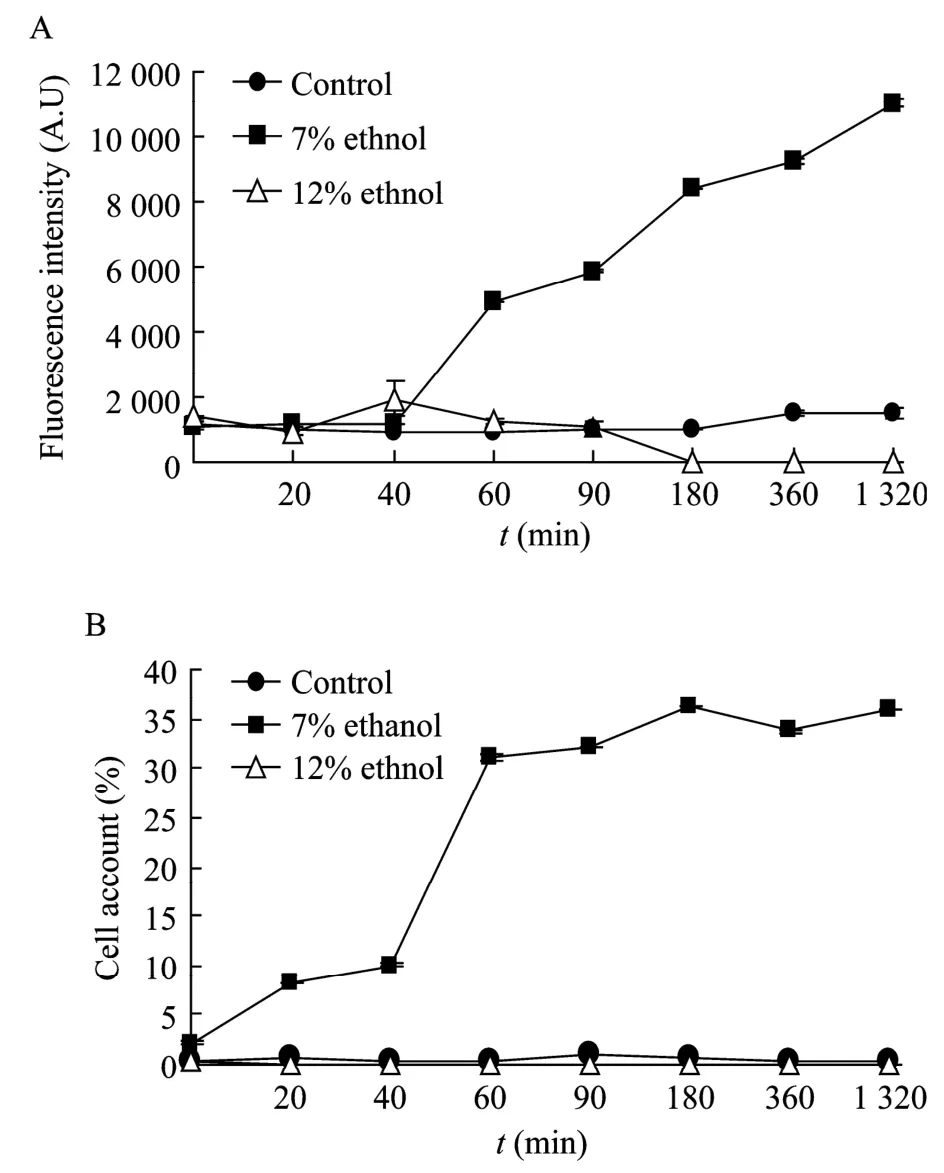
图2 絮凝酵母海藻糖合成酶启动子在乙醇胁迫下的变化(A)和GFP阳性细胞占有率(B)Fig.2 Promoter activity ofTPS1in presence of different ethanol(A)and ratio of the cells expressing GFP after 180 min(B)under different ethanol concentrations.
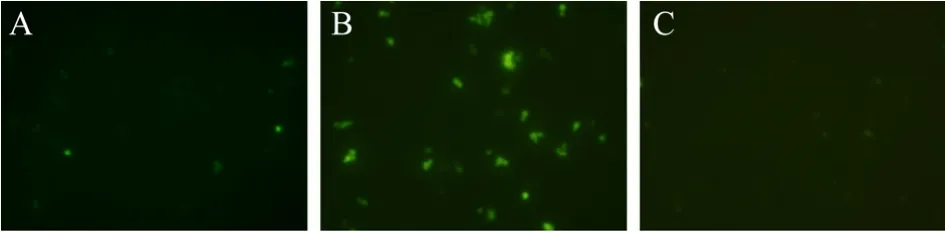
图3 不同乙醇浓度胁迫180 min时GFP表达情况的荧光显微图片Fig.3 Cells expressing GFP after ethanol shock treatment under fluorescence microscope.(A)Without ethanol.(B)With 7%(V/V)ethanol.(C)With 12%(V/V)ethanol.
由图4可以看出,用 7%(V/V)或 12%(V/V)的乙醇胁迫转基因酵母后,酵母的生长状况与不用乙醇胁迫的对照组相比,酵母的生长受到抑制,添加7%(V/V)乙醇的实验组在180 min后开始生长,但直到1 320 min,生长速度明显慢于对照组。添加12%(V/V)乙醇的实验组酵母始终没有越过停滞期,可见这 2个浓度的乙醇都对酵母起到了较强的胁迫抑制作用(图3)。另外,活性酵母细胞不容易被亚甲基兰染色,显微镜下观察到的酵母细胞较为透明,而死亡的酵母细胞容易被亚甲基兰染成紫色,亚甲基兰染色结果再次证明了 7%(V/V)和 12%(V/V)的乙醇都对酵母细胞起到了较强的胁迫作用,其中采用12%(V/V)的乙醇胁迫过度,导致大量酵母细胞死亡(结果未显示)。7%(V/V)的乙醇诱导了TPS1启动子大量启动EGFP的表达。
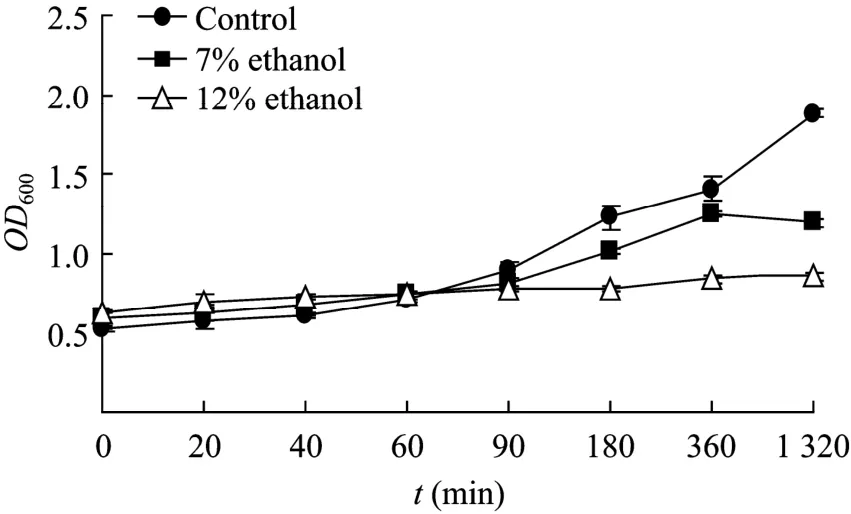
图4 酵母细胞转化子在不同浓度乙醇胁迫下的生长情况Fig.4 Cell growth of the yeast transformants in presence of different concentration of ethanol.
本实验室前期对絮凝酵母乙醇耐性的生物化学机制研究发现,絮凝酵母的乙醇耐性与细胞内的海藻糖含量相关[11-12],海藻糖也是酵母细胞在环境胁迫条件下积累的胞内产物,而海藻糖合成酶 TPS1是酵母海藻糖合成的关键酶,因此TPS1基因启动子的活性强弱可以反映TPS1基因的表达情况,进而反映海藻糖合成酶的表达量和海藻糖在酵母细胞内的合成情况。以上研究结果揭示了PTPS1spsc在乙醇胁迫下表达明显提高,证明了乙醇可在转录水平促进海藻糖的合成。
本实验室前期对絮凝酵母乙醇耐性的生化机理研究表明,乙醇耐性不同的絮凝颗粒群体的海藻糖合成情况具有明显差别[11-12],但是对海藻糖的合成与乙醇耐性的直接关系还不清楚。本文的结果表明,在一定浓度乙醇存在下,絮凝酵母海藻糖合成酶基因TPS1的启动子活性被迅速诱导,进而启动海藻糖的合成,因此絮凝酵母海藻糖的生物合成与乙醇耐受性具有密切的关系。本文发现TPS1的启动子活性在亚致死乙醇浓度下最高,显示了细胞通过启动海藻糖的合成有效保护其免受乙醇的毒害。文献报道利用热击蛋白Hsp12启动子驱动GFP的表达,发现该启动子可以响应乙醇、高温、高渗透压等多种胁迫[9],而本实验室的研究结果显示,絮凝酵母的TPS1基因启动子活性只对乙醇有响应,对高温和高糖条件没有明显响应,而且文献报道Hsp12启动子作用时间较短,80 min时GFP的表达量开始下降,这与本文所研究的启动子PTPS1spsc启动EGFP表达的持续时间较长,短时间内 EGFP的表达量无下降趋势具有明显不同,说明不同的乙醇胁迫相关基因的作用具有明显差异,能在不同时间启动相关代谢反应机制和细胞的相关防御反应。进一步的研究将揭示絮凝酵母海藻糖合成酶基因在超高浓度乙醇发酵过程中的表达量变化,并利用所建立的报告载体系统进一步研究絮凝酵母基因组内其他基因对其乙醇耐性的影响,深入揭示絮凝酵母乙醇耐性的分子机制,为选育耐受高浓度乙醇的菌株提供理论基础。
REFERENCES
[1]Zhao XQ, Bai FW.Mechanisms of yeast stress tolerance and its manipulation for efficient fuel ethanol production.J Biotechnol, 2009, 27: 849−856.
[2]Lucero P, Penalver E, Moreno E,et al.Internal trehalose protects from inhibition by ethanol inSaccharomyces cerevisiae.Appl Environ Microbiol, 2000, 66(10):4456−4461.
[3]Pereira MD, Eleutherio EC, Panek AD.Acquisition of tolerance against oxidative damage inSaccharomyces cerevisiae.BMC Microbiol, 2001, 1: 11.
[4]Pham TK, Wright PC.The proteomic response ofSaccharomyces cerevisiaein very high glucose conditions with amino acid supplementation.J Proteome Res, 2008,7(11): 4766−4774.
[5]Soto T, Fernandez J, Vicente-Soler J,et al.Accummulation of trehalose by overexpression oftps1, coding for trehalose-6-phosphate synthase, causes increased resistance to multiple stresses in the fission yeastSchizosaccharomyces pombe.Appl Environ Microbiol,1999, 65(5): 2020−2024.
[6]Li L, Ye Y, Pan L,et al.The induction of trehalose and glycerol inSaccharomyces cerevisiaein response to various stresses.Biochem Biophys Res Commun, 2009,387(4): 778−783.
[7]Liang LK, Wang XK, Zhu KL,et al.Trehalose synthesis inSaccharomycopsis fibuligeradoes not respond to stress treatments.Appl Microbiol Biotechnol, 2007, 74(5):1084−1091.
[8]Bandara A, Fraser S, Chambers PJ,et al.Trehalose promotes the survival ofSaccharomyces cerevisiaeduring lethal ethanol stress, but does not influence growth under sublethal ethanol stress.FEMS Yeast Res, 2009, 9(8):1208−1216.
[9]Karreman RJ, Lindsey GG.A rapid method to determine the stress status ofSaccharomyces cerevisiaeby monitoring the expression of aHsp12: green fluorescent protein(GFP)construct under the control of theHsp12promoter.J Biomol Screen, 2005, 10(3): 253−259.
[10]Burke D, Dawson D, Stearns T.Methods in Yeast Genetics.New York: Cold Spring Harbor Laboratory Press, 2000.
[11]Lei JJ, Zhao XQ, Xue C,et al.Influence of floc size distribution on the ethanol tolerance of a self-flocculating yeast strain SPSC01.Chin J Biotech, 2008, 24(2):309−314.雷娟娟, 赵心清, 薛闯, 等.絮凝颗粒粒度分布对自絮凝酵母 SPSC01乙醇耐受能力的影响.生物工程学报,2008, 24(2): 309−314.
[12]Xue C, Zhao XQ, Ge XM,et al.Effect of zinc ion on ethanol tolerance and floc size of self-flocculating yeast.CIESC J,2008, 59(10): 2582−2588.薛闯, 赵心清, 葛旭萌, 等.锌离子对自絮凝酵母乙醇耐性和絮凝颗粒大小的影响.化工学报, 2008, 59(10):2582−2588.
Cloning of the promoter region of the Trehalose-6-phosphate synthase gene TPS1 of the self-flocculating yeast and exploration of the promoter activity on ethanol stress
Bei Lin1,2, Xinqing Zhao1, Qiumei Zhang1, Liming Ma1, and Fengwu Bai1
1 Department of Life Science and Bioengineering, Dalian University of Technology, Dalian 116024, China 2 Department of Polytechnic, North College of Beijing University of Chemical Technology, Langfang 065201, China
Received:May 26, 2010;Accepted:June 18, 2010
Supported by:Natural Science Foundation of China(No.30500011), National High Technology Research and Development Program of China(863 Program)(No.2007AA10Z358).
Corresponding author:Xinqing Zhao.Tel: +86-411-84707617; E-mail: xqzhao@dlut.edu.cn国家自然科学基金(No.30500011),国家高技术研究发展计划(863计划)(No.2007AA10Z358)资助。

