木质纤维素生物转化产氢技术现状与发展趋势
王爱杰,曹广丽,徐诚蛟,2,任南琪
1 哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨 150090 2 东北农业大学资源与环境学院,哈尔滨 150030
木质纤维素生物转化产氢技术现状与发展趋势
王爱杰1,曹广丽1,徐诚蛟1,2,任南琪1
1 哈尔滨工业大学城市水资源与水环境国家重点实验室,哈尔滨 150090 2 东北农业大学资源与环境学院,哈尔滨 150030
氢能是一种清洁能源,利用木质纤维素类生物质生产氢气,在生产可再生绿色能源的同时,避免了木质纤维素资源未被充分利用而造成的环境污染和资源浪费,它的开发与应用对人类未来能源与经济发展具有十分重要意义。以下综述了木质纤维素生物转化产氢技术的研究现状,提出了木质纤维素生物转化产氢的总体构想与对产业发展方向的建议。
木质纤维素生物质,生物制氢,预处理,发酵
Abstract:Hydrogen production from lignocellulosic biomass is both sustainable and environmentally friendly, which is garnering more and more attention across the world, with an expectation to challenge the shortage of fossil fuels supply and climate change as well.In this article, the update research progress and technology development of biohydrogen production are reviewed, with a focus on biomass pretreatment, hydrogen-producing microorganisms and process engineering strategies.And in the meantime, a roadmap for more efficient and economic biohydrogen production is envisioned.
Keywords:lignocellulosic biomass, biohydrogen, pretreatment, fermentation
当今世界矿质能源储备的耗竭和持续的环境污染,已成为全球面临的重要问题。寻求新的可再生能源迫在眉睫。氢能作为一种高效、清洁、可再生的能源,已越来越受到人们的关注和重视[1-2]。在大力推进和支持可持续发展清洁生产项目的国际背景下,发酵法生物制氢技术因其具有清洁、节能和不消耗矿物资源等许多突出优点而备受世人关注。国内外众多的科研工作者为此开展了大量的研究工作。然而,生物制氢技术距离大规模的工业化生产还有很大的距离,尚有很多关键性技术问题有待解决。降低生产成本,提高系统的产氢效率是生物制氢技术实现工业化的根本问题。目前的研究资料表明,现有的生物制氢技术研究所利用的基质主要集中在一些简单碳水化合物如葡萄糖、蔗糖、淀粉及由这些简单化合物构成的废水等,阻碍了生物制氢技术的规模化生产。
木质纤维素生物质是地球上最丰富、最廉价的可再生资源,全世界每年通过光合作用产生的木质纤维素生物质高达1 000亿t,其中89%目前尚未被人类利用。我国的木质纤维素生物质也非常丰富,每年仅农作物秸秆就有7亿t,加上数量巨大的林业纤维废料和工业纤维废渣,每年可利用的木质纤维素生物质总量可达 20亿 t以上[3]。如此丰富的木质纤维资源除少部分用作造纸和牲畜饲料外,其余的都被堆积或者原地焚烧,不仅造成资源的浪费,也由此造成严重的环境污染问题。若能利用工农业生产的木质纤维废弃物等廉价的基质制取氢气,既能降低氢气的生产成本,又能使废弃物得到资源化。因此,开发廉价的木质纤维素生物质制氢技术,其重要意义是毋庸置疑的,该技术的研究开发及推广应用,将会带来显著的环境效益和社会效益。本文重点介绍了木质纤维素生物转化产氢研究中的关键技术问题,包括木质纤维素的预处理、水解液中抑制成分的脱除、水解液混合糖发酵产氢微生物资源及纤维素糖化发酵产氢工艺。同时,提出了利用木质纤维素资源发酵产氢的主要发展方向及前景。
1 木质纤维素生物转化产氢的主体工艺流程
木质纤维素生物质是一种潜在的低成本原料,如农作物秸秆、木屑等[3],通常含有38%~50%的纤维素、20%~35%的半纤维素和 15%~25%的木质素,其中纤维素和半纤维素可转化为发酵性糖用于氢气生产[4]。但由于木质纤维素结构复杂,利用木素纤维素中纤维素和半纤维素生产氢气时需要一些额外的工序,如预处理、脱毒处理和生产水解酶类等。图1是以木质纤维素为原料,转化为氢气的主体工艺流程。

图1 木质纤维原料生物转化氢气的主要工艺流程Fig.1 Schematic diagram of hydrogen production through bioconversion of lignocellulosic biomass.
2 木质纤维素原料的预处理
木质纤维素中纤维素由木质素和半纤维素包裹着,纤维素与半纤维素或木质素分子间的结合主要依赖于氢键;半纤维素和木质素之间除氢键外还有化学键合。半纤维素是无定形组分,含木糖、阿拉伯糖、葡萄糖等多种结构单元,易于水解;木质素和半纤维素对纤维素的包覆作用及结晶纤维素致密结构引起的反应惰性,都使纤维素酶水解严重受限。因此,需要对原料进行预处理以去除部分或全部木质素,溶解半纤维素,或破坏纤维素的晶体结构,从而减小聚合度、增加孔隙度和表面积等,以促进酶与底物相互接触并反应,提高酶解速率和得糖率。理想的预处理方法应满足以下要求[5]:1)有利于酶水解过程的糖化;2)避免碳水化合物的降解或损失;3)避免生成对后续水解或发酵有害的副产物;4)经济可行。预处理方法归纳起来包括物理法、物理化学法、化学法和生物法。
2.1 物理法
机械粉碎是常用的物理预处理方法,它能使颗粒变小,降低结晶度,对处理高结晶度和高度木质化的材料都有较高的效果。此外粉碎处理后得到的粉料具有较高的容积密度,有利于增加酶反应的底物浓度,提高酶的作用效率。粉碎处理的方法中,以球磨尤其是振荡球磨的效率更高,高温下研磨比在常温下研磨的效果更好。如果在研磨时加入少量膨胀剂或木质素溶剂亦可以提高研磨的效果。但物理法具有耗能大、成本高、生产效率低的缺点,因此研究较少[6]。
2.2 化学法
采用酸、碱、次氯酸钠、臭氧等试剂进行预处理,其中以碱和稀酸预处理研究较多。
碱预处理是利用木质素能够溶解于碱性溶液的特点,碱预处理操作简便,设备要求较低。使用较多的碱有NaOH、KOH、Ca(OH)2和氨等。用碱预处理天然木质纤维素可破坏其中木质素的结构,显著提高后续酶水解效率。碱处理法的机理在于 OH−能够削弱纤维素和半纤维素之间的氢键以及皂化半纤维素和木质素分子之间的酯键。稀NaOH可引起木质纤维原料的膨胀,结果导致内部表面积增加、聚合度降低、结晶度下降、木质素和碳水化合物之间化学键断裂,从而破坏木质素结构。碱预处理相对于酸法成本较低、操作安全,但仍需废水和残余物的回收处理工序[7]。
稀酸预处理通常采用 0.5%~2%的 H2SO4,在110℃~220℃下处理一定时间。由于半纤维素被水解成单糖,残余物形成多孔或溶胀型结构,从而促进了酶解效果。在稀酸预处理条件下,半纤维素转化成可进一步发酵的单糖,有利于资源的充分利用。但木质素依然保留在固体残渣中,对后续酶水解步骤会有一定的不良影响。
2.3 物理-化学法
物理化学方法有蒸汽爆破法、CO2爆破法、氨纤维爆破法。木质纤维素原料在高压水蒸汽或氨水中经过短时间加热后,快速地释放压力至大气压,此过程使纤维结构严重膨化破坏,从而促进后续的酶水解过程。
氨纤维爆破法是蒸汽爆破法与碱处理法的结合,即将木质纤维原料在高温和高压下用液氨处理,然后突然减压使原料爆破。利用氨气爆破处理具有很多优点:它不用机械粉碎将纤维素物料粒径变小;木质素除去后,大部分的半纤维素和纤维素可以保留下来得以充分利用;不会产生发酵抑制物,水解液可以不用处理直接发酵微生物;氨气可以回收,残留的铵盐可以作为微生物的营养[8]。
2.4 生物法
生物法是利用分解木质素的微生物降解木质素,从而提高纤维素和半纤维素的酶解糖化率。但是由于目前存在的微生物种类较少,木质素分解酶类的酶活低,作用周期长等关键技术问题,发展较慢。
目前,用于木质纤维素预处理发酵产氢的研究主要是采用化学方法预处理和物理化学方法预处理。如 Rohit等[9]采用热击活性污泥发酵中性和酸化汽爆后的玉米秸秆产氢,比产氢量分别为2.84 mol H2/mol葡萄糖和3.0 mol H2/mol葡萄糖,转化效率达到了 71%~75%;樊耀亭等[10-11]采用稀HCl处理稻草秸秆、酒糟和玉米秸秆,以牛粪堆肥为菌源进行发酵产氢。获得最大累积产氢量分别为68.1 mL/g TVS,68.6 mL/g TVS和149.69 mL/g TVS;de Vrije等[12]用NaOH处理Miscanthus脱木素后再经纤维素酶水解,得到的水解液供Thermotoga elfii发酵产氢,获得了不错的效果;周俊虎等[13]研究了活性污泥发酵稻草秸秆产氢,经NaOH预处理的的稻草产氢量达90.5 mL/g TVS。
3 木质纤维素水解液发酵产氢
利用木质纤维素水解物发酵产氢研究中主要有2个关键点:首先,如何解除木质纤维素预处理水解过程中产生的抑制物质对发酵的抑制作用:其次,木质纤维素水解产物包括戊糖(木糖、阿拉伯糖)和己糖(葡萄糖、甘露糖、半乳糖)多种糖的混合物,如何高效利用戊糖己糖混合糖进行发酵产氢。以下从抑制物的解除和混合糖发酵微生物 2个方面进行了阐述。
3.1 木质纤维素水解液中抑制物的控制
木质纤维素原料在高温高压和催化剂预处理(水解)过程中会形成多种发酵抑制物质,如糠醛、羟甲基糠醛、乙酸、酚类化合物等。由于这些抑制物质对微生物的生长代谢有抑制作用,从而使水解液中糖发酵生成氢气受到严重限制。在水解过程,抑制性物质的浓度随着预处理温度的升高、处理时间的延长和催化剂浓度的增加而增加。同时抑制性物质的生成也与木质纤维素材料的种类相关。不同木质纤维材料,其产生的抑制物质的数量与比例不同[14]。另外。多种抑制物存在时,对发酵的影响要比单一抑制物存在时强烈。如曹广丽等研究了糠醛、羟甲基糠醛、香兰素等对菌株Thermoanaerobacterium.thermosaccharolyticumW16发酵产氢的影响,发现多种抑制物同时存在时,抑制物之间存在协同增效作用[15]。
因此,采用高效、经济的方法去除或减少木质纤维素水解液中的抑制性物质,对于提高微生物的氢气转化效率具有重要意义。目前,关于木质纤维素水解液抑制成分的脱除方法已有多种报道,如活性炭吸附、负压蒸发、加碱、离子交换、微生物降解或酶解法。其中效果较好的是离子交换法,但该方法成本高,不宜在大规模生产中使用。碱法是指用碱将pH值调到10然后再调到发酵所需pH,这是目前对水解液抑制成分脱除使用最多的一种有效方法,但该方法产生大量沉淀,使水解糖液中的糖损失较大,操作复杂,因此实际应用有一定难度。负压蒸发可去除挥发性抑制剂,但该方法在大规模生产应用中受到限制。活性炭吸附是一种廉价、有效的方法,所以对活性炭吸附脱除抑制成分作了较多研究,包括pH、温度、接触时间、活性炭浓度对脱除抑制成分的影响等。微生物或酶法降解抑制性物质,目前仍在研究阶段。
3.2 木质纤维素水解液发酵产氢微生物
木质纤维素水解产物中富含戊糖(木糖、阿拉伯糖)和己糖(葡萄糖、甘露糖、半乳糖)等混合糖。其中己糖较容易被微生物利用,目前关于能够利用己糖发酵产氢的微生物已有很多报道,且已获得了一些产氢能力较高的菌株。如Kumar等[16]从树叶榨出物中分离到一株阴沟肠杆菌Enterobacter clocaeIIT-BT08,在以葡萄糖为碳源时,36℃和pH 6.0条件下,最大产氢速率可达 2 9.6 3 m m o l H2/(g-drycell·h);林明[17]从生物制氢反应器的厌氧活性污泥中分离到了一株高效产氢细菌 B49,其最大产氢速率和比产氢速率分别为 32.28 mmol H2/(g-drycell·h)和 2.34 mol H2/mol葡萄糖。相比之下,水解液中的戊糖较难被微生物利用。如果仅将水解液中的己糖部分进行较高程度的利用,产生的氢气相对于木质纤维原料的利用率也不超过40%,只有将水解液中戊糖己糖全部转化成氢气,才能获得较高的经济效益。据有关资料报道[18],若能充分利用水解液中的戊糖成分,发酵法生产燃料的生产成本可直接下降25%左右。因此,如果找到能同时利用戊糖和己糖产氢的微生物可大大提高水解液的利用效率,降低成本。近年来,研究者们陆续开展了一些关于戊糖发酵产氢及同步发酵戊糖己糖混合糖产氢的相关研究,如Kumar等分离的兼性厌氧菌Enterobacter cloacaeIIT-BT 08发酵木糖的产氢能力为0.95 mol H2/mol 木糖[16];Lo等[19]从连续流产氢反应器中分离出7株纯菌株,并考查了这7株菌发酵木糖的产氢能力,结果发现只有Clostridium butyricumandKlebsiellasp.能够利用木糖发酵产氢,其中菌株Cl.butyricumCGS5利用木糖产氢能力最高,其最大产氢速率和比产氢率分别为 212.5 mL/(L·h)and 0.73 mol H2/mol木糖;Kadar等[20]研究了Caldicellulosiruptor saccharolyticus对葡萄糖、木糖及混合糖转化产氢能力,其在木糖上的转化率为 2.24 mol H2/mol木糖,最大产氢速率为11.3 mmol/(L·h),其在葡萄糖上的转化率为2.5 mol H2/mol 木糖,最大产氢速率为 10.7 mmol/(L·h),其在葡萄糖木糖混合糖上的转化率 2.32 mol H2/mol 底物,最大产氢速率为 9.2 mmol/(L·h);曹广丽等[21]从温泉中分离出一株能有效利用葡萄糖木糖发酵产氢的高温菌T.thermosaccharolyticumW16,其在葡萄糖上的氢气转化率为2.42 mol H2/mol葡萄糖,最大产氢速率为12.9 mmol/(L·h),其在木糖上的氢气转化率为2.19 mol H2/mol木糖,最大产氢速率为10.7 mmol/(L·h)。其在不同葡萄糖/木糖浓度比混合糖上的氢气转化率为2.23~2.37 mol H2/mol 底物,最大产氢速率为11.2~12.7 mmol/(L·h)。表1列出了目前报道的能够利用戊糖发酵产氢的微生物,相对于己糖发酵产氢微生物的种类、数量,该类微生物资源还非常稀少,且目前报道的能够同步发酵戊糖己糖产氢微生物中只有嗜热菌Caldicellulosiruptor saccharolyticus和T.thermosaccharolyticumW16。因此,在今后的研究中应加强对戊糖发酵产氢微生物,尤其是具有能同步发酵戊糖己糖产氢微生物菌种资源的开发。戊糖的有效利用不仅扩展了产氢底物的利用范围,而且对提高木质纤维素水解液的利用效率起到关键作用。
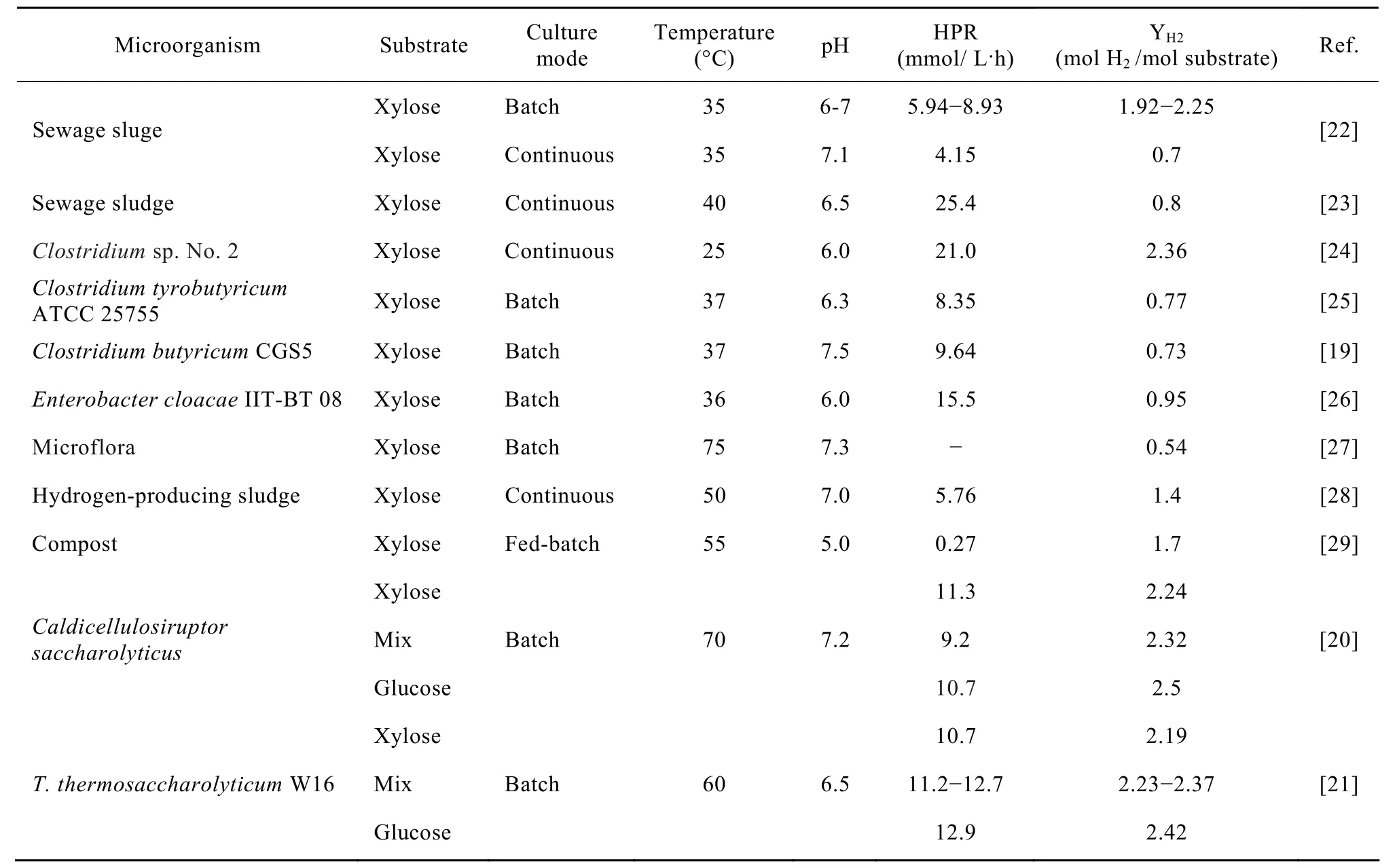
表1 文献中报道的利用戊糖发酵产氢的微生物Table 1 H2yields and production rates reported in xylose fermentation studies
4 纤维素生物转化发酵产氢
利用木质纤维素材料进行暗发酵产生氢气,通常需要对底物进行不同程度的预处理,产生大量以戊糖或己糖为主要成分的水解液,与此同时,还会有较多以纤维素为主要成分的固型物。因此,十分需要开发更具成本效益和技术上可行的纤维素产氢的过程。利用微生物降解纤维素材料并将其转化为氢气是十分重要而有效的途径[30]。纤维素产氢的过程一般需要遵循以下原则:1)有效降低生产过程中的能源需求;2)进程简捷;3)产氢率较高;4)原料价格低廉,废物利用最为理想[31-33]。
随着对纤维素质原料生物转化生产清洁能源的不断研究,先后有学者提出纤维素生物转化的工艺过程,包括分步水解发酵(Separate hydrolysis and fermentation, SHF)、同步糖化发酵(Simultaneous saccharification and fermentation, SSF)、同步糖化共发酵(Simultaneous saccharification and co-fermentation,SSCF)和联合生物加工工艺(Consolidated bioprocessing, CBP)等工艺方案。以上各种方法分别在酶的产生与提供、纤维素水解、水解物发酵过程等方面存在一定的差异(图2),这些差异也将导致纤维素产氢的效率有所不同。

图2 纤维素产氢的生物转化过程Fig.2 Cellulose bioconversion processes for hydrogen production.
4.1 分步糖化发酵
分步糖化发酵(SHF),是将纤维素酶法或微生物法水解糖化与利用糖化液发酵制氢分步进行。在这一过程中,反应或发酵条件可独立控制完成,糖化或发酵更为准确、针对性更强。在混合培养体系中,最佳酶解条件与最佳生长或产氢条件会有所不同,可能导致单方面限制产糖或产氢效率,从而降低纤维素转化效率和产氢量。因此,为更好地进行高效率生产,单独水解和方法被很多学者所采用[34]。在分步糖化发酵过程中,产物的形成也受多种因素的限制,如末端产物的反馈抑制,在糖化过程中产生的葡萄糖过量会抑制葡萄糖苷酶的活性,纤维素酶也会被纤维二糖和葡萄糖所抑制[35-37]。此外,低细胞浓度以及高浓度基质也会抑制发酵过程。
分步水解糖化发酵(SHF)从木质纤维素化学转化演变而来,即用酶解纤维素产生还原糖,进而再利用糖进行发酵。纤维素的酶解和酶解液的发酵分别在不同的反应器中进行。Datar等认为,中温厌氧细菌并不能有效利用纤维素。而此时外源纤维素酶增加更有利于中温条件下厌氧细菌利用纤维素物质产生氢气[38]。而纤维素酶解糖化又存在成本较高、酶活性及酶转化率不稳定等诸多问题,因此逐渐有人采用具有糖化功能的菌株或复合菌系对纤维素进行糖化,再进行产氢发酵。Lo等从土壤中分离可水解木质纤维物质(木聚糖、稻壳和稻草)的菌株,应用于木质纤维物质水解产糖发酵。水解液初始还原糖浓度为 0.36 g/L时,利用菌株ClostridiumbutyricumCGS5进行发酵产氢,氢气产量和氢气产率分别为88.1 mL/L和19.15 mmol H2/g还原糖或17.24 mmol H2/g 纤维素[39]。
与纯菌株相比,复合菌系同样可以应用于纤维素的糖化过程。Lo等采用分步糖化发酵产氢的方法,首先将细菌混合菌系NS和QS应用于有纤维素水解过程,当羧甲基纤维素钠(CMC)浓度为10 g/L时,混合菌系降解CMC所产生总还原糖(TRS)和还原糖(RS)产生率达到5531.0 mg/L和92.9 mg/(L·h)。再利用产氢细菌转换纤维素水解物以产生氢气。初始还原糖浓度为0.8 mg/L时,氢气的产量约为1.21 mmol H2/g还原糖(0.097 mmol H2/g纤维素)[40]。利用复合菌系进行糖化与利用酶相比,反应体系更为稳定,不易受环境影响,再利用纯菌发酵糖化产物产氢取得较好效果。但在糖化过程中,产糖效率不及酶糖化明显。
4.2 同步糖化发酵
同步糖化发酵法(SSF),即纤维素的酶水解糖化过程与厌氧产氢发酵同步进行。目前,很多学者利用糖化微生物而非直接添加酶进行糖化,并与产氢微生物进行联合培养,称之为同步糖化共发酵(SSCF)。以上两种同步糖化发酵的方法,微生物糖化及发酵过程在同一体系内进行,纤维素糖化产物很容易迅速被产氢微生物所利用,解除其对糖化反应的反馈抑制。同步糖化发酵,较大程度简化发酵设备,缩短纤维素物质转化周期,提高转化率[41-43]。因其具有设备投资成本较低,生产能耗低等工业化优势,越来越受到人们的重视,也是目前较为流行的纤维素生物转化产氢的工艺方法。
以产酸克雷伯氏菌Klebsiella oxytocaHP1为产氢菌株,以稻草粉为产氢底物,进行同步糖化发酵产氢。结果表明40℃,pH 6.5,纤维素酶用量为20 FPAU/g稻草粉,摇床转速100 r/min,发酵时间42 h时,最大氢产率为110.6 mL/g稻草粉,稻草粉的氢转化率为22%。10 L放大发酵产氢试验,最大氢产率为122.3 mL/g稻草粉,氢转化率为24.3%。与分步糖化发酵产氢相比,氢产率提高 34.4%。从而证明,利用同步糖化发酵工艺可以提高生物制氢的产量和得率[44]。
将纤维素分解菌Clostridium thermocellumDSM1237,与无纤维素分解能力的产氢菌Clostridium thermopalmariumDSM 5974,进行同步发酵糖化培养,并确定在最佳条件下,滤纸碳源量9 g/L时,最大氢气产量为1 387 mL/L培养液[45]。
同步糖发酵过程中也可将复合菌系应用于反应体系,以利于糖化过程。Lin等富集牛粪中的微生物复合菌系,并将其应用于纤维素发酵糖化及利用糖化产物发酵产氢。试验结果表明,复合菌系在最佳初始pH值7.6~8.0时,氢气的最高产量分别达到2.8 mmol H2/g纤维素,3 mmol H2/g木糖[46]。
同步糖化发酵方法与分步糖化发酵法相比,有效提高了生产效率,降低了生产与设备成本,但纤维素酶解过程与产氢发酵过程,在发酵条件、发酵周期、发酵速度等方面的不统一性,一直是限制该方法研究与应用的主要因素。
4.3 直接微生物转化产氢
直接微生物转化(Direct microbial conversion,DMC),又可称为联合生物加工工艺(CBP),是一种将纤维素酶的产生过程与糖化、产氢发酵集合在一个反应体系内同步进行,是一种将纤维素直接利用转化为氢气的生产工艺。尽管该工艺也需要对木质纤维素原料进行一些预处理,但与以上几种方法相比,较大程度地降低生产过程的能量消耗,有效地降低生产成本。因此,它正成为第 3代能源生产过程中非常经济而又受关注的目标[47-49]。
Magnusson等采用高温型厌氧纤维素分解菌株Clostridium thermocellumATCC 27405,未经任何预处理的废弃纤维素材料为底物发酵产氢,利用酒糟、大麦壳和镰刀霉污染过的大麦壳为碳源,产氢量分别为1.27 mmol H2/g葡萄糖、1.24 mmol H2/g葡萄糖和1.18 mmol H2/g葡萄糖[50]。该研究为选择用于直接发酵产氢的纤维素资源作出了有益尝试。玉米秸秆经H2SO4、NaOH和氨水浸泡,蒸汽等预处理后,利用Clostridium acetobutylicumX9进行水解并与高效产氢菌Ethanoigenens harbinenseB49进行联合培养,直接发酵纤维素产氢,B49与X9的生物强化与X9单独培养相比,有效提高纤维素水解产氢效率[51-52]。Liu等从腐败的麦秸中,以纤维二糖为底物,分离得到高温产氢菌株Clostridium thermocellumJN4和Thermoanaerobacterium thermosaccharolyticumGD17,JN4和GD17可以利用玉米芯等数种天然基质为碳源,在高温条件下发酵产生氢气。在60℃下,以0.5%的结晶纤维素为碳源,将两菌株进行联合培养,其氢气产量达到55 mmol/L[53]。
针对预处理过后的纤维素物质,David分别以0.1 g/L纤维素、滤纸、木质纤维、脱木素纤维素(DLWs)和纤维二糖为底物,利用菌株Clostridium thermocellum27405进行直接发酵产氢。结果表明,脱木素纤维素为碳源,产氢量较高,可达 1.6 mol H2/mol葡萄糖[54]。利用菌株Clostridium termitidisCT1112,比较纤维二糖和纤维素纯品为底物的直接发酵产氢能力,氢气产量分别为4.6 mmol/L培养液和7.7 mmol/L培养液[55]。
表2所列出为已报道直接利用纤维素类物质发酵产氢微生物,其中很多高温型菌株表现出较好的直接转化纤维素类物质产氢效果,受到很多研究者的关注。高温型产氢菌株与中温型相比,其在较高温度下生长特征更利于纤维素酶的反应活性,从而有效地直接利用纤维素物质发酵产氢。
5 木质纤维素生物转化产氢技术发展方向及前景
对于木质纤维素生物转化产氢而言,目前还处于起步阶段,尚有很多技术和问题需要进一步探索、研究和解决, 今后木质纤维素生物转化产氢研究的主要发展方向有:
1)加大产氢微生物资源的开发力度:大规模选育能同步发酵戊糖己糖产氢微生物及直接转化纤维素产氢的微生物,优化产氢工艺条件,建立最佳的共降解生物质废弃物产氢菌群,提高原料利用效率和目标产物收率。
2)建立木质纤维素类生物质的定向高效产氢生物技术:开发多种微生物细胞固定化、微生物耐受逆境的生物技术,增强微生物对生物质废弃物水解液中抑制成分的耐受能力,提高产氢稳定性,实现高产氢速率、产氢量和连续稳定的生物制氢过程;开发吸附、中和等方法减少或消除代谢物中抑制物的抑制作用,结合多种高效、无污染、低成本的预处理方法,针对不同类型的生物质进行处理。探索高效的预处理方法、优化预处理工艺。
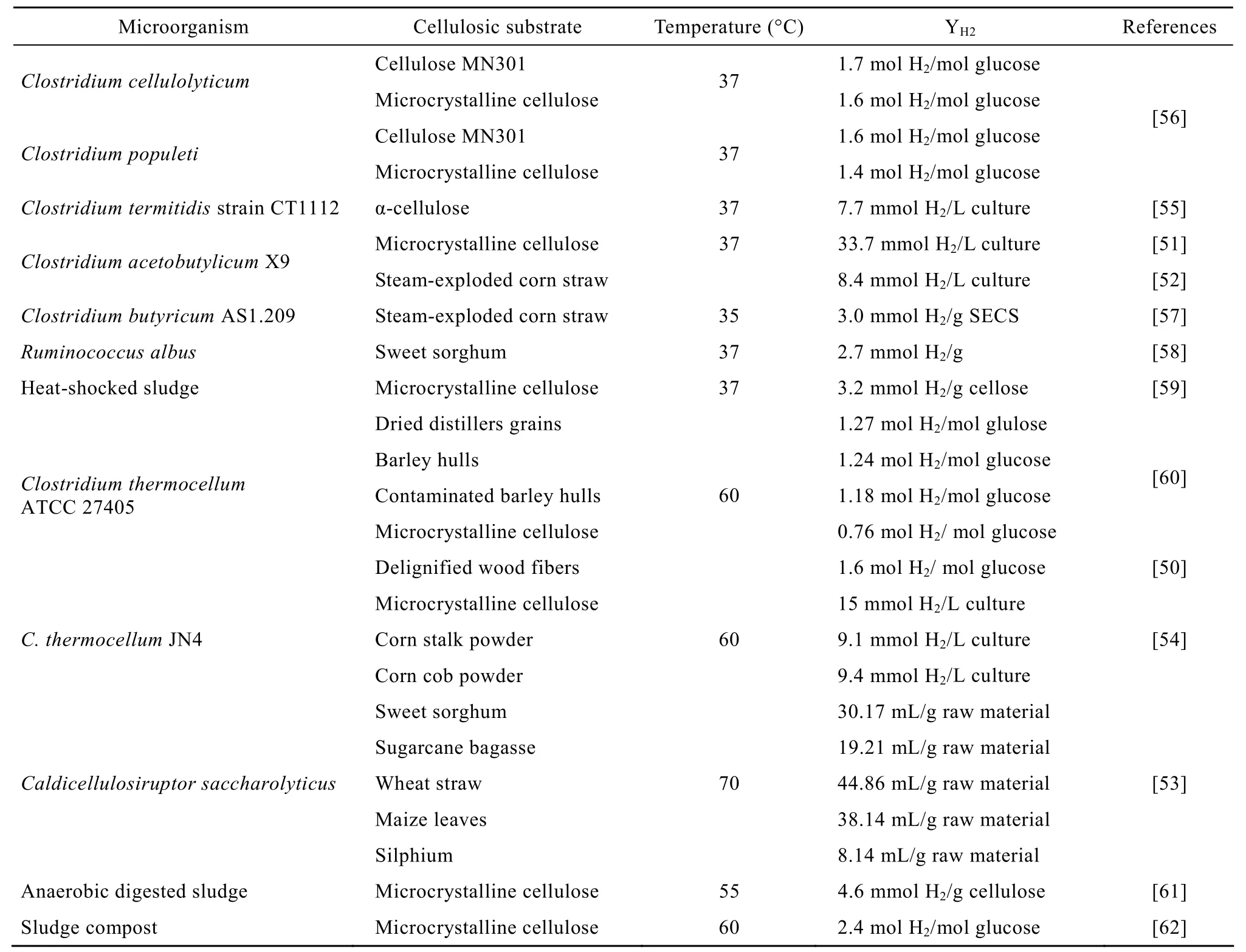
表2 文献中报道的直接利用纤维素类物质发酵产氢的微生物Table 2 Hydrogen production reported in cellulosic substrates fermentation studies
3)开发规模化木质纤维素类生物质制氢工艺:为进一步提高产氢能力,提高基质利用率和多目标产物收率,多目标联合/耦合工艺模式值得推行。如暗发酵-光发酵耦合,暗发酵-微生物电解产氢工艺耦合、产氢-产甲烷工艺耦合等。
清洁能源—氢气的利用已成为未来能源利用的发展趋势。随着生物制氢技术的发展,利用廉价的原料进行氢气生产势在必行。从可持续发展来看,以木质纤维素类生物质为原料进行氢气生产将是一个非常具有潜力的发展方向,它既有利于环境整治,又可回收能源、降低成本,是一项集环境效益、社会效益和经济效益于一体的新型环保产业,其重要意义是毋庸置疑的。同时,发展木质纤维素生物质的微生物制氢对我国能源结构调整和可持续发展具有非常迫切和重要的意义,对于解决未来能源的可持续发展问题也具有十分重要的意义,将使我国在生物制氢领域达到一个新的阶段。
REFERENCES
[1]Lee DH, Lee DJ.Biofuel economy and hydrogen competition.Energ Fuel, 2008, 22: 177–181.
[2]Bockris JM.The origin of ideas on a hydrogen economy and its solution to the decay of the environment.Int J Hydrogen Energ, 2002, 27: 731–740.
[3]Li RQ.Complex use of wastes containing cellulose.China Environ Sci, 2002, 22(1): 24–27.李日强.纤维素类废弃物的综合利用.中国环境科学,2002, 22(1): 24–27.
[4]Xing QM, Sun QZ, Gao FQ.Development of lignocellulosic materials for bioethanol production.J Agri Sci Technol, 2008, 10(S1): 41–45.邢启明, 孙启忠, 高凤芹.木质纤维素类物质生产燃料乙醇的研究进展.中国农业科技导报, 2008, 10(S1):41–45.
[5]Yang CJ, Wang Q, Zhang GY.Research progress in pretreatment techniques of lignocellulose.Liquor-Making Sci Technol, 2008, 3: 85–89.杨长军, 汪勤, 张光岳.木质纤维素原料预处理技术研究进展.酿酒科技, 2008, 3: 85–89.
[6]Sun JS, Su DH, Liu L.Pretreatment technology of corn stover for ethanol production.Progress Chem, 2007,19(7/8): 1122–1128.孙君社, 苏东海, 刘莉.秸秆生产乙醇预处理关键技术.化学进展, 2007, 19(7/8): 1122–1128.
[7]Mcmillan JD.Pretreatment of lignocellulosic biomass//Enzymatic Conversion of Biomass for Fuels Production.ACS Symposium Series.Washington, DC: American Chemical Society, 1994: 292–324.
[8]Gollapalli LE, Dale BE, Rivers DM.Predicting digestibility of ammonia fiber explosion(AFEX)-treated rice straw.Appl Microbiol Biotechnol, 2002,(98/100):23–35.
[9]Rohit D, Huang J, Maness PC,et al.Hydrogen production from the fermentation of corn stover biomass pretreated with a steam-explosion process.Int J Hydrogen Energ,2007, 32: 932–939.
[10]Fan YT, Zhang YH, Zhang SF,et al.Efficient conversion of wheat straw wastes into biohydrogen gas by cow dung compost.Bioresour Technol, 2006, 97: 500–505.
[11]Fan YT, Zhang GS, Guo XY,et al.Biohydrogenproduction from beer lees biomass by cow dung compost.Biomass Bioenergy, 2006, 30: 493–496.
[12]de Vrije T, Keijsers ERP, Claassen PAM.Pretreatment of miscanthus for hydrogen production byThermotoga eliff.Int J Hydrogen Energ, 2002, 27: 1381–1390.
[13]Zhou JH, Qi F, Cheng J,et al.Impact of alkaline pretreatment on bio-hydrogen production from straw by anaerobic fermentation.Acta Energ Solaris Sin, 2008,38(3): 229–333.周俊虎, 戚峰, 程军, 等.秸秆发酵产氢的碱性预处理方法研究.太阳能学报, 2008, 38(3): 229–333.
[14]Martin C, Fernández T, García R,et al.Preparation of hydrolysates from tobacco stalks and ethanolic fermentation bySaccharomy cescerevisiae.World JMicrobiol Biotech, 2002, 18: 857–862.
[15]Cao GL, Ren NQ, Wang AJ,et al.Effect of lignocellulosederived inhibitors on growth and hydrogen production byThermoanaerobacterium thermosaccharolyticumW16.Int J Hydrogen Energ, 2010, 35: 1–6.
[16]Kumar N, Das D.Enhancement of hydrogen production byEnterobacter CloacaeIIT-BT 08.Process Biochem, 2000,35: 589–593.
[17]Lin M.Hydrogen production mechanism and ecology of a new species of high efficiency hydrogen production by fermentation[D].Harbin: Harbin Institute of Technology,2002.林明.高效产氢发酵新菌种的产氢机理及生态学研究[D].哈尔滨: 哈尔滨工业大学, 2002.
[18]Lu P, Jiang T, Li GX.Key points of ethanol fermentation of lignocellulose and resolving methods.Chin Society Agr Eng, 2006, 26(6): 237–242.路鹏, 江滔, 李国学.木质纤维素乙醇发酵研究中的关键点及解决方案.农业工程学报, 2006, 26(6): 237–242.
[19]Lo YC, Chen WM, Chang JS,et al.Dark H2fermentation from sucrose and xylose using H2-producing indigenous bacteria: feasibility and kinetic studies.Water Res, 2008,42: 827–842.
[20]Kadar Z, van Noorden GE, Budde MAW,et al.Yields from glucose, xylose, and paper sludge hydrolysate during hydrogen production by the extreme thermophileCaldicellulosiruptor Saccharolyticus.Appl Biochem Biotechnol, 2004, 113-116: 497–508.
[21]Ren NQ, Cao GL, Wang AJ,et al.Dark fermentation of xylose and glucose mix using isolatedThermoanaerobacterium thermosaccharolyticumW16.Int J Hydrogen Energ, 2008,33: 6124–6132.
[22]Lin CY, Cheng CH.Fermentative hydrogen production from xylose using anaerobic mixed microflora.Int J Hydrogen Energ, 2006, 31: 832–840.
[23]Wu SY, Lin CY, Lee KS,et al.Dark fermentative hydrogen production from xylose in different bioreactors using sewage sludge microflora.Energ Fuel, 2008, 22:113–119.
[24]Taguchi F, Mizukami N, Saito-Taki T,et al.Hydrogen production from continuous fermentation of xylose during growth ofClostridiumsp.strain No.2.Can J Microbiol,1995, 41: 536–540.
[25]Zhu Y, Yang ST.Effect of pH on metabolic pathway shift in fermentation of xylose byClostridium tyrobutyricum.J Biotechnol, 2004, 110: 143–157.
[26]Kumar N, Das D.Enhancement of hydrogen production byEnterobacter cloacaeIIT-BT 08.Process Biochem, 2000,35: 589–593.
[27]Yokoyama H, Moriya N, Ohmori H,et al.Community analysis of hydrogen-producing extreme thermophilic anaerobic microflora enriched from cow manure with five substrates.Appl Microbiol Biotechnol, 2007, 77(1):213–222.
[28]Lin CY, Wu CC, Hung CH.Temperature Effects on fermentative hydrogen production from xylose using mixed anaerobic cultures.Int J Hydrogen Energ, 2008, 33:43–50.
[29]Calli B, Schoenmaekers K, Vanbroekhoven K,et al.Dark fermentative h2production from xylose and lactose-effects of on-line pH control.Int J Hydrogen Energ, 2008, 33:522–530.
[30]Balows A, Truper HG, Dworkin M,et al.(Eds.).The Prokaryotes.New York: Springer, 1992, 2: 460–516.
[31]Levin DB, Pitt L, Love M.Biohydrogen production:prospects and limitations to practical application.Int J Hydrogen Energ, 2004, 29: 173–185.
[32]Benemann J.Hydrogen biotechnology: progress and prospects.Nat Biotechnol, 1996, 14: 1101–1113.
[33]Nandi R, Sengupta S.Microbial production of hydrogen:an overview.Crit Rev Microbiol, 1998, 24: 61–84.
[34]Olsson L, Hahn-Hagerdal B.Fermentative performance of bacteria and yeasts in lignocellulose hydrolyzates.Proc Biochem, 1993, 28: 249–257.
[35]Dekker RFH.Kinetic, inhibition, and stability properties of a commercialβ-D-glucosidase(cellobiase)preparation fromAspergillus nigerand its suitability in the hydrolysis of lignocellulose.Biotechnol Bioeng, 1986, 28: 1438–1442.
[36]Hong J, Ladisch MR, Cong CS,et al.Combined product and substrate inhibition equation for cellobiase.Biotechnol Bioeng, 1981, 24: 2779–2788.
[37]Alfani F, Cantarella L, Gallifuoco A,et al.Membrane reactors for the investigation of product inhibition on enzyme activity.J Membr Sci, 1990, 52: 339–350.
[38]Datar R, Huang J, Maness PC,et al.Hydrogen production from the fermentation of corn stover biomass pretreated with a steam-explosion process.Int J Hydrogen Energ,2007, 32: 932–939.
[39]Lo YC, Saratale GD, Chen WM,et al.Isolation of cellulose-hydrolytic bacteria and applications of the cellulolytic enzymes for cellulosic biohydrogen production.Enzyme Microb Technol, 2009, 44: 417–425.
[40]Lo YC, Bai MD, Chen WM,et al.Cellulosic hydrogen production with a sequencing bacterial hydrolysis and dark fermentation strategy.Bioresour Technol, 2009, 99:8299–8303.
[41]Stenberg K, Bollok M, Reczey K,et al.Effect of substrate and cellulase concentration on simultaneous saccharification and fermentation of steam-pretreated softwood for ethanol production.Biotechnol Bioeng, 2000,68: 204–210.
[42]Alfani F, Gallifuoco A, Saporosi A,et al.Comparison of SHF and SSF processes for the bioconversion of steam-exploded wheat straw.J Ind Microb Biotechnol,2000, 25: 184–192.
[43]Eklund R, Zacchi G.Simultaneous saccharification and fermentation of steam-pretreated willow.Enzyme Microb Technol, 1995, 17: 255–259.
[44]QI YL, Du J, Xu HJ,et al.Biohydrogen production from rice straw by simultaneous saccharification and fermentationusing Klebsiella oxytocaHP1.J Xiamen Univ:Natural Sci, 2007, 46(5): 707–710.
[45]Geng A, He YL, Qian CL,et al.Effect of key factors on hydrogen production from cellulose in a co-culture ofClostridiumthermocellumandClostridium thermopalmarium.Bioresour Technol, 2010, 101:4029–4033.
[46]Lin CY, Hung WC.Enhancement of fermentative hydrogen/ethanol production from cellulose using mixed anaerobic cultures.Int J Hydrogen Energ, 2008, 33:3660–3667.
[47]Lynd LR.Overview and evaluation of fuel ethanol production from cellulosic biomass: technology,economics, the environment, and policy.Annu Rev Energy Environ, 1996, 21: 403–465.
[48]Lynd LR, vanZyl WH, McBride JE,et al.Consolidated bioprocessing of cellulosic biomass: an update.Curr Opin Biotechnol, 2005, 16(5): 557–583.
[49]Demain AL, Newcomb M, Wu JHD.Cellulase, clostridia,and ethanol.Microbiol Mol Biol Rev, 2005, 69: 124–154.
[50]Magnusson L, Islam R, Sparling R,et al.Direct hydrogen production from cellulosic waste materials with a single-step dark fermentation process.Int J Hydrogen Energ, 2008, 33: 5398–5403.
[51]Ren NQ, Wang AJ, Gao LF,et al.Bioaugmented hydrogen production from carboxymethyl cellulose and partially delignified corn stalks using isolated cultures.Int J Hydrogen Energ,2008, 33: 5250–5255.
[52]Wang AJ, Ren NQ, Shi YJ,et al.Bioaugmented hydrogen production from microcrystalline cellulose using co-culture—ClostridiumacetobutylicumX9 andEthanoigenens harbinenseB49.Int J Hydrogen Energ,2008, 33: 912–917.
[53]Liu Y, Yu P, Song X,et al.Hydrogen production fromcellulose by co-culture ofClostridium thermocellumJN4 andThermoanaerobacterium thermosaccharolyticumGD17.Int J Hydrogen Energ, 2008, 33: 2927–2933.
[54]Levin DB, Islam R, Cicek N,et al.Hydrogen production byClostridium thermocellum27405 from cellulosic biomass substrates.Int J Hydrogen Energ, 2006, 31:1496–1503.
[55]Ramachandran U, Wrana N, Cicek N,et al.Hydrogen production and end-product synthesis patterns byClostridiumtermitidisstrain CT1112 in batch fermentation cultures with cellobiose or a-cellulose.Int J Hydrogen Energ, 2008, 33: 7006–7012.
[56]Li DM, Chen HZ.Biological hydrogen production from steam-exploded straw by simultaneous saccharification and fermentation.Int J Hydrogen Energ, 2007, 32(12):1742–1748.
[57]Ntaikou I, Gavalaa HN, Kornaros M,et al.Hydrogen production from sugars and sweet sorghum biomass usingRuminococcus albus.Int J Hydrogen Energ, 2008, 33:1153–1163.
[58]Zhang ML, Fan YT, Xing Y,et al.Enhanced biohydrogen production from cornstalkwastes with acidification pretreatment by mixed anaerobic cultures.Biomass Bioenergy, 2007, 31: 250–254.
[59]Fan YT, Zhang YH, Zhang SF,et al.Efficient conversion of wheat straw wastes into biohydrogen gas by cow dung compost.Bioresour Technol, 2006, 97: 500–505.
[60]Fan YT, Zhang GS, Guo XY,et al.Biohydrogenproduction from beer lees biomass by cow dung compost.Biomass Bioenerg, 2006, 30: 493–496.
[61]Ivanova G, Rákhely G, Kovács KL.Thermophilic biohydrogen production from energy plants byCaldicellulosiruptor saccharolyticusand comparison with related studies.Int J Hydrogen Energ, 2009, 34:3659–3670.
[62]Ueno Y, Kawai T, Sato S,et al.Biological production of hydrogen from cellulose by natural anaerobic microflora.J Ferment Bioeng, 1995, 79: 395–397.
Progress and technology development on hydrogen production through bioconversion of lignocellulosic biomass
Aijie Wang1, Guangli Cao1, Chengjiao Xu1,2, and Nanqi Ren1
1 State Key Laboratory of Urban Water Resource and Environment, Harbin Institute of Technology, Harbin 150090, China 2 College of Resources and Environment, Northeast Agricultural University, Harbin 150030, China
Received:May 24, 2010;Accepted:June 9, 2010
Supported by:National Natural Science Foundation of China(Nos.30470054, 50638020).
Corresponding author:Nanqi Ren.Tel/Fax: +86-451-86418180; E-mail: rnq@hit.edu.cn Aijie Wang.Tel/Fax: +86-451-86418180; E-mail: waj0578@hit.edu.cn国家自然科学基金(Nos.30470054, 50638020)资助。

