低水用量约束条件下的高固体含量纤维乙醇生物加工技术策略
张建,楚德强,于占春,张小希,邓红波,王修胜,朱智楠,张怀庆,戴干策,鲍杰
1 华东理工大学生物工程学院 生物反应器工程国家重点实验室,上海 200237 2 中国石油吉林燃料乙醇有限公司,吉林 132101 3 华东理工大学化学工程学院 化学工程联合国家重点实验室,上海 200237
低水用量约束条件下的高固体含量纤维乙醇生物加工技术策略
张建1,楚德强1,于占春2,张小希2,邓红波2,王修胜1,朱智楠1,张怀庆1,戴干策3,鲍杰1
1 华东理工大学生物工程学院 生物反应器工程国家重点实验室,上海 200237 2 中国石油吉林燃料乙醇有限公司,吉林 132101 3 华东理工大学化学工程学院 化学工程联合国家重点实验室,上海 200237
木质纤维素原料生物转化生产纤维乙醇需要使用大量的水和蒸汽,从而使过程能耗和废水排放显著增加,大幅度增加了加工成本。最大限度地降低水和蒸汽用量对过程节能和废水减排并对最终成本控制极为重要。对极限低水用量约束条件下木质纤维素生物转化关键路径进行了实验研究和计算分析,确定了极低水和蒸汽用量的新型预处理技术,实现高效率预处理过程的废水零排放;采用独特的生物脱毒技术,用从自然界筛选的煤油霉菌Amorphotheca resinaeZN1对预处理原料中的抑制物进行了快速生物脱毒;对极限高固体含量下高粘度多相流物系在复杂抑制物胁迫下的酶水解与发酵行为以及放大准则进行了研究;建立了基于Aspen plus平台上的生物质加工物性数据库和严格热力学意义上的全过程流程模拟数学模型,实现了对过程的局部和全局设计与调优。这一综合技术在生物炼制微型工厂中进行了测试,并在纤维素乙醇工业示范装置中得到了应用。该研究结果将为构建具有工业实用价值的节能和清洁化木质纤维素生物转化技术提供依据。
木质纤维素生物转化,极限低水用量策略,煤油霉菌,同步糖化与发酵,流程模拟
Abstract:The massive water and steam are consumed in the production of cellulose ethanol, which correspondingly results in the significant increase of energy cost, waster water discharge and production cost as well.In this study, the process strategy under extremely low water usage and high solids loading of corn stover was investigated experimentally and computationally.The novel pretreatment technology with zero waste water discharge was developed; in which a unique biodetoxification method using a kerosene fungus strainAmorphotheca resinaeZN1 to degrade the lignocellulose derived inhibitors was applied.With high solids loading of pretreated corn stover, high ethanol titer was achieved in the simultaneous saccharification and fermentation process, and the scale-up principles were studied.Furthermore, the flowsheet simulation of the whole process was carried out with the Aspen plus based physical database, and the integrated process developed was tested in the biorefinery mini-plant.Finally, the core technologies were applied in the cellulose ethanol demonstration plant, which paved a way for the establishment of an energy saving and environment friendly technology of lignocellulose biotransformation with industry application potential.
Keywords:lignocellulose bioconversion, extremely low-water-usage strategy,Amorphotheca resinaeZN1, simultaneous saccharification and ethanol fermentation, flowsheet simulation
木质纤维素原料经过生物转化生产纤维乙醇需要进行预处理、酶水解(糖化)、发酵等基本过程。以美国和中国为代表的超级农业大国和超级生物质生产大国,近年来在以纤维素乙醇为代表的木质纤维素生物转化技术上进行了巨额投资,两国都形成了 2015年前后完成产业化技术示范、2030年前后形成规模化纤维素乙醇产业的共识[1-3]。目前纤维素乙醇产业形成的主要障碍在于木质纤维素生物转化过程的成本过高,具体体现在纤维素酶价格昂贵、木质纤维素对乙醇收率低、预处理和精馏过程的能耗高、以及大量富含多种木质纤维素降解产物的废水处理所导致的环境成本[4-5]。在以往和正在进行的研究中,大量注意力都放在了降低纤维素酶成本和提高乙醇收率的菌种等物耗所导致的成本问题上,而高能耗和废水排放这类在大尺度过程上才得以充分显现的工程问题则关注较少[6-8]。在工业示范工程实施之前,这类问题很难获得实用的方案,甚至很难认识到关键问题所在[9-10]。
从能耗角度进行分析,木质纤维素生物转化过程的能耗主要表现在预处理过程的蒸汽消耗和低浓度乙醇发酵液的提浓精馏能耗[4,11-14]。精馏能耗是工业生产中能耗最大的单元操作之一,一般占工厂总能耗的 50%~90%。乙醇精馏能耗与发酵液中的乙醇浓度关系显著,乙醇浓度每一个百分点的提高都伴随着精馏能耗的显著降低[4]。达到较高乙醇浓度的先决条件是在生物转化体系中加入尽可能高的木质纤维素固体原料,从酶水解过程中获得尽可能多的可发酵单糖,进而在发酵后获得较高的乙醇浓度[15]。然而,固体原料含量的提高会产生诸多生物反应器设计和操作上的工程问题[11,14]。另一方面,当从预处理的角度考虑能耗时,降低高温蒸汽的用量是主要考虑因素。在保证预处理效率的前提下减少预处理高温蒸汽的用量是减少预处理能耗的主要手段。
从降低废水排放的角度分析,木质纤维素生物转化过程的废水排放主要出现在预处理废水排放和发酵废水排放两个工序。目前世界上已经或正在实施的纤维乙醇工业示范项目,预处理后的木质纤维素物料均需经过一定形式的脱毒处理方可进入后续的同步糖化与发酵工序,如水洗、过碱化调节(Overliming)、真空蒸发、活性炭/离子交换树脂吸附、沉淀等手段,脱除预处理工段产生的大量复杂的抑制物组分,使得后续的同步糖化与发酵可以正常进行[16-23]。这两个步骤都伴随着固液分离以及大量富含多种木质纤维素降解产物和无机盐成分的废水的产生(15~25吨新鲜水/吨乙醇)。以最常用的稀酸预处理为例,预处理过程的固液比一般在1∶6~1∶10,即处理1 kg的固体原料,需要使用6~10 kg的稀酸溶液[24-25]。这不仅使过程水耗显著增加,而且预处理后的木质纤维素原料含水量增加,使后续降低能耗为目标的高固体含量同步糖化与发酵操作无法实施。另一个问题是水洗或过碱化处理中所必须涉及的固液分离只能在开放体系中进行,由此产生的固体原料染菌问题极难避免[26]。
基于上述对工业示范实践问题的观察与思考,木质纤维素转化过程中水和蒸汽的大量使用可以被认为是最关键的技术障碍之一。在保证生物转化过程收率和效率的前提下,最大限度地降低水和蒸汽的用量对过程节能和废水减排具有极为重要的作用。本文从工程角度提出了一个应对高能耗和废水排放的极限低水用量的生物转化技术策略,主要内容可以简述为:从第一步工序预处理在保证效率的前提下压缩固液比至1∶1,即总水用量不超过木质纤维素干固体质量,预处理过程不产生任何废水;第二步工序采用作者提出的独特的煤油真菌Amorphotheca resinaeZN1生物脱毒技术,脱毒过程不使用任何耗水和耗能的操作,此过程不经过固液分离直接进入下一工序;第三步工序酶水解(糖化)与发酵过程采用极限高固体含量的同步糖化与发酵工艺,在低纤维素酶用量的条件下,以极低机械能耗获得不低于8%(V/V)的高浓度乙醇发酵液。这一极限低水策略可以有效解决上述工业实践中出现的问题:极限低水用量的预处理过程可以降低新鲜水和蒸汽用量的50%~80%以上,过程不产生任何废水;预处理物料无需水洗、过碱化处理等高耗水处理工序,无需固液分离等引起染菌的操作;预处理物料直接进行无需能耗和水耗的快速固体静态生物脱毒,以脱除预处理过程产生的各种抑制物;生物脱毒后预处理物料无需进行任何灭菌过程和脱水过程直接作为高固体含量同步糖化与发酵过程的原料;独特的生物反应器设计可以非常理想地适用于高固体含量的同步糖化与乙醇发酵过程,减少废水排放,有效解决高粘度多相体系的混合与传递问题;高抗逆乙醇发酵菌种可以很好地适用于高抑制物体系。
这一基于极限低水用量的生物转化策略已经在作者建立的木质纤维素生物转化微型工厂中进行了测试,初步证明了这一策略的有效性。部分设想如适用于高固体含量的同步糖化与发酵生物反应器等已经在工业示范技术中进行了应用。
1 材料与方法
1.1 材料
1.1.1 玉米秸秆与纤维素酶
实验中所用玉米秸秆来自吉林,2007年秋收获。经过粗切、清洗、除尘、烘干,并经过直径为10 mm的圆孔筛进行筛分后,装入塑料防潮袋中备用。
实验中所用纤维素酶为 Accellerase1000(购自杰能科国际有限公司,Genencor International),纤维素酶活和纤维二糖酶活分别为 65.8 FPU/mL和152.0 IU/mL。
1.1.2 菌种
生物脱毒所用菌种Amorphotheca resinaeZN1为本实验室从自然界分离纯化得到。高抗逆乙醇发酵菌种Saccharomyces cerevisiaeDQ1为本实验室诱变选育得到。
1.1.3 培养基
PDA培养基:取去皮马铃薯200 g,切成小块,加水1 L,煮沸l h,用8层纱布过滤,然后补水至1 L,并添加葡萄糖20 g,琼脂粉20 g,pH自然。
合成培养基:KH2PO42.0 g/L,MgSO4·7H2O 1.0 g/L,(NH4)2SO41.0 g/L,酵母粉 1.0 g/L,葡萄糖20.0 g/L,pH自然,分装于三角瓶中20 mL/100 mL。
25%和50%的水解液培养基:将在30%(W/W)固体含量条件酶解得到的水解液与合成培养基分别以1∶3和1∶1(V/V)的比例混合,pH调整至5.0,即可分别得到25%和50%的水解液培养基,分装于三角瓶中20 mL/100 mL。
种子培养基:成分同50%的水解液。
上述培养基经过115℃、20 min灭菌后备用。
此外,在进行同步糖化与发酵操作时,发酵体系中营养盐的浓度为:KH2PO42.0 g/L,MgSO4·7H2O 1.0 g/L,(NH4)2SO41.0 g/L,酵母粉 1.0 g/L。
1.2 仪器与设备
1.2.1 预处理反应器
预处理反应器为自行设计和制造。主要由蒸汽发生器、高压反应釜和储料仓 3部分组成。蒸汽发生器工作压力为 3.0 MPa;高压反应釜设计容积为15 L,最多可装填干基秸秆800 g;高压蒸汽由反应釜底部经分散器喷射进入反应釜,与稀酸预浸后的玉米秸秆直接接触。反应釜内温度以及外壁温度分别由热电偶监测。
1.2.2 同步糖化与发酵生物反应器
适合于高固体含量同步糖化与发酵的生物反应器为自行设计,详细结构参见文献[12]。反应器内部容积为 5 L,搅拌桨为正螺旋螺带桨、涡轮/翼型搅拌桨和底桨,正螺旋螺带桨通过支撑杆固定在搅拌轴上,并自上而下盘旋在搅拌轴周边;涡轮/翼型搅拌桨设置于正螺旋螺带桨形成的框体内,固定在正螺旋螺带桨的上下两个端部之间的搅拌轴上;底桨固定在搅拌轴的底端,紧贴罐体底部。同时,反应器上安装有功率测定仪,可以监测搅拌桨的实时功耗变化。
1.2.3 生物脱毒反应器
生物脱毒反应器为5 L培养箱,安装有控温和控湿设备。
1.3 方法
1.3.1 极限低水用量的高温稀酸预处理及效果评价
称取一定量干基玉米秸秆,按一定的液固比加入不同浓度的稀 H2SO4溶液,预浸一定时间。将预浸好的秸秆装填入预处理反应器进行预处理,温度160℃~200℃,压力 1.0~1.6 MPa,保温 3~15 min。预处理物料不经水洗直接在0.1 mol/L、pH为4.8的柠檬酸缓冲液体系中进行糖化评价;固体含量5.0%(W/W),内含60 μg的四环素和80 μg的放线菌酮;加酶量为15.0 FPU/g DM,于50℃、180 r/min的恒温水浴摇床上酶解72 h。每组3个平行实验,酶解结束后取样分析。
1.3.2 预处理秸秆的生物脱毒
从Amorphotheca resinaeZN1斜面接一环孢子于PDA斜面培养基,25℃静置培养3 d后,用20 mL无菌水将斜面上的孢子洗出,接入盛有 200 g稀酸预处理后且pH调整至6.0的玉米秸秆的生物脱毒反应器中,维持25℃、60%的湿度进行脱毒共培养3 d。脱毒后将物料保存于−20℃冰箱中待用。
1.3.3 同步糖化与发酵
同步糖化与发酵过程根据温度的不同分为 2个阶段,即预酶解阶段和同步糖化与发酵阶段。预酶解阶段的条件为50℃、150 r/min,以15 FPU/g DM加入所需纤维素酶,再以补料的方式加入稀酸预处理后的秸秆,至固体含量达到 30%(W/W)。完成预酶解之后,调整反应器温度至37℃、pH 5.0,以10%(V/V)的接种量接入驯化后的酵母种子液,同步糖化与发酵阶段开始。该阶段持续48 h或60 h。每隔6 h取样,10 000 r/min离心5 min,取上清进行HPLC分析。
30%固体含量水解液的制备同同步糖化与发酵过程中预酶解阶段操作,酶解持续48 h。然后8 000 r/min离心10 min,收集上清液即得到30%固体含量的水解液。
1.3.4 分析方法
玉米秸秆组分分析:玉米秸秆中纤维素、半纤维素和木质素含量由Foss 2021纤维素分析仪(Foss A/S,丹麦)测定。原始秸秆中纤维素、半纤维素和木质素的含量分别为32.6%、26.4%和8.1%。秸秆中含水量的测定是将样品置于 105℃烘箱中烘 12 h至恒重,通过差重法计算其含水量。
预处理后玉米秸秆中水不溶性固体含量(Water insoluble solids,WIS)的测定:称取一定量的预处理后的玉米秸秆,以10∶1(V/W)的比例加入去离子水,室温下振荡混合2 h,用砂芯漏斗抽滤,然后重复上述步骤,直至滤液中葡萄糖浓度低于0.1 g/L,将固体收集后烘干至恒重,利用差重法计算WIS。
葡萄糖、木糖、乙醇及抑制物浓度分析:葡萄糖、木糖、乙醇、乙酸、乙酰丙酸、糠醛及羟甲基糠醛通过高效液相色谱仪测定。条件为:Bio-Rad HPX-87H柱,流动相为 5 mmol/L硫酸,流速为0.6 mL/min,柱温65℃,示差折光检测器(RID-10A)监测,样品经过适当的稀释并用0.22 μm的滤膜过滤,进样量为20 μL。
葡萄糖得率和木糖得率:葡萄糖得率和木糖得率的计算参照美国可再生能源实验室的 LAP-008(2001)的方法[27]。
螺带桨反应器内流型分布模拟:采用计算流体力学软件CFX 11.0(ANSYS Inc.)对反应器内的流型分布进行模拟。反应器内的流体简化为均一的液体模型,其粘度为10 Pa·s(与实际物系粘度相当),搅拌桨转速为150 r/min。
2 结果与讨论
2.1 极限低水用量的稀酸预处理
一般预处理过程的固液比一般在1∶6~1∶10,即处理1 kg的固体原料,需要使用6~10 kg的稀酸溶液[24-25]。木质纤维素原料由于其固有的高度吸水特性,即使含水率高于90%时,原料状态仍呈现为分散状的小颗粒固体。这使得在低水用量的预处理过程中,木质纤维素固体原料、稀酸液体、高温蒸汽三相之间的传热、传质和混合成为影响预处理效率的关键因素。
本文对不同预浸状态下稀硫酸浓度、固液比(稀硫酸与干基秸秆质量之比)、温度、时间、原料装量、蒸汽压力的变化对预处理过程中能耗、水耗及预处理后秸秆酶解效果的影响进行了实验。表 1列出了预浸固液比及预处理时装料量对预处理过程的影响。从表 1可以看出,随着预浸时固液比从 2/1降低到1/2,预处理蒸汽用量从41.9 g/100 g DM增到59.1 g/100 g DM,增加了41.1%;水耗(包括新鲜水和蒸汽冷凝水)增加近 3倍,预处理后秸秆固体含量从50.1%降至26.5%,而预处理后秸秆的酶解性能基本没有变化(葡萄糖得率稳定在 85%左右,木糖得率有所提高)。同时,降低预处理时的装料量(从800 g到400 g),随之带来的是蒸汽用量加倍,水耗增加了将近50%,预处理后物料的固体含量也有大幅下降(从50.1%降低到37.7%),而秸秆的酶解性能没有明显变化。从表 1中也可以看出,延长预处理时间可以提高秸秆的预处理效果,但伴随着预处理过程能耗和水耗的增加。
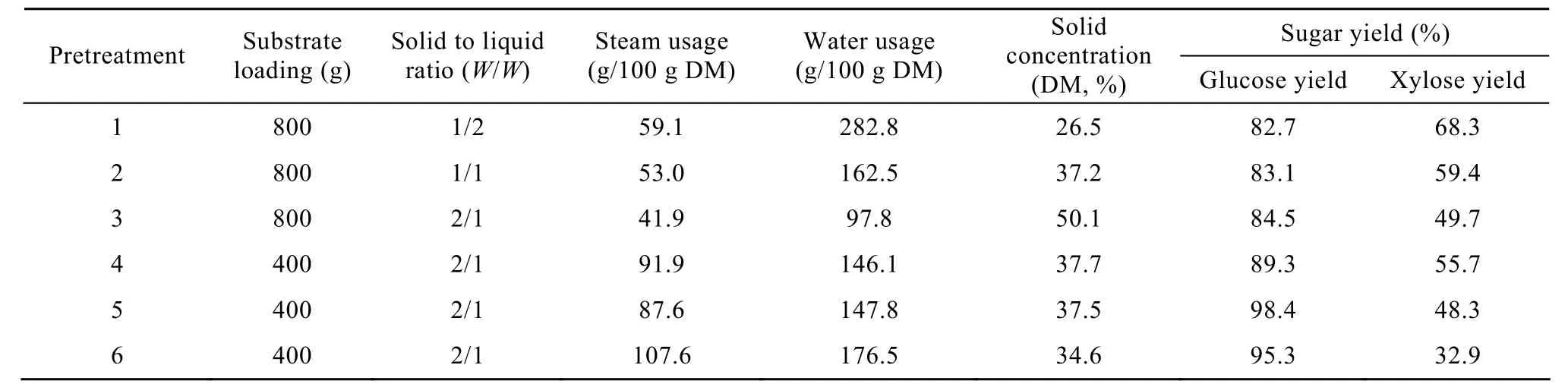
表1 不同稀酸预处理条件下蒸汽用量、水用量及预处理秸秆的酶解效果Table 1 Effect of different pretreatment conditions on the steam and water usage and enzymatic hydrolysis
从上述分析可知,影响预处理原料酶水解效率的主要因素除了在以往大量研究中认知的稀酸浓度、反应温度、反应时间以外,原料预浸时的液固比和原料在预处理时反应器内的装填量也是影响预处理酶水解效率、水耗和能耗的主要因素。预浸时固液比的降低对预处理效率的影响有限,但对预处理用水量的降低影响明显,因为预浸固液比的降低与预处理所用蒸汽的增加并不存在线性关系。换言之,预处理固液比的显著降低在对预处理效率改变不明显的情况下,仅导致了蒸汽用量的有限增加。另一个影响预处理效率的因素是预处理反应器的原料装填量。实验发现当增大预处理反应器的原料装填量时,预处理效率基本不变,而蒸汽消耗则大量降低,从而显著降低了过程的能耗和水耗。原因可能是由于秸秆原料的强大和快速的吸水能力,使预处理原料吸收蒸汽的速率快于反应器内蒸汽冷凝的速率。当预处理反应器满载时,进入的蒸汽大部分用于加热秸秆,即大部分消耗的蒸汽都是有效蒸汽;而当反应釜装料量较少时,则造成了较多蒸汽的自然冷凝而形成无效蒸汽。使用本文所述预处理反应器,选择 100%固体原料装填率,预浸固液比为 2/1,预浸稀硫酸浓度为2.5%,190℃维持3 min,在维持相同或相近的预处理效率的结果的同时,新鲜水用量和蒸汽用量比目前典型的稀酸预处理技术指标大量降低,稀酸用量与固体原料比率不超过0.5∶1,消耗蒸汽与固体原料比率不超过0.5∶1,即预处理全过程的液固比不超过 1∶1,最终获得的预处理原料含水率不超过50%,实现预处理过程稀酸废水的零排放。
2.2 预处理后木质纤维素的生物脱毒与水洗脱毒
预处理过程中木质纤维素发生部分降解,产生包括有机酸类(乙酸、甲酸、乙酰丙酸)、呋喃类(糠醛、羟甲基糠醛)、酚类化合物(香兰素、对羟甲基苯甲醛)等在内的各种类型的降解产物,对后续的酶水解和乙醇发酵菌种形成强抑制作用。有效脱除预处理原料所含的抑制物(即“脱毒”)是生物转化过程中一个必需的步骤。我们从自然界分离筛选到3株能够快速代谢预处理后秸秆中抑制物的霉菌(分别命名为 ZN1、ZN2、ZN3),其菌落形态如图1所示。对3株菌进行了16S rDNA分子生物学鉴定和NCBI数据库进行BLAST同源性比较后确定的结果表明,3株霉菌分别属于Amorphotheca resinae、Penicillium polonicum、Penicillium turbatum。脱毒能力实验的结果表明,Amorphotheca resinaeZN1可代谢的抑制物种类和脱毒时间较另外两株菌更有优势,所以在生物脱毒实验中选取菌株Amorphotheca resinaeZN1。
对稀酸预处理后的玉米秸秆原料进行水洗脱毒和生物脱毒的实验结果见表 2。从表 2可以看出,随着水洗时用水量的增加,秸秆中的抑制物浓度有明显的减少,但可发酵单糖也随之流失。而使用A.resinaeZN1进行2 d生物脱毒后,秸秆中的抑制物明显减少,单糖虽然有少量消耗,但是纤维素的含量基本没有变化,原料固体含量稳定在40%左右,能够与后续的高固体含量同步糖化与发酵工艺很好的衔接起来。实验结果表明,典型的稀酸预处理玉米秸秆在1~3 d的A.resinaeZN1生物脱毒后,秸秆物料不经过灭菌步骤直接进入同步糖化与发酵生物反应器进行高固体含量操作。

表2 稀酸预处理玉米秸秆进行不同脱毒后秸秆中成分变化Table 2 The composition variations in corn stover after different detoxification methods
2.3 高固体含量下高粘度体系的同步糖化(酶水解)与发酵
在高固体含量条件下,木质纤维素酶水解形成的液-固两相体系具有极高的粘度和非牛顿流体特征,并依预处理强度不同含有不同浓度的有机酸、呋喃、苯酚类降解产物。在进入同步糖化与发酵阶段后,发酵产生的CO2气体与原有的液-固两相形成一个类似于气溶胶形式的高粘度气-液-固多相复杂体系,传质、传热、酶反应、细胞活性、气体释放等行为都受到极大的抑制。这一复杂的体系中酶水解和发酵的行为表征、类气溶胶体系抑制的解除是过程强化的关键因素。
本文结合高固体含量玉米秸秆同步糖化与发酵过程中粘度的变化、固体含量的变化、CO2溢出速率的变化规律等特征参数研发了一种新型的能够处理高固体含量、高粘度含气泡复杂体系的新型螺带桨反应器[12]。同时,利用计算流体力学(CFD)软件对螺带桨反应器中的流型分布进行了模拟(图2)。从图2可以看出,在高粘度的同步糖化与发酵体系中,物流在整个反应器内形成了一个大的循环,即随着螺带桨的旋转,底部物料顺着螺带的方向从反应器外周盘旋而上,到达螺带的顶部后沿着搅拌轴落下;同时,反应器内也形成了无数的小循环,即在螺带与罐壁的交界处部分物料形成了二次绕流,这也是反应器中剪切最强的部位,它们促进了整个反应体系的混合与传质[12]。
图3表示经过不同脱毒处理的玉米秸秆在同步糖化与发酵过程中,葡萄糖的消耗和乙醇的生成情况。从图3可以看出,没有经过脱毒处理的玉米秸秆由于抑制物的大量存在,严重影响了纤维素酶的催化活力,导致预酶解结束时体系中的葡萄糖浓度仅为 47.4 g/L,远低于经过脱毒处理体系的60 g/L左右。同时,抑制物的存在也影响了酵母菌的正常生长和乙醇代谢过程,发酵结束体系的乙醇浓度仅为7.8 g/L。随着水洗时用水量的增加,秸秆中的抑制物浓度逐渐降低,酵母菌的延滞期明显缩短,葡萄糖的消耗速率和乙醇的生成速率明显加快。而经过生物脱毒的玉米秸秆其葡萄糖消耗速率和乙醇生成速率与1倍水洗脱毒的效果相当,发酵结束体系中乙醇浓度能达到41 g/L左右的水平。

图1 霉菌的不同菌落形态Fig.1 The different phenotypes of mold colonies.

图2 螺带桨反应器中的流型分布Fig.2 The fluid flow distribution in the helical bioreactor.

图3 不同脱毒方法对玉米秸秆高固体含量 SSF性能的影响Fig.3 The effect of different detoxification methods on the SSF performances of high solids loading corn stover.
2.4 基于Aspen plus平台的木质纤维素物性数据库和过程全流程数学模拟

图4 基于Aspen plus平台建立的年产3 000吨纤维乙醇数学模型Fig.4 The established simulation model for 3 000 ton/year cellulosic ethanol production flow chart based on Aspen plus technology.
本文在Aspen plus流程模拟平台上构建了从木质纤维素原料生产燃料乙醇的全流程数学模型(图4)。严格热力学基础上的木质纤维素生物质物性数据库,包括标量常数数据库、饱和蒸汽压数据库、汽化热数据库、固体摩尔体积数据库、理想气体热容数据库、固体热容数据库、液相热容数据库等。模拟系统对基于3 000 吨/年玉米秸秆生产燃料乙醇工业示范项目流程进行了严格的流程模拟。数学模型包括34个单元操作设备,75股物流,26种组分。操作方式采用拟稳态方法,并与实际过程的半连续方法实现了等价匹配。对涉及的26种生物质组分初步建立了生物质模拟用物性数据库。物性模型采用了严格的热力学方法模型。对全流程进行了案例计算,对过程参数进行全局调优。模拟计算结果已经用于工业示范项目的物料平衡和热量平衡计算。
对不同预处理原料进行案例计算的结果(表 3)表明,降低预处理时的固液比,同时采用高固体含量SSF工艺,尽管乙醇生产效率和后续分离的能耗不变,但新鲜水用量和污水产量都随之增加;如果在高固液比(2/1)的条件下进行预处理,而降低SSF过程的固体含量,尽管没有污水产生,但是用于条件SSF工艺固体含量的新鲜用水量逐步增加,更为严重的是,乙醇的生产效率大幅降低,蒸馏单位重量的乙醇所消耗的能量也大幅度提高。因此,这再次证明了我们开发的高固液比预处理、固态生物脱毒和高固含量SSF工艺是节水、零污染、乙醇产率高且分离能耗低的环境友好型工艺。
2.5 生物炼制微型工厂平台以及工业示范应用
本文所提出的极限低水用量约束下的高固体含量纤维乙醇生物加工技术策略在生物反应器工程国家重点实验室生物炼制微型工厂公共平台进行了测试。图5是微型工厂的流程示意简图。微型工厂以典型的农作物秸秆为原料,经过一套生物转化的完整流程,日产1 kg燃料乙醇;同时利用乙醇发酵产生的CO2,经过第二套生物转化流程日产1 kg琥珀酸。微型工厂平台共包括原料仓储区/原料罐区、前处理工段、预处理工段、同步糖化与乙醇发酵工段、琥珀酸发酵工段、产品提纯工段等6个主要工段。
这一策略的主要内容在中石油3 000 吨/年玉米秸秆生产燃料乙醇产业化示范项目得到了应用。该工业示范项目由国家发改委和中石油投资,由吉林燃料乙醇有限公司实施,是一套严格意义上的纤维乙醇工业示范装置,计划于 2010年开工,2010年底完工并试车。本文所述的糖化与发酵技术、全流程物料与热量衡算等已经在该装置上得到了应用。
3 结论
从木质纤维素原料进行生物转化生产纤维乙醇需要使用大量的水和蒸汽,从而使过程能耗和废水排放显著增加。最大限度地降低水和蒸汽的用量对过程的节能和废水减排极为重要。本文从纤维素乙醇工业示范的实践中提炼出了一个极限低水策略,从工程角度对水和蒸汽用量进行了严格控制。本实验对极限低水用量约束下的木质纤维素生物转化关键路径进行了实验研究和计算分析,对极限低水和极限低蒸汽用量下的影响酶水解效率、能耗、水耗的关键因素进行了研究,确定了最适的预处理工艺技术;采用独特的生物脱毒技术,用作者从自然界筛选的煤油霉菌Amorphotheca resinaeZN1对预处理原料中的抑制物进行了快速的生物脱毒;对极限高固体含量下高粘度多相流物系在复杂抑制物胁迫下的酶水解与发酵行为以及放大准则进行研究。这一综合技术在作者建立的生物炼制微型工厂中进行了测试并已在纤维素乙醇工业示范装置中得到了应用。本文所提出的技术思路将为构建具有工业实用价值的节能和清洁化木质纤维素生物转化技术提供依据。

表3 利用Aspen plus模拟不同预处理固液比条件的纤维乙醇生产案例计算Table 3 Case simulation of cellulosic ethanol production under different S/L ratio during pretreatment process with Aspen plus

图5 生物反应器国家重点实验室生物炼制微型工厂流程图Fig.5 The flow chart of mini-plant for biorefinery in state key laboratory of bioreactor engineering.
REFERENCES
[1]Department of Energy of USA(DOE), Office of Biomass Program.Biomass Multi-year Program Plan.Washington DC, USA, November 2007.
[2]Department of Energy of USA(DOE), Office of Biomass Program.Major DOE Biofuels Project Locations:Geographic, Feedstock, and Technology Diversity.Washington DC, USA, January 2009.(http://www1.eere.energy.gov/biomass/pdfs/biofuels_project_locations.pdf)
[3]Technological Development Roadmap for Chinese Biomass Resource to the Year of 2050.Beijing: Science Press, 2009.中国至 2050年生物质资源科技发展路线图.北京: 科学出版社, 2009.
[4]Galbe M, Sassner P, Wingren A,et al.Process engineering economics of bioethanol production.Adv Biochem Engin/Biotechnol, 2007, 108: 303−327.
[5]Lynd LR, Laser MS, Bransby D,et al.How biotech can transform biofuels.Nat Biotechnol, 2008, 26: 169−172.
[6]Tolan JS.Iogen’s process for producing ethanol from cellulosic biomass.Clean Techn Environ Policy, 2002, 3:339−345.
[7]Larsen J, Petersen MO, Thirup L,et al.The IBUS process-lignocellulosic bioethanol close to a commercial reality.Chem Eng Technol, 2008, 31: 765−772.
[8]Gerbens-Leenes PW, Hoekstra AY, Van der Meer T.The water footprint of energy from biomass: A quantitative assessment and consequences of an increasing share of bio-energy in energy supply.Ecol Econ, 2009, 68:1052−1060.
[9]Kristensen JB, Felby C, Jørgensen H.Yield-determining factors in high-solids enzymatic hydrolysis of lignocellulose.Biotechnol Biofuels, 2009, 2: 11.
[10]Bao J Translation.Curent Bioenergy Technology.Beijing:Science Press, 2009.鲍杰, 译.现代生物能源技术.北京: 科学出版社, 2009.
[11]Jørgensen H, Vibe-Pedersen J, Larsen J,et al.Liquefaction of lignocellulose at high-solids concentration.Biotechnol Bioeng, 2007, 96: 862−870.
[12]Zhang J, Chu DQ, Huang J,et al.Simultaneous saccharification and ethanol fermentation at high corn stover solids loading in a helical stirring bioreactor.Biotechnol Bioeng, 2010, 105: 718−728.
[13]Jørgensen H, Kristensen JB, Felby C.Enzymatic conversion of lignocellulose into fermentable sugars:challenges and opportunities.Biofuels Bioprod Bioref,2007, 1: 119−134.
[14]Varga E, Klinke HB, Reczey K,et al.High solid simultaneous saccharification and fermentation of wet oxidized corn stover to ethanol.Biotechnol Bioeng, 2004,88(5): 567−574.
[15]Olofsson K, Bertilsson M, Lidén G.A short review on SSF– an interesting process option for ethanol production from lignocellulosic feedstocks.Biotechnol Biofuels,2008, 1: 7.
[16]Palmqvist E, Grage H, Meinander NQ,et al.Main and interaction effects of acetic acid, furfural, and p-hydroxybenzoic acid on growth and ethanol productivity of yeasts.Biotechnol Bioeng, 1999, 63(1): 46−55.
[17]Palmqvist E, Hahn-Hagerdal B.Fermentation of lignocellulosic hydrolysates.I: inhibition and detoxification.Bioresource Technol, 2000, 74: 17−24.
[18]Mussatto SI, Roberto IC.Alternatives for detoxification of diluted-acid lignocellulosic hydrolyzates for use in fermentative processes: a review.Bioresource Technol,2004, 93: 1−10.
[19]Martinez A, Rodriguez ME, York SW,et al.Effects of Ca(OH)2treatments(“Overliming”)on the composition and toxicity of bagasse hemicellulose hydrolysates.Biotechnol Bioeng, 2000, 69(5): 526−536.
[20]Zautsen RRM, Maugeri-Filho F, Vaz-Rossell CE,et al.Liquid-liquid extraction of fermentation inhibiting compounds in lignocellulose hydrolysate.Biotechnol Bioeng, 2009, 102(5): 1354−1360.
[21]Miyafuji H, Danner H, Neureiter M,et al.Effect of wood ash treatment on improving the fermentability of wood hydrolysate.Biotechnol Bioeng, 2003, 3(84): 390−393.
[22]Dong HW, Bao J.Biofuel via biodetoxification.Nat Chem Biol, 2010, 6: 316−318.
[23]Nichols NN, Sharma LN, Mowery RA,et al.Fungal metabolism of fermentation inhibitors present in corn stover dilute acid hdyrolysate.Enzyme Microb Technol,2008, 42: 624−630.
[24]Wyman CE, Dale BE, Elander RT,et al.Coordinated development of leading biomass pretreatment technologies.Bioresour Technol, 2005, 96: 1959−1966.
[25]Himmel ME, Ding SY, Johnson DK,et al.Biomass recalcitrance: engineering plants and enzymes for biofuels production.Science, 2007, 315: 804−807.
[26]Monavari S, Galbe M, Zacchi G.The influence of solid/liquid separation techniques on the sugar yield in two-step dilute acid hydrolysis of softwood followed by enzymatic hydrolysis.Biotechnol Biofuels, 2009, 2: 6.
[27]National Renewable Energy Laboratory(NREL).SSF Experimental Protocols: Lignocellulosic Biomass Hydrolysis and Fermentation.Golden, CO: National Renewable Energy Laboratory, 2001, LAP-008.
Journals.im.ac.cn
Process strategy for ethanol production from lignocellulose feedstock under extremely low water usage and high solids loading conditions
Jian Zhang1, Deqiang Chu1, Zhanchun Yu2, Xiaoxi Zhang2, Hongbo Deng2, Xiusheng Wang1,Zhinan Zhu1, Huaiqing Zhang1, Gance Dai3, and Jie Bao1
1 State Key Laboratory of Bioreactor Engineering, School of Biotechnology, East China University of Science and Technology, Shanghai 200237, China 2 Jilin Fuel Ethanol Co., PetroChina, Jilin 132101, China 3 State Key Laboratory of Chemical Engineering, School of Chemical Engineering, East China University of Science and Technology, Shanghai 200237, China
Received:May 23, 2010;Accepted:June 28, 2010
Supported by:National Natural Science Foundation of China(No.20976051), Ministry of Education of China(No.20090074110013), Fundamental Research Funds for the Central Universities, Shanghai Leading Academic Discipline Project(No.B505), China National Special Fund for State Key Laboratory of Bioreactor Engineering(No.2060204).
Corresponding author:Jie Bao.Tel: +86-21-64251799; E-mail: jbao@ecust.edu.cn国家自然科学基金(No.20976051),教育部博士点基金(No.20090074110013),中央高校基本科研业务费专项资金,上海市重点学科建设项目(No.B505),科技部生物反应器工程国家重点实验室专项基金(No.2060204)资助。

