河南省耐多药结核分枝杆菌链霉素耐药相关基因rpsL和rrs突变分析
贾琼 石大伟 赵玉玲 李辉 陈彦丞 李亮 朱国峰
(1.中国医学科学院/北京协和医学院病原生物学研究所 北京 100176;2.河南省疾病预防控制中心 郑州 450016;3.国家科学技术部办公厅 北京 100862;4.北京结核病胸部肿瘤研究所 北京 101149)
链霉素是第一个用于治疗结核病的药物[1]。由于用于治疗结核病历史较长,链霉素耐药在全球较为严重。在我国链霉素的耐药率为20.5%,在4种常用一线抗结核药物的耐药率中最高[2]。虽然链霉素的高耐药率及其耳毒性限制了该药在治疗耐多药结核中的应用,但是在按阶梯原则使用注射类抗结核药时链霉素仍是首选[3]。因此,使用分子生物学技术早期快速检测结核分枝杆菌的链霉素耐药性对于及时制定和调整耐多药(MDR)结核病的治疗方案具有重要意义。结核分枝杆菌rpsL和rrs基因的突变与链霉素耐药有关,但多数研究[1,4-6]显示检测此2个基因突变最多可发现80%左右的链霉素耐药菌株。本研究通过对来自于河南省的较大样本的耐多药结核分枝杆菌的链霉素相关基因rpsL的编码区全长和rrs高频突变区中的突变进行分析,力图为开发和应用适合该地区乃至更大范围的快速检测耐多药结核分枝杆菌链霉素耐药性的分子诊断工具提供更多的数据。
1 材料和方法
1.1 菌株来源 115株耐多药结核分枝杆菌株来源于河南省疾病预防控制中心,分离培养自2007至2009年河南省结核病患者(包括新发和复发患者,男82例,女33例,年龄15到86岁)的痰标本。另收集了22株对利福平、异烟肼、乙胺丁醇和链霉素全敏感菌株作为对照。
1.2 菌株的分离培养、菌种鉴定和药物敏感性实验菌株分离培养、菌种鉴定按照中国防痨协会2006年修订并出版的《结核病诊断实验室检验规程》中推荐的实验方法进行。药敏实验为WHO推荐的比例法。
1.3 结核分枝杆菌基因组DNA提取和rpsL、rrs基因的PCR扩增和测序 采用煮沸法提取结核分枝杆菌基因组DNA。使用Phusion热启动高保真DNA聚合酶扩增rpsL、rrs基因全长序列。PCR扩增和测序所用引物序列见表1。测序工作由北京诺赛基因组研究中心有限公司完成。
1.4 测序数据分析和统计分析 分别使用软件Seqman pro(version 7.1,DNAstar Lasergene,Inc.,USA)和SPSS for windows(version 10.0,SPSS,Inc.,USA)进行测序数据统计分析。参比序列为结核分枝杆菌H37Rv标准株DNA序列。
2 结果
115株耐多药(MDR)结核分枝杆菌株中有114株获得良好的扩增产物和测序数据。114株中99株为链霉素耐药,15株为链霉素敏感。
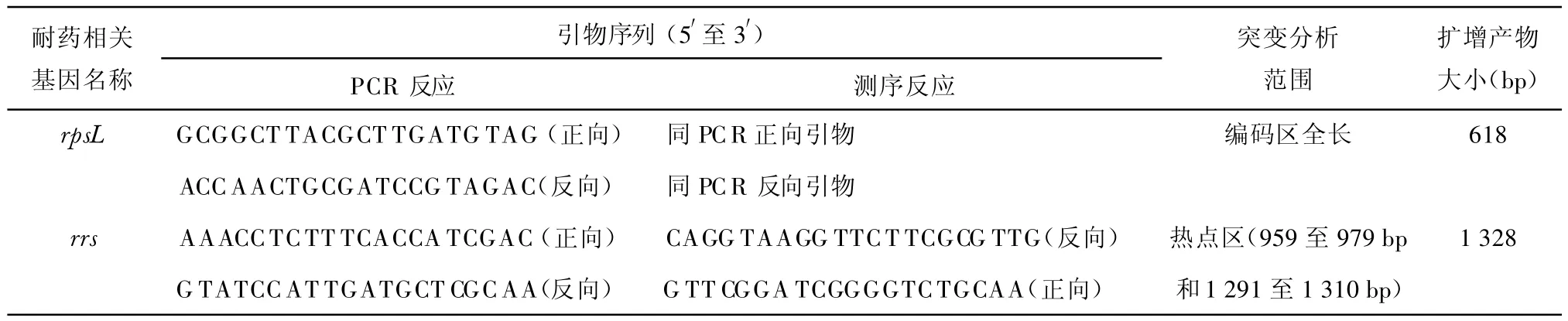
表1 rpsL和rrs基因PCR扩增和测序相关信息

表2 链霉素耐药相关基因rpsL和rrs突变特征(按突变位点分析)
在完成分析的114株 MDR结核分枝杆菌的rpsL和rrs基因中,共检测到10个突变位点(以密码子编号计算),详见表2。其中同义突变为rpsL39(1株)和rpsL121(114株)。在结核分枝杆菌耐药相关基因突变和多态性数据库(www.tbdreamdb.com)中检索发现的10个突变位点,有4个突变位点未见记录:非同义突变 rpsL2(1株)、rrs1443(1株)和同义突变rpsL39、rpsL121。所有MDR菌株和22株全敏感菌株均发生rpsL121位突变,检索TBDB数据库(www.tbdb.org)显示 rpsL 121位AAA→AAG为多态性改变,与链霉素耐药性无关。
rpsL和rrs基因的突变类型均为点突变,未发现插入或缺失。rpsL 43位点的突变类型有两种:AAG→ACG(1株)和AAG→AGG(62株),主要为AAG→AGG(K43R),均为密码子第二个碱基的突变。rpsL 88位点的突变类型为:AAG→ACG(2株)、AAG→AGG(11株)、AAG →ATG(1株)。rrs基因的各突变位点只发现一种突变类型(表2)。
除去仅发生同义突变和多态性位点的菌株,共有80.7%(92/114)的MDR结核分枝杆菌的 rpsL和rrs基因发生突变(发生1个及1个以上位点突变的菌株)。不考虑单点同义突变和多态性位点,发生rpsL 43突变的菌株比例最高,为55.3%;其次是rpsL 88,为 12.3%;再次是 rrs1440,为 9.6%,但其中10株为合并rpsL 43突变。发生rrs513突变的菌株有10株,其中有9株是 rrs基因单点突变;发生rrs516突变的菌株有4株,均为rrs基因单点突变(表2)。
单独检测rpsL基因突变可以发现74.7%对链霉素耐药的MDR菌株,加入rrs基因后灵敏度提高至 88.9%(88/99)。有 63株 MDR菌株发生rpsL43突变,但这些菌株中有3株是链霉素敏感菌株,另有1株链霉素敏感的MDR菌株发生 rrs513突变。
3 讨论
本研究中rpsL基因的突变主要发生在rpsL43和 rpsL88,rpsL43的主要突变类型为 AAG→AGG,其次是AAG→ACG,但后者只有1株发生该突变,这与已有研究的结果一致[4,7-8]。虽发现2个新突变位点(rpsL2和 rrs1443),但各只有1株,且与rpsL43突变同时发生,其在链霉素耐药产生中的作用需要进一步研究。
99株链霉素耐药株中有74株发生 rpsL43或rpsL88突变,即 rpsL基因突变可解释74.7%的MDR菌株的链霉素耐药性,这个比例略高于某些研究的结果,但与中国中部的研究相近(76.5%)[4]。本研究中,rpsL和rrs基因突变总共可以解释88.9%的MDR菌株链霉素耐药,同样高于某些研究的结果:美洲(56%~68%)[9],德国(48%)[10],和日本(77.8%)[6],但与中国中部的研究接近(85.2%)[4]。链霉素耐药株的 rpsL和rrs基因的高突变频率提示在河南地区通过检测上述位点预测链霉素耐药性有较高的潜在应用价值。
rpsL 43突变菌株被认为多数为链霉素高水平耐药[1],但在本研究中发现有3株链霉素敏感菌株发生了 rpsL 43突变。此外还有1株敏感株发生rrs513突变。这些敏感株发生的突变降低了检测的特异度。国内也有研究报道[11-12]少数链霉素敏感株也发生rpsL和rrs基因突变的现象,但多被认为是突变检测或耐药性检测的误差导致。我们认为,这种现象与对乙胺丁醇敏感的MDR菌株中发生embB306突变相似[13-14],其原因可能与菌株对利福平或/和异烟肼耐药有关。这4株结核分枝杆菌均为乙胺丁醇敏感,因此突变与乙胺丁醇耐药有关的可能性不大。另一方面,鉴于所检测样品为均为MDR菌株,其中部分菌株很可能具有对二线药的耐药性,且已有研究表明 rrs突变和二线药物卡那霉素的耐药有关[15],因此不能排除上述4株链霉素敏感菌株的突变和菌株对二线药物的耐药有关。我们将检测上述链霉素敏感菌株对卡那霉素、阿米卡星等药物的耐药性并进一步扩大样本量以验证链霉素敏感菌株发生rpsL和rrs基因突变现象的普遍性。
本研究中约有11%的链霉素耐药菌株没有发生rpsL和rrs基因的突变,有研究这指出这些菌株的耐药性较低而使药物敏感实验检测时易于出现误差[16],其耐药机制也可能是细胞膜通透性的改变,但也不能排除还存在链霉素耐药的其他机制。有研究报道gidB基因和链霉素耐药有关,[17],但有研究指出该基因突变在敏感菌株也会出现[18]。因此,链霉素耐药的分子机制及耐药分子指标还需深入研究以进一步阐明。
[1] Ramaswamy S,Musser JM.Molecular genetic basis of antimicrobial agent resistance in Mycobacterium tuberculosis:1998 update.[J] .Tuber Lung Dis,1998,79(1):3-29.
[2] He GX,Zhao YL,Jiang G L,Liu YH,Xia H,Wang SF,Wang LX,Borgdorff MW,van der Werf M J,van den Hof S.Prevalence of tuberculosis drug resistance in 10 provinces of China[J] .BMC Infect Dis,2008,8:166.
[3] 肖和平,唐神结.耐药结核病防治手册[M] 北京:人民卫生出版社,2009,88-89.
[4] Shi R,Zhang J,Li C,Kazumi Y,Sugawara I.Detection of streptomycin resistance in Mycobacterium tuberculosis clinical isolates from China as determined by denaturing HPLC analy sis and DNA sequencing[J] .Microbes Infect,2007,9(14-15):1538-1544.
[5] Ramaswamy SV,Dou SJ,Rendon A,Yang Z,Cave M D,G raviss EA.Genotypic analysis of multidrug-resistant Mycobacterium tuberculosis isolates from Monterrey,Mexico[J] .J Med Microbiol,2004,53(Pt 2):107-113.
[6] Katsukawa C,T amaru A,Miyata Y,Abe C,M akino M,Suzuki Y.Characterization of the rpsL and rrs genes of streptomycinresistant clinical isolates of Mycobacterium tuberculosis in Japan[J] .J Appl Microbiol,1997,83(5):634-640.
[7] Musser JM.Antimicrobial agent resistance in mycobacteria:molecular genetic insights[J] .Clin Microbiol Rev,1995,8(4):496-514.
[8] Sreevatsan S,Pan X,Stockbauer KE,Williams DL,Kreiswirth BN,Musser JM.Characterization of rpsL and rrs mutations in streptomycin-resistant Mycobacterium tuberculosis isolates from diverse geog raphic localities[J] .Antimicrob Agents Chemother,1996,40(4):1024-1026.
[9] Morris S,Bai GH,Suffy s P,Portillo-Gomez L,Fairchok M,Rouse D.Molecular mechanisms of multiple drug resistance in clinical isolates of Mycobacterium tuberculosis[J] .J Infect Dis,1995,171(4):954-960.
[10] Dobner P,Bretzel G,Rusch-Gerdes S,Feldmann K,Rifai M,Loscher T,Rinder H.Geographic variation of the predictive values of genomic mutations associated with streptomycin resistance in Mycobacterium tuberculosis[J] .Mol Cell Probes,1997,11(2):123-126.
[11] 吴雪琼,庄玉辉.结核分枝杆菌链霉素耐药基因的检测[J] .中华结核和呼吸杂志,1996,19(6):342-345.
[12] 邵明明,薛欣,楚雍烈,寻萌,宋娟,曹春霞,邱奕.结核分枝杆菌链霉素耐药基因 rpsL的检测[J] .中国病原生物学杂志,2008,3(9):651-653.
[13] Mokrousov I,Otten T,Vyshnevskiy B,Narvskaya O.Detection of embB306 mutations in ethambutol-susceptible clinical isolates of Mycobacterium tuberculosis from Northwestern Russia:implications for genotypic resistance testing.[J] .J Clin Microbiol,2002,40(10):3810-3813.
[14] Lee AS,Othman SN,Ho YM,Wong SY.Novel mutations within the embB gene in ethambutol-susceptible clinical isolates of Mycobacterium tuberculosis[J] .Antimicrob Agents Chemother,2004,48(11):4447-4449.
[15] Alangaden GJ,Kreiswirth BN,Aouad A,Khetarpal M,Igno FR,M og hazeh SL,Manavathu EK,Lerner SA.M echanism of resistance to amikacin and kanamycin in Mycobacterium tuberculosis[J] .Antimicrob Agents Chemother,1998,42(5):1295-1297.
[16] Meier A,Sander P,Schaper KJ,Scholz M,Bottger EC.Correlation of molecular resistance mechanisms and phenotypic resistance levels in streptomycin-resistant Mycobacterium tuberculosis[J] .Antimicrob Agents Chemother,1996,40(11):2452-2454.
[17] Okamoto S,T amaru A,Nakajima C,Nishimura K,Tanaka Y,T okuyama S,Suzuki Y,Ochi K.Loss of a conserved 7-methylguanosine modification in 16S rRNA confers low-level streptomycin resistance in bacteria[J] .M ol Microbiol,2007,63(4):1096-1106.
[18] 石瑞如,张健源,刘新,张国龙,李传友.链霉素耐药结核分枝杆菌临床分离株gidB基因突变研究[J] .中国防痨杂志,2008(3):197-199.

