体外诱导禽巴氏杆菌链霉素耐药株及耐药机制的初步分析
汪最 孔令严 邵华斌 卢琴 罗青平 杨玉莹

摘要:為了研究多杀性巴氏杆菌(Pasteurella multocida,Pm)对链霉素(Streptomycin,Str)药物敏感性变化及其耐药机制,采用体外诱导法对禽源Pm亲本敏感株(C48-1)进行诱导后成功获得Str耐药株,并对Str耐药株的最小抑菌浓度(MIC)、生化特性、生长曲线、耐药稳定性、耐药基因点突变以及耐药逆转性进行了研究。结果表明,与亲本株相比,Str耐药株生化特性与生长曲线无显著差异,MIC值由8 μg/mL上升至1 024 μg/mL;发现耐药基因StrA、StrB,且核糖体基因rpsL编码的氨基酸发生了Lys43→Thr突变;耐药逆转性试验中羰基氰氯苯腙(CCCP)将Str耐药株MIC值降为16 μg/mL。逐步递增药物浓度可以诱导禽源Pm对氨基糖苷类药物的耐药性,其耐药机理为磷酸转移酶类对氨基糖苷类抗生素结构的修饰作用,核糖体靶位点突变和外排泵的过量表达。
关键词:禽源多杀性巴氏杆菌;体外诱导;链霉素;耐药基因;位点突变;耐药机制
中图分类号:S852.61+5 文献标识码:A 文章编号:0439-8114(2018)08-0096-04
DOI:10.14088/j.cnki.issn0439-8114.2018.08.024
Characterization of Sreptomycin-resistant Avian Pasteurella multocida in Vitro Induction and Preliminary Analysis of Resistance Mechanism
WANG Zui1,2,KONG Ling-yan2,SHAO Hua-bin2,LU Qin2,LUO Qing-ping2,YANG Yu-ying1
(1.College of Animal Sciences,Yangtze University,Jingzhou 434025,Hubei,China;2.Institute of Animal Husbandry and Veterinary,Hubei Academy of Agricultural Sciences/Key Laboratory of Prevention and Control Agents for Animal Bacteriosis(Ministry of Agriculture),
Wuhan 430064,China)
Abstract: In order to study the drug susceptibility to sreptomycin(Str) and its drug resisitance mechanism of avian Pasteurella multocida(Pm),a Str-resistant avian Pm was obtained via in vitro induction with gradually increasing drug concentrations to the standard strain named C48-1. The minimal inhibitory concentration(MIC),biochemical characteristics, growth curve,stability of drug resistance,drug resistance gene site mutation and drug resistance reversal of the Str-resistant strain was analyzed. The results showed that compared with the parent strain, the biochemical characteristics and growth curve had no significant difference,the MIC of the Str-resistant strain was increased from 8 μg/mL to 1 024 μg/mL. What more,the drug resistance gene StrA and StrB were found and the amino acid sequence encoded by the rpsL gene had an amino acid exchange of Lys43→Thr. In the drug resistance reversal test, carbonyl cyanide-m-chlorophenylhydrazone (CCCP) reduced the MIC of the Str-resistant strain to 16 μg/mL. In total,it shows that gradually increasing drug concentration can induce Pm resistance to aminoglycosides in vitro. Its mechanism is the modification of aminoglycoside antibiotics by phospho-transferase,the mutation of ribosomal protein and the over expression of efflux pumps.
Key words: avian Pasteurella multocida; in vitro induction; sreptomycin; drug resistance gene; site mutation; resistance mechanism
禽源多杀性巴氏杆菌(Pasteurella multocida,Pm)是引起禽霍乱的致病菌,该病属于急性、热性、高致病性传染病[1]。在中国引起禽霍乱的病原菌主要是荚膜血清A型Pm[2]。目前对于该病的控制措施,主要采用药物防治,尤其是抗生素如链霉素、磺胺嘧啶等效果较好,但耐药菌株的出现对该病的防控带来了严峻挑战[3]。
氨基糖苷类药物属于最早投入临床使用的抗菌药物之一,由于长期、频繁、大剂量使用,近年来临床分离出的Pm对氨基糖苷类药物出现普遍耐药现象,部分分离株对Str等氨基糖苷类药物已达到了高度耐药[4]。已有研究表明,细菌对氨基糖苷类药物耐药机制主要分为核糖体靶位修饰或点突变、氨基糖苷类抗生素修饰酶的修饰作用和外排泵的外排作用[5]。而目前公认的Pm耐氨基糖苷类药物的主要机制是其质粒或染色体上携带多种氨基糖苷类钝化酶基因[6],其他耐药机制的研究较少。
为研究多杀性巴氏杆菌对氨基糖苷类药物的耐药机制,本试验以禽源多杀性巴氏杆菌代表株C48-1为研究对象,应用体外诱导法诱导出Str耐药株,并对其耐药基因、核糖体靶位突变以及耐药逆转性进行了分析,旨在为后续耐药机制的研究提供参考。
1 材料与方法
1.1 菌株
大肠杆菌ATCC25922,购自广州环凯微生物有限公司;禽巴氏杆菌C48-1株,购自中国兽药监察所。
1.2 主要试剂
链霉素、CCCP、利血平、奥美拉唑、维拉帕米,购自索莱宝公司;麦氏比浊管、生化试剂管,购自广州环凯微生物有限公司;Taq酶等PCR试剂,购自诺唯赞公司;MH、TSA、TSB培养基,购自美国BD公司。
1.3 方法
1.3.1 MIC值的测定 参照美国临床检验标准委员会(CLSI)[7]推荐的微量稀释法检测链霉素对亲本株C48-1的MIC值,以大肠杆菌ATCC25922作为质控菌。培养物置于37 ℃恒温箱中培养18 h后观察结果。
1.3.2 巴氏杆菌耐药株的体外诱导 采用体外诱导法增加药物浓度诱导标准菌株C48-1对链霉素产生耐药性。将菌株在含有1/2 MIC抗生素的TSA培养基中传代培养,每3 d转接1次,每周检测1次MIC值,同步设质控菌ATCC25922作为平行对照,以保证试验的可靠性。以CLSI的临界浓度(Break point)作为耐药判断标准,链霉素耐药为不低于64 μg/mL。为保证菌株没有污染,每代都利用PCR技术检测诱导菌株是否为巴氏杆菌。
1.3.3 巴氏杆菌耐药株的稳定性检测
1)诱导株的MIC值稳定性检测。将诱导获得的链霉素耐药株转接于无抗性的TSA培养基中培养,每天转接1次,连续传代20代后检测MIC值,以判断StrR耐药性的稳定性。
2)生理生化特性检测。对培养的链霉素耐药株和亲本株单个菌落进行葡萄糖、蔗糖、甘露醇、半乳糖、麦芽糖、乳糖、鼠李糖、木糖、甲基红、阿拉伯糖、山梨醇、卫矛醇、明胶酶、氧化酶、硝酸盐还原、尿素、V-P、吲哚等生化试验,观察其生理生化特性。
3)诱导株及其亲本株生长曲线测定。分别接种链霉素耐药株和亲本株的单个菌落于TSB液体培养基中,37 ℃恒温振荡培养至对数生长期(约3×108 CFU/mL),调节菌液的起始OD600 nm值一致,吸取100 μL菌液转接于100 mL TSB培养中,37 ℃、180 r/min振荡培养。每隔1 h取样100 μL,在分光光度计上测定OD600 nm值,记录结果。以时间为横坐标,OD600 nm值为纵坐标,绘制各菌株的生长曲线。
1.3.4 耐药株耐药相关基因检测 根据GenBank现有文献检索Pm相应的氨基糖苷类药物耐药相关基因,对耐药菌株的耐药相关基因进行PCR扩增,并送至生工生物工程(上海)股份有限公司进行测序,检测耐药相关基因序列是否正确以及是否发生靶位突变。氨基糖苷类药物相关耐药基因及引物序列见表1。
1.3.5 逆转性耐药试验 利用琼脂二倍稀释法测定CCCP、利血平、奥美拉唑、维拉帕米对链霉素耐药株的最小抑菌浓度,然后以1/4 MIC的CCCP、利血平、奥美拉唑、维拉帕米溶液加入含有各浓度梯度的链霉素平皿内(不含链霉素的平皿为对照)。检测CCCP、利血平、奥美拉唑、维拉帕米对受試菌链霉素MIC值影响。
2 结果与分析
2.1 巴氏杆菌耐药株的体外诱导
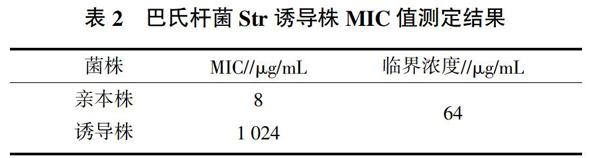
采用体外逐步诱导法构建出Str的诱导耐药菌株,标记为StrR,依据CLSI标准对亲本株C48-1和诱导株StrR的MIC值进行测定,结果见表2。C48-1的MIC值为8 μg/mL;StrR的MIC值为1 024 μg/mL,是亲本株的128倍,为高度耐药。利用Pm的特异性引物对StrR菌株进行PCR检测,得到明亮的目的条带,表明获得了高度耐药的Pm链霉素耐药菌株。
2.2 巴氏杆菌耐药株的稳定性检测
将诱导获得的耐药株连续传20代后检测MIC值,其MIC值保持为1 024 μg/mL,表明成功获得了稳定的Pm链霉素耐药菌株。对诱导株和亲本株分别进行生化特性检测,结果见表3,诱导株和亲本株在生理生化特性上无差异,诱导株和亲本株生长曲线见图1,总体上诱导株与亲本株无较大差异,诱导株达到对数生长期的时间稍微延迟,这可能是诱导株在链霉素诱导过程中为了更好地适应药物环境,从而放缓了生长速率。
2.3 耐药株耐药相关基因检测
对耐药株StrR耐药相关基因进行PCR检测见图2,成功扩增出了磷酸转移酶类的StrA、StrB基因,核糖体30 s亚基上的rpsE、rpsL和rrs基因,而腺嘌呤转移酶类AadB、AadA25、AadA14、AadA1基因和乙酰转移酶类AacA4基因均未扩增出条带。将扩增的StrA、StrB、rpsE、rpsL和rrs基因全长测序后与亲本株比对发现,StrA、StrB、rpsE和rrs基因均未发生突变,只有rpsL基因在第128个碱基发生了突变由(A→C),从而使相应的第43位氨基酸也发生了突变(Lys43→Thr),由于在所有的不同程度耐药的诱导菌株中该位点都发生了突变(图3),可以确定该位点突变不是导致高度耐药的主要因素。
2.4 逆转性耐药试验结果
通过琼脂二倍稀释法测得CCCP、利血平、奥美拉唑、维拉帕米对链霉素耐药株的MIC值分别为20、40、60、60 μg/mL。1/4MIC CCCP溶液导致耐药株的MIC值显著下降,链霉素MIC值从初始的1 024 μg/mL降低为16 μg/mL(临界值为64 μg/mL),而利血平、奥美拉唑、维拉帕米对耐药株MIC值并无明显影响(表4),说明受试菌在外排泵抑制剂CCCP的作用下发生了链霉素耐药性的逆转。
3 小结与讨论
氨基糖苷类抗生素因其对禽巴氏杆菌有良好灭杀作用而被广泛应用,但耐药性问题也日趋严重。对于Pm氨基糖苷类抗生素耐药机制,国内外主要集中于检测分离株是否在质粒或基因组上携带StrA、StrB等耐药基因,而对核糖体靶位突变和外排泵的过量表达等耐药机制研究较少。
为了研究Pm氨基糖苷类抗生素耐药机制,本试验采用体外逐步诱导法成功诱导出Pm的Str高度耐药菌株,MIC值达到1 024 μg/mL,其生物学特性与亲本株表现一致,耐药性也稳定存在。磷酸转移酶、腺苷酰转移酶和乙酰基转移酶类属于氨基糖苷类抗生素修饰酶,是介导氨基糖苷类耐药最为广泛的途径[8]。本试验对Str耐药株所携带耐药基因进行PCR检测,只发现了磷酸转移酶类的StrA、StrB基因,该类基因可以对氨基糖苷类抗生素上的磷酸盐基团进行催化转移[9],使其无法作用于细菌产生耐药性。金天明等[10]发现临床分离的禽源Pm链霉素耐药株均在StrA基因编码的第204位氨基酸处存在突变,这可能是介导链霉素耐药的主要因素,而本研究并未发现StrA、StrB有突变发生。有研究表明,rpsL基因编码的核糖体蛋白S12和rrs基因编码的16S rRNA构成了核糖体的蛋白质合成中心,也是链霉素主要的作用靶点[11],rpsE基因编码的核糖体蛋白S5突变能够介导细菌对氨基糖苷类抗生素耐药[12],所以rpsL、rrs和rpsE基因突变会导致链霉素耐药。通过对诱导株rpsL、rrs、rpsE基因全长测序,发现rrs和rpsE基因没有发生突变,所以诱导株链霉素耐药与rpsE和rrs基因突变无关。而rpsL基因发生了Lys43→Thr突变,该位点是结核分枝杆菌链霉素耐药株中最常见的突变位点,在结核分枝杆菌链霉素耐药中起主要作用[13]。由于在不同敏感程度诱导株中均发生了Lys43→Thr突变,说明该位点突变确实与Pm链霉素耐药相关,但并不是Pm链霉素高度耐药的原因。逆转性耐药试验中,外排泵抑制剂CCCP对诱导株链霉素耐药产生了显著逆转效果,诱导株MIC值由1 024 μg/mL降为16 μg/mL。作为实验室最常用的外排泵抑制药物,CCCP通过损耗细胞膜的质子动力来阻断外排泵能量来源,从而影响药物的外排[14],但CCCP是非特异性外排泵抑制剂,能抑制主动外排作用却不能确定外排泵的种类[15],具体是对哪种或哪几种外排泵起作用,还有待进一步研究。通过CCCP耐药逆转效果,可以看出外排泵过量表达是诱导株链霉素高度耐药的原因。所以,诱导株耐药机理为磷酸转移酶类对氨基糖苷类抗生素结构的修饰作用,核糖体靶位点突变以及外排泵的过量表达。
本研究初步分析了耐药株中可能存的耐药机制,后续将利用RNA-Seq技术对诱导耐药株进行转录组分析,以期发现其他耐药机制,为防止耐药性的产生和研制新药提供理论依据。
参考文献:
[1] 罗青平,王红琳,张蓉蓉,等.限铁培养禽巴氏杆菌制备灭活疫苗及其免疫效果分析[J].中国家禽,2016(21):51-53.
[2] 林志敏,林彬彬,程龙飞.禽源多杀性巴氏杆菌耐药性及其质粒多样性的研究[J].福建农业学报,2015,30(7):648-651.
[3] SAN M A,ESCUDERO J A,GUTIERREZ B,et al.Multiresistance in pasteurella multocida is mediated by coexistence of small plasmids[J].Antimicrob Agents Chemother,2009,53:3399-3404.
[4] 孔令聪,战 利,赵 晴,等.动物源多杀性巴氏杆菌耐药性及耐药机制研究进展[J].中国兽药杂志,2012,46(3):52-55.
[5] 王 梓,孔令聪,贾博岩,等.氨基糖苷类抗生素耐药机制研究进展[J].中国兽药杂志,2015(3):65-69.
[6] 王 梓.牛荚膜血清A型巴氏杆菌氨基糖苷类抗生素耐药性研究[D].长春:吉林农业大学,2016.
[7] CLINICAL AND LABORATORY STANDARDS INSTITUTE. Performance Standards for Antimicrobial Diskand Dilution Susceptibility Tests for Bacteria Isolated from Animals; Approved Standard[M].3rded. Wayne,USA:CLSI,2008.
[8] 顧觉奋,杨晓兵.细菌对氨基糖苷类抗生素耐药机制研究进展[J].药物生物技术,2001(3):174-177.
[9] MARIA S,MARCELO E,TOLMASKY T. Aminoglycoside modifying enzymes[J].Drug Resistance Updates,2010,13:151-171.
[10] 金天明,高 丰,佟庆彬,等.巴氏杆菌对链霉素和磺胺耐药机制的研究[J].畜牧与兽医,2007(2):5-7.
[11] BAUSKENIEKS M,POLE I,SKENDERS G,et al. Genotypic and phenotypic characteristics of aminoglycoside resistant Mycobacterium tuberculosis isolates in Latvia[J].Diagnostic Microbiology & Infectious Disease,2015,81(3):177-182.
[12] GALIMAND M,GERBAUD G,COURVALIN P. Spectinomycin resistance in Neisseria spp. due to mutations in 16S rRNA[J].Antimicrobial Agents & Chemotherapy,2000,44(5):1365-1366.
[13] 杨彩虹,曹旭东,史静雪,等.结核分枝杆菌临床分离株链霉素耐药性的检测及耐药基因突变位点分析[J].石河子大学学报,2017,35(2):169-175.
[14] 王二兵,马淑涛.药物耐药性外排泵抑制剂的研究进展[J].中国药物化学杂志,2005,15(3):188-192.
[15] 王 悦,宋诗铎,王玉宝.22株多重耐药鲍曼不动杆菌临床株的外排泵AdeABC和AdeIJK的表达研究[J].中国抗生素杂志,2009,34(5):304-308.

