深海古菌Thermococcus siculi HJ21高温普鲁兰酶基因的克隆及表达
王淑军,吕明生,李华钟,徐金利,,焦豫良,房耀维,刘 姝
深海古菌Thermococcus siculi HJ21高温普鲁兰酶基因的克隆及表达
王淑军1,吕明生1,李华钟2,徐金利1,2,焦豫良1,房耀维1,刘 姝1
(1.淮海工学院食品工程学院,江苏 连云港 222005;2.江南大学 教育部工业生物技术重点实验室,江苏 无锡 214122)
根据NCBI上公布的普鲁兰酶基因的保守序列设计简并引物,以Thermococcus siculi HJ21基因组DNA为模板进行PCR,得到T. siculi HJ21普鲁兰酶的基因,测序后通过Blast(NCBI)数据库比对和分析表明扩增基因有一个4056bp、编码1351个氨基酸的开放阅读框,为一新的普鲁兰酶基因。将该基因插入表达载体pET28a,并转化Escherichia coli BL21(DE3),经IPTG诱导,测定普鲁兰酶比活力。重组转化子的细胞破碎液有高温普鲁兰酶活性,SDS-PAGE电泳结果显示出分子质量约为150kD的特异性条带。
Thermococcus siculi HJ21;普鲁兰酶;基因;PCR
普鲁兰酶(pullulanase,EC 3.2.1.41) 是一种能够专一性水解普鲁兰多糖和其他多糖如淀粉、糖原和极限糊精中的α-1,6糖苷键,从而剪下整个侧枝,形成直链淀粉的脱支酶[1-2]。它在淀粉加工工业中有着非常重要的用途,可大规模地提高淀粉的利用率和生产效率[3-4]。普鲁兰酶可以单独使用,亦可与其他酶配合使用,相辅相成收到良好的效果[5-7]。该酶已被较成熟地应用于高葡萄糖浆、高麦芽糖浆和干啤酒生产中[8-9]。目前我国对于该酶的研究还处于实验室研究阶段,因此无此酶的生产技术,普鲁兰酶制品主要依赖进口[10]。
来自嗜热菌Thermococcus siculi HJ21的耐高温普鲁兰酶的最适反应温度为95℃,且温度的稳定性较好,因而具有较高的工业应用价值。本实验利用分子生物学技术,克隆T. siculi HJ21的普鲁兰酶基因,并在大肠杆菌中进行表达,以为该酶的工业应用提供参考。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
Thermococcus siculi HJ21、Escherichia coli DH5α、E. coli BL21(DE3)为淮海工学院江苏省海洋生物技术重点建设实验室保藏。T-A克隆载体pMD18-T TaKaRa(大连)公司;pET28a表达载体由中国科学院海洋研究所秦松研究员馈赠。
1.1.2 酶与试剂
DNA聚合酶、氨苄青霉素、胶回收试剂盒 上海生工生物工程技术服务有限公司;DNA限制性内切酶、T4 DNA连接酶、 Universal Genomic DNA Extraction Kit Ver.3.0 宝生物工程(大连)有限公司;其他化学试剂均为国产分析纯。
1.1.3 培养基及培养条件
大肠杆菌的培养使用LB培养基(液体LB培养基:每升含10g胰蛋白胨、5g酵母粉、10g NaCl;固态LB培养基:在液体培养基的基础上添加0.02g/mL琼脂粉),37℃培养。T. siculi HJ21的培养用自行设计的厌氧培养装置,培养基为改良的YPS培养基按参考文献[11]进行配制。
1.1.4 引物合成和测序
引物合成和测序均由上海生工生物工程服务有限公司完成。引物序列及用途见表1。

表1 克隆T. siculi HJ21高温普鲁兰酶全长DNA所用引物Table 1 Primers used for the cloning of full-length DNA of T. siculi HJ21 pullulanase gene
1.2 方法
1.2.1 T. siculi HJ21 高温普鲁兰酶基因的克隆
1.2.1.1 T. siculi HJ21基因组总DNA的制备
基因组总DNA的提取采用TaKaRa公司的试剂盒Universal Genomic DNA Extraction Kit Ver.3.0进行提取。
1.2.1.2 部分DNA序列的PCR
根据已报道的普鲁兰酶基因保守区设计简并引物(F1、R1、F2、R2、F3、R3、F4、R4)。PCR反应体系(25μL)的组成为:10×buffer 2.5μL、Mg2+(25mmol/L) 2.5μL、引物1(P1),100μmol/L) 0.5μL、引物2(P2),100μmol/L) 0.5μL、dNTP(10mmol/L) 0.5μL、Taq酶 (5U/μL) 0.2μL、模板1μL、ddH2O定容至25 μL。PCR按照如下程序进行扩增:94℃预变性4min,然后进入以下循环:94℃变性1min;54℃退火40s;72℃延伸,共进行35个循环。循环结束后,72℃延伸10min,4℃保存。取PCR反应产物以0.01g/mL 琼脂糖凝胶电泳进行分析、胶回收(胶回收参阅上海生工生物工程技术服务有限公司上海生工公司的小量胶回收试剂盒说明书,凝胶的制备和操作参照文献[12],并克隆到pMD18-T载体上,转化E.coli DH5α,蓝白斑筛选和酶切鉴定阳性克隆,挑选正确的阳性克隆测序。
1.2.1.3 序列拼接
将简并引物所获得的部分DNA序列用DNAMAN Version6.0进行序列拼接,结合测序峰图进行序列校正,最后获得拼接好的序列,见图1。
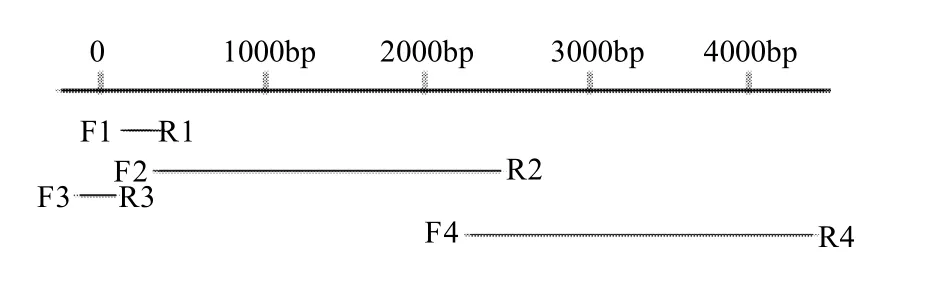
图1 DNA序列拼接Fig.1 DNA fragment assembly
1.2.1.4 全长DNA的扩增
根据序列拼接结果设计两端引物F5和R5,按94℃预变性4min;然后94℃ 40s,56℃ 40s,72℃ 4min,35个循环;72℃延伸10min,4℃保存。将PCR反应产物以0.007g/mL脂糖凝胶电泳进行分析和胶回收,并克隆到pMD18-T载体上构建得到新质粒pMD18-T-pull,并转化E. coli DH5α,蓝白斑筛选和酶切鉴定阳性克隆,提取的质粒pMD18-T-pull冻存,20℃备用。
1.2.2 目的基因的表达及活性鉴定
1.2.2.1 大肠杆菌表达质粒的构建及转化
提取含有T. siculi HJ21普鲁兰酶基因的质粒pMD18-T-pull,用BamHⅠ和SalⅠ双酶切,回收并与以同样双酶切的pET28a质粒以3:1的物质的量比进行混合连接,构建得到新质粒pET28a-pull,并转化到大肠杆菌DH5α,以Amp+筛选阳性转化子,提取质粒pET28a-pull冻存-20℃备用。大肠杆菌感受态细胞的制备与转化按文献[13]方法进行操作。大肠杆菌工程菌的诱导按文献[14]方法进行操作。
1.2.2.2 普鲁兰酶比活力测定
粗酶液制备:将发酵液用三层滤纸抽滤除去残余硫颗粒及杂质后,以10000r/min离心15min,除去菌体,取上清液盐析过夜,每100mL上清液加39.6g硫酸胺,然后再以11000r/min离心30min,取沉淀透析,透析结束后以12000r/min离心10min,除去杂质,所得上清液即为粗酶液,置于-40℃冰箱保存。
将50μL粗酶液加入到150μL普鲁兰乙酸钠缓冲液(200mmol/L,pH6.0)中,在95℃水浴中反应15min,用DNS测定还原糖量[15]。在上述条件下,每分钟催化底物产1μmol麦芽糖的酶量作为一个酶活力单位。
2 结果与分析
2.1 T. siculi HJ21普鲁兰酶基因的扩增及序列分析
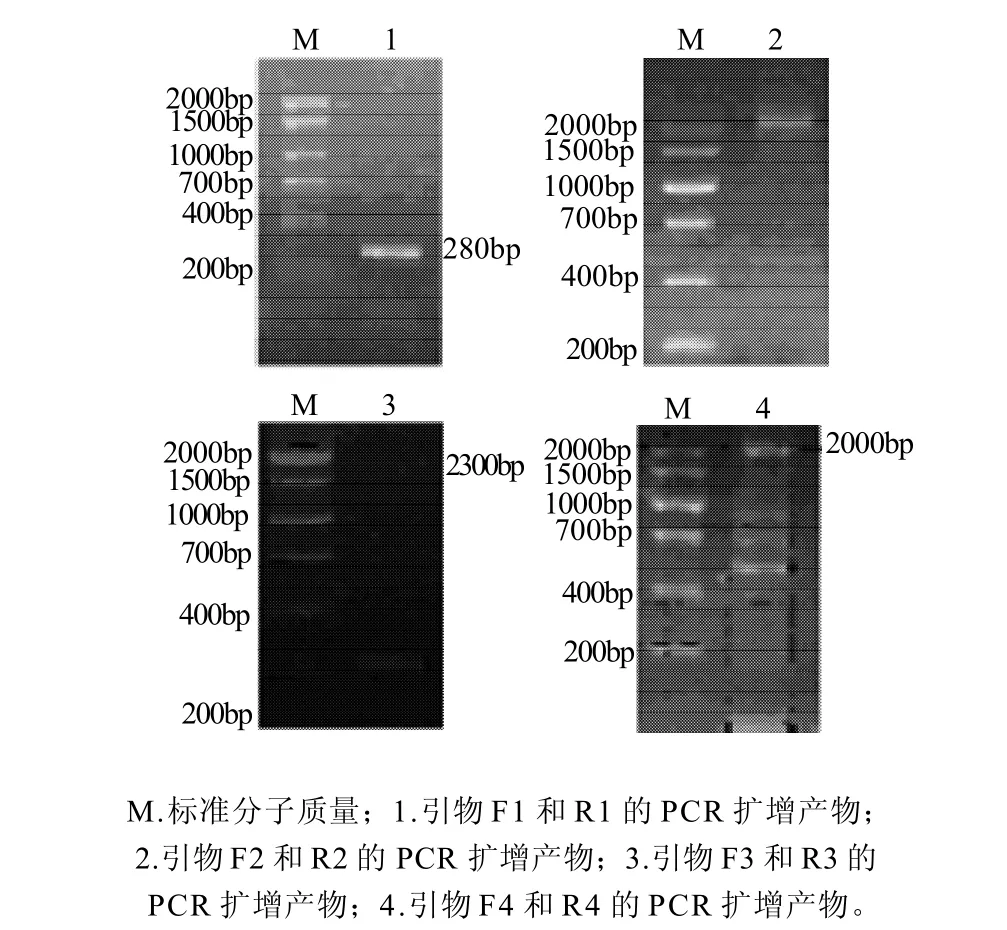
图2 简并引物扩增产物Fig.2 Electrophoresis of the PCR products of pulluanase gene with four pairs of degenerate primers
根据NCBI中公布的耐高温普鲁兰酶序列,利用ClustalX软件对序列进行对比,找到保守氨基酸序列,设计简并引物进行PCR,获得长度约为280、2300、200bp及2000bp的片段,结果见图2。将片段回收后,测序结果显示所扩增得到的片段经拼接后全长为4056bp,编码1351个氨基酸。然后根据拼接后的序列设计引物扩增普鲁兰酶基因,并与pMD18-T相连,获得pMD18-T-pull质粒,结果见图3。通过其编码的氨基酸序列在GenBank数据库中用Blast(Basic Local Alignnlentsemh Tool)进行相似性搜索比对可以看出,T. siculi HJ21与T. hydrothermalis AL662 (AF068255)的亲缘关系最近,碱基序列的相似性达到82%,氨基酸序列的相似性达到87%。
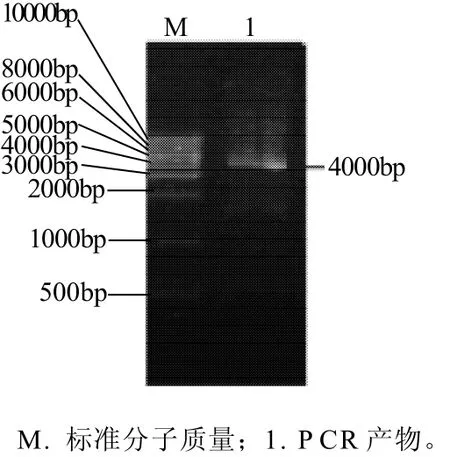
图3 普鲁兰酶编码基因Fig.3 Electrophoresis of the full-length PCR products of pulluanase gene
2.2 重组质粒的构建和酶切验证
将pMD18-T-pull进行BamHⅠ和SalⅠ双酶切,电泳胶回收4.0kb左右的条带,对pET28a质粒进行BamHⅠ和SalⅠ双酶切,电泳胶回收5.3kb的条带;将上述胶回收产物以3:1的物质的量比进行混合,构建过程见图4。
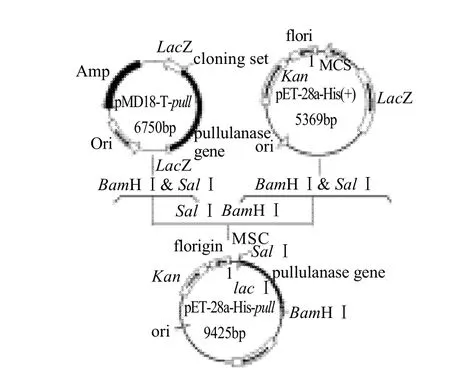
图4 pET-28a-pull的构建Fig.4 Construction map of recombinant expressing vector pET-28apull
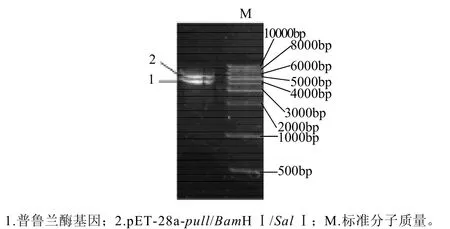
图5 pET-28a-pull经BamHⅠ和SalⅠ双酶切Fig.5 Double enzymatic digestion identification of pET-28a-pull with BamHⅠ and SalⅠ
将重组质粒 pET28a-pull用BamHⅠ和SalⅠ双酶切,酶切后于0.007g/mL的琼脂糖凝胶中电泳验证,电泳结果显示产生4.0kb和5.3kb两条带,证明重组表达质粒构建正确,结果见图5。
2.3 普鲁兰酶基因在大肠杆菌中的表达
将pET28a、pET28a-pull分别转化E. coli BL21 (DE3),转化子接种于含有50μg/mL卡那霉素的液体LB培养基中,37℃振荡培养至对数期后期,加入IPTG,使其终浓度为1mmol/L,于37℃条件下诱导4h后离心收集菌体用缓冲液洗涤悬浮,于冰水中超声破碎细胞,测定酶比活力。结果表明,普鲁兰酶基因在大肠杆菌中成功表达。SDS-PAGE结果表明,经IPTG诱导后普鲁兰酶基因在大肠杆菌中得到了较好的表达,150kD附近出现了明显的蛋白条带,表达蛋白占细胞总蛋白的8%,结果见图6。
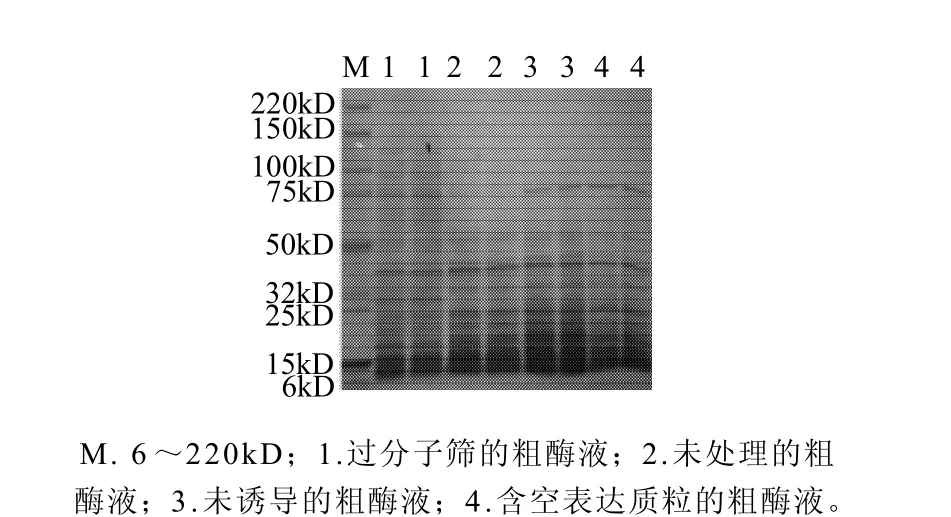
图6 重组酶液SDS-PAGEFig.6 SDS-PAGE of recombinant pullulanase
3 讨 论
该研究实现了普鲁兰酶基因在大肠杆菌中的表达,表达采用了T7强启动子,但酶的表达水平不高,全细胞蛋白SDS-PAGE电泳结果表明,含重组质粒的细胞和含pET28a空载体的细胞用IPTG诱导后所获电泳图谱并没有明显差别,这说明重组蛋白的表达量不高。利用一个在线分析大肠杆菌稀有密码子的网站http://nihserver. mbi.ucla.edu/RACC/分析T. siculi HJ21普鲁兰酶基因中的稀有密码子,共有稀有密码子99个,其中稀有精氨酸密码子有28个,稀有亮氨酸密码子有4个,稀有异亮氨酸密码子有41个,稀有脯氨酸密码子有26个,而在大肠杆菌稀有密码子的tRNA中,以tRNAArg (AGG/ AGA)含量最低,对表达的影响也最大,因而显著影响表达水平。
来源于T. siculi HJ21的普鲁兰酶由于其反应温度高、对Ca2+依赖性小、酶的稳定性高等特点,因而受到越来越多的关注。但由于超嗜热微生物生长环境的特殊性(高压、厌氧以及低营养),利用传统的生物发酵技术难以实现超嗜热微生物的工业生产。因此,目前主要通过基因工程的手段把优良的酶基因在适宜的宿主系统中进行高效表达,从而实现嗜热酶的工业应用。本实验利用分子生物学手段,展现了来源于T. siculi HJ21的普鲁兰酶基因的表达,为该酶的进一步研究和应用奠定了基础。近年来虽然已经将嗜热普鲁兰酶在不同的宿主中表达成功,但是表达量比较低,因此,可以通过分子定向进化技术提高其表达量,以满足工业应用的要求。
[1]ADINARAYANA K, SUREN S. Improved high thermal stability of pullulanase from a newly isolated thermophilic Bacillus sp. AN-7[J]. Enzyme and Microbial Technology, 2006, 39(7): 399-1404.
[2]SUBHASH U, SINGHAL R, KAMAT M, et al. Induction of pullulanase production in Bacillus cereus FDTA-13[J]. Bioresource Technology, 2007, 98(4): 856-859.
[3]DOMAN-PYTKA M, BARDOWSKI J. Pullulan degrading enzymes of bacterial origin[J]. Microbiology, 2004, 30: 107-121.
[4]GOMES I, GOMES J, STENIER W. Highly thermostable amylase and pullulanase of the extreme thermophilic eubacterium Rhodothermus marinus: production and partial characterization[J]. Bioresource Technology, 2003, 90: 207-214.
[5]徐金利, 吕明生,王淑军,等. 嗜热古菌Thermococcus sp.HJ21产高温普鲁兰酶条件和酶学性质[J]. 食品与生物技术学报, 2009, 28 (2): 243-249.
[6]HORVTHOV V, GODNY A, TURDK E, et al. α-Amylase from Thermococcus hydrothermalis: recloning aimed at the improved expression and hydrolysis of corn starch[J]. Enzyme and Microbial Technology, 2006, 39(6): 1300-1305.
[7]WANG Shujun, LU Zhaoxin, LU Mingsheng, et al. Identification of archaeon-producing hyperthermophilic alpha-amylase and characterization of the alpha-amylase[J]. Microbiololy and Biotechnology, 2008, 80 (4): 605-614.
[8]张晓宇, 艾志录,李梦琴, 等. 极限糊精酶的研究进展及展望[J]. 中国食品添加剂, 2004(3): 32-35.
[9]BERTOLDO C, ANTRANIKIAN G. Starch-hydrolyzing enzymes from thermophilic archaea and bacteria[J]. Current Opinion in Chemical Biology, 2002, 6(2): 151-160.
[10]唐宝英, 朱晓慧, 刘佳. 耐酸耐热普鲁兰酶菌株的筛选及发酵条件的研究[J]. 微生物学通报, 2001, 28(1): 39-43.
[11]JOLIVET E, CORRE E, L HARIDON S, et al. Thermococcus marinus sp. nov., and Thermococcus radiotolerans sp. nov., two hyperthermophilic archaea from deep-sea hydrothermal vents that resist ionizing radiation[J]. Extremophiles, 2004, 8(3): 219-227.
[12]萨姆布鲁克J, 拉塞尔 D W. 分子克隆实验指南[M]. 3版, 黄培堂,译. 北京: 科学出版社, 2002.
[13]杨云娟. 普鲁兰酶基因的克隆及其在毕赤酵母中的高效表达[D]. 云南: 云南师范大学, 2005.
[14]夏子芳, 王正祥. Thermotoga maritima普鲁兰酶的基因克隆与酶学性质研究[J]. 食品与发酵工业, 2007, 33(4): 19-22.
[15]KIM J, KIM Y, LEE H, et al. Molecular cloning and biochemical characterization of the first archaeal maltogenic amylase from the hyperthermophilic archaeon Thermoplasma volcanium GSS1[J]. Biochim Biophys Acta, 2007, 24: 661-669.
Cloning and Expression of a New Thermostable Pullulanase Gene from a Deep-sea Archaeaon Strain Thermococcus siculi HJ21
WANG Shu-jun1,LU Ming-sheng1,LI Hua-zhong2,XU Jin-li1,2,JIAO Yu-liang1,FANG Yao-wei1,LIU Shu1
(1. College of Food Science and Technology, Huaihai Institute of Technology, Lianyungang 222005, China;2. Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, China)
The gene of pullulanase was amplified from Thermococcus siculi HJ21 with degenerate primes designed based on the NCBI published conserved sequence information. The DNA sequencing and BLAST (NCBI) analysis showed that this DNA sequence was a new pullulanase gene with an open reading frame (ORF) of 4056 bp in length encoding 1351 amino acids.The gene was cloned into the expression vector, pET28a, producing a hybrid plasmid pET28a-pull. Subsequently, pET28a-pull was introduced into Escherichia coli BL21(DE3). The lysate of the transformant cells showed thermostable pullulanase activity. The SDS-PAGE analysis showed a band with apparent molecular weight of 150 kD.
Thermococcus siculi HJ21;pullulanase;gene;PCR
Q936;Q814
A
1002-6630(2010)19-0309-04
2010-06-08
国家自然科学基金项目(40746030);江苏省高校自然科学研究重大项目(09KJA170001)
王淑军(1965—),女,教授,博士,研究方向为食品科学。E-mail:shujunwang86@hotmail.com

