重组牛乳铁素融合蛋白的原核表达及其抑菌活性分析
魏新元,闻盼盼,丑敏霞,樊明涛
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学生命科学学院,陕西 杨凌 712100)
重组牛乳铁素融合蛋白的原核表达及其抑菌活性分析
魏新元1,闻盼盼1,丑敏霞2,樊明涛1
(1.西北农林科技大学食品科学与工程学院,陕西 杨凌 712100;2.西北农林科技大学生命科学学院,陕西 杨凌 712100)
为建立生物合成牛乳铁素的方法,根据牛乳铁素氨基酸序列确定其编码序列,利用PCR技术获得基因扩增产物,接着将该产物与编码鱼腥蓝细菌Anabaena sp. PCC 7120的DNA聚合酶基因dnaENI中断裂的内含肽基因Asp dnaEIn的PCR产物进行重组PCR,将获得的重组融合基因再克隆到表达载体pET-28a构建重组融合表达质粒。结果显示,融合表达质粒转化大肠杆菌后经诱导能在大肠杆菌表达宿主Escherichia.coli BL21(DE3) 中大量表达,且细胞裂解液与纯化的Anabaena sp. PCC 7120中含断裂内含肽Asp DnaEIc的DNA聚合酶蛋白DnaECI混合反应后对金黄色葡萄球菌具有抑制作用。
牛乳铁素;重组P C R;融合基因;融合蛋白
牛乳铁素是牛乳铁蛋白的降解产物[1-2],它由靠近牛乳铁蛋白氨基端的2 5个氨基酸组成,序列为FKCRRWQWRMKKLGAPSITCVRRAF[3]。牛乳铁素为一种新型抗微生物多肽,它能抑制多种细菌、病毒甚至寄生虫等生长[4-7]。
目前,商用牛乳铁素主要通过胃蛋白酶水解牛乳铁蛋白获得[8],此法为当前药用牛乳铁素生产的最佳方法。但此法工艺复杂、成本高、回收率低。牛乳铁素也可通过多肽合成仪进行合成,但此法价格昂贵,也不适于大量生产,仅限于研究用的小量制备。
采用基因工程体外合成牛乳铁素具有广阔的前景。传统蛋白质生物合成是将目的蛋白与特定标签进行融合构建,借助标签对目的蛋白进行亲和吸附纯化[9],该法成本低廉、工艺简单、回收率高,是当前生物合成蛋白的常用方法。但该法需要进行酶解和再次分离,因此易导致目的蛋白产量、稳定性和纯度的降低[9]。
内含肽的发现和应用使蛋白质的生物合成与纯化得到了大大改进。该方法首先将目的蛋白与内含肽及某一标签进行融合构建,利用标签对融合蛋白进行分离纯化后,再在内含肽的自我剪接作用下,仅将目的蛋白剪切下来,从而使目的蛋白只需一步就能完成分离和纯化[10]。鉴于此,本研究将牛乳铁素编码序列与鱼腥蓝细菌Anabaena sp. PCC 7120的DNA聚合酶DnaE中断裂的内含肽Asp dnaEIn在体外进行重组后,克隆到表达载体pET28a的His标签前,构建成三联融合表达质粒,然后利用大肠杆菌表达系统对牛乳铁素融合蛋白进行超量表达并进行抑菌实验,旨在为牛乳铁素一步纯化提供参考。
1 材料与方法
1.1 材料
1.1.1 菌株
鱼腥蓝细菌Anabaena sp. PCC 7120(在28~30℃,120r/min,40μE/m2s连续光照下培养,其DNA聚合酶DnaE由分离的两个基因dnaENI和dnaECI编码,并分别含断裂的内含肽Asp DnaEIn和Asp DnaEIc)、 Escherichia coli TG1大肠杆菌常规克隆宿主、E. coli BL21(DE3)大肠杆菌表达宿主,3种菌株均由华中农业大学农业微生物学国家重点实验室惠赠;金黄色葡萄球菌、志贺氏菌由本实验室保存。
1.1.2 质粒
pBluescript SK(-)常规克隆载体(含α-互补和氨苄青霉素抗性(Ampr)双重筛选标记)、pET28a表达载体(含卡那霉素抗性(kanamycin,Kmr)筛选标记),两种质粒均由华中农业大学农业微生物学国家重点实验室惠赠。
1.1.3 试剂
DnaECI蛋白(含内含肽Asp DnaEIc的Anabaena sp.PCC 7120的dnaECI基因在E. coli BL21(DE3)中表达后被纯化的蛋白[11]);PCR引物由西安沃尔森生物技术有限公司合成;限制性核酸内切酶、高保真的DNA聚合酶Probest、T4DNA连接酶 大连TaKaRa公司;DNA回收试剂盒 北京百泰克生物技术有限公司;氯化钙、丙烯酰胺、甲叉双丙烯酰胺、甘氨酸等为进口或国产分析纯或电泳纯试剂。
1.2 方法
1.2.1 牛乳铁素基因确定
根据已知的牛乳铁素(LfcB)的氨基酸序列,然后依照中心法则,并结合各氨基酸密码子在大肠杆菌中的使用效率确定牛乳铁素的基因序列。
1.2.2 牛乳铁素重组融合基因的构建
分别通过PCR获得牛乳铁素和Anabaena sp. PCC 7120内含肽基因dnaEIn的扩增产物,并使牛乳铁素基因下游序列与dnaEIn上游序列的部分序列能互补配对。然后采用重组PCR,将两个基因PCR产物进行重叠、延伸,从而获得重组融合基因[12]。为了保证牛乳铁素的翻译起始,实验设计中在其编码序列上游加入翻译起始密码子;为了保证牛乳铁素与内含肽之间的分离,在其基因下游加入内含肽剪接区上游5个氨基酸的编码序列。
1.2.3 牛乳铁素融合表达质粒的构建与诱导表达
将获得的融合基因首先插入到常规克隆质粒pBluescript SK(-)中,再将阳性质粒中的外源基因克隆到表达载体pET28a的His-tag标签前,从而获得三联融合表达质粒。将融合表达质粒转化表达宿主E. coli BL21(DE3)[11,13]后,在37℃、180r/min条件下,以1mmol/L isopropyl β-D-thiogalactoside(IPTG)诱导牛乳铁素融合蛋白的超量表达[14]。具体操作参考文献[15]进行。
1.2.4 牛乳铁素融合蛋白裂解与抑菌活性鉴定
内含肽Asp DnaEIn和Asp DnaEIc分别为Anabaena sp. PCC 7120断裂的DNA聚合酶DnaE所含内含肽的氨基端和羧基端,断裂的内含肽只有在共同存在时才具有反式剪接或剪切作用[12]。牛乳铁素融合蛋白经诱导表达后,利用超声波破碎诱导表达后的细胞,离心取上清液,然后在上清液中加入纯化的DnaECI蛋白和终浓度为100mmol/L的dithiothreitol(DTT)[12],20℃条件下反应,然后取反应液检测其抑菌活性。
2 结果与分析
2.1 牛乳铁素基因序列的确定
已知牛乳铁素由25个氨基酸FKCRRWQWRMKK LGAPSITCVRRAF组成[3],由于本研究拟定在大肠杆菌中对其进行超量表达,因此需要依照中心法则,并考虑各氨基酸密码子使用效率来确定牛乳铁素的编码序列。已经证实Anabaena sp. PCC 7120的DNA聚合酶dnaE基因能在E. coli BL21(DE3)中高效表达[12],因此以该基因作为参考,利用Bioedit软件,分析在dnaE中存在的牛乳铁素各氨基酸密码子的出现频率(数据未提供),选取频率高者组成牛乳铁素的编码序列,序列为:5′-TTCAAGTGTC GCCGCTGGCA GTGGCGTATG AAAAAGCTGG GTGCCCCGTC CATCACGTGT GTGCGTCGTG CCTTC-3′。
2.2 重组融合基因的构建
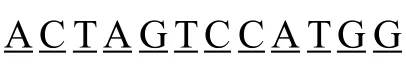

图1 PCR产物琼脂糖凝胶电泳Fig.1 Agarose gel electrophoresis of the PCR products separately containing LfcB, dnaEIn and LfcB-dnaEIn
2.3 融合基因表达质粒的构建
将获得的融合基因LfcB-dnaEIn以限制性内切酶Spe I和Xho I消化后纯化回收,接着与经过相同的内切酶消化的载体质粒pBluescript SK(-)使用T4DNA连接酶,在16℃条件下进行连接,然后将酶连产物转化大肠杆菌TG1,利用Amp抗性并结合蓝白斑筛选标记进行筛选,获得的阳性克隆进行SpeI和XhoI双酶切鉴定,结果如图2A所示。泳道3和4对应阳性重组质粒,其双酶切两条片段分别与PCR产物和pBluescript SK(-)空质粒的酶切片段大小一致。接着对泳道3的克隆子进行测序验证,结果显示,相对于设计序列,插入序列中有一个碱基发生了置换,但不改变氨基酸序列(数据未提供),因此证实为正确的重组质粒,命名为pSK-N。
接着将pSK-N利用内切酶Nco I和EcoR I进行消化,纯化回收的外源基因LfcB-dnaEIn连接到表达载体pET28a的Nco I和EcoR I位点之间,以卡那霉素作为抗性筛选标记,获得阳性克隆。对阳性克隆质粒进行NcoI和XhoI双酶切鉴定,结果如图2B所示。其双酶切两条片段分别与PCR产物和空载体pET28a的酶切片段大小一致,命名为pET28-N。

图2 重组质粒pSK-N和pET28-N限制性内切酶消化后电泳Fig.2 Agarose gel electrophoresis of recombinant plasmids pSK-N(panel A) and pET28-N (panel B) digested by the restriction endonucleases SpeI and XhoI
2.4 融合表达质粒的诱导表达
将融合表达质粒pET28-N转化表达宿主E. coli BL21(DE3)(该菌株中IPTG可以诱导T7RNA聚合酶的大量表达),然后挑取部分单菌落转接于液体LB培养基进行培养,并以终浓度为1mmol/L 的IPTG诱导培养3h[14],接着,细胞裂解物经过SDS-PAGE,检测牛乳铁素融合蛋白的表达情况,结果如图3所示。外源融合蛋白在E. coli BL21(DE3)中被诱导大量表达,其分子质量与理论值16.9ku相符。结果还说明,牛乳铁素融合蛋白对E. coli BL21(DE3)未造成明显毒害作用。

图3 大肠杆菌中表达的重组融合蛋白SDS-PAGEFig.3 SDS-PAGE analysis of the recombinant fusion protein expressed in E. coli BL21(DE3)
2.5 牛乳铁素融合蛋白抑菌活性分析
收集经过IPTG诱导牛乳铁素表达的E. coli细胞,用PBS缓冲液(含0.02mol/L Na2HPO4- NaH2PO4,0.5mol/L NaCl,pH7.6)洗涤细胞两次,再以PBS缓冲液进行重悬。然后利用超声波破碎仪裂解细胞,裂解液经12000r/min离心20min后取上清,等量分装成小份。接着,取3小份,向上清液中加入已经纯化的冻存的DnaECI蛋白溶液和终浓度为100mmol/L的DTT[12],20℃分别反应0.5、1、2h,然后取等体积反应物加入涂布金黄色葡萄球菌平板的LB培养基中的圆孔中,37℃条件下培养18h,检测各反应产物对金黄色葡萄球菌生长的抑制作用,结果如图4所示。孔3、4、5中反应产物对金黄色葡萄球菌具有明显的抑制作用。但是反应产物对志贺氏菌没有表现抑菌活性。

图4 牛乳铁素融合蛋白被诱导表达的细胞裂解液与DnaECI反应后对金黄色葡萄球菌的抑制效果Fig.4 Antibacterial effect of DnaECI-mediated reaction products containing bovine lactoferrici fusion protein on Staphylococcus aureus
3 讨 论
尽管牛乳铁素对多种细菌包括大肠杆菌都具有抑菌作用[4-5],但是牛乳铁素编码序列与内含肽基因进行基因融合后克隆到表达载体中获得的重组融合表达质粒,在IPTG的诱导下可以在大肠杆菌中成功表达,说明表达的融合蛋白消除或消弱了牛乳铁素对宿主细胞的明显伤害。而被诱导表达细胞的裂解液与DnaECI蛋白混合后表现出对金黄色葡萄球菌的抑制作用,说明断裂的两个内含肽Asp DnaEIn和Asp DnaEIc之间发生了剪接或剪切作用,导致了内含肽的解离,使牛乳铁素分离出来,从而表现出抑菌活性。
PCR技术能使目的基因得到大量扩增,而重组PCR技术则可以利用两个或多个分离的基因之间人为引入的互补配对序列将它们拼接起来,形成融合基因。本实验首先通过重组PCR获得了牛乳铁素基因的PCR产物,然后将其与加入一段牛乳铁素编码序列的Anabaena sp.PCC 7120的DnaE内含肽基因的PCR扩增产物进一步进行重组PCR,获得重组牛乳铁素融合基因。最终测序结果说明构建是成功的,这表明重组PCR技术对不同来源的两个基因进行融合构建是切实可行的。由于长片段基因的PCR扩增往往保真度不高,因此该技术为长基因的扩增提供了思路,可以通过将长基因进行分段扩增,最后利用重组PCR进行拼接获得完整基因。该技术也可用于多个基因的融合构建,这为构建多酶体系的发酵工程菌提供了一定的理论和技术基础。
由于在牛乳铁素氨基端含有甲硫氨酸,而在其羧基端带有内含肽Asp DnaEIn剪接区上游宿主蛋白中的5个固有氨基酸,是否表达牛乳铁素融合蛋白后的细胞裂解液与DnaECI的反应产物没有对志贺氏菌表现出抑菌活性与此相关,有待进一步研究。
[1] ABE H, SAITO H, MIYAKAWA H, et al. Heat stability of bovine lactoferrin at acidic pH[J]. J Dairy Sci, 1991, 74(1): 65-71.
[2] TOMITA M, BELLAMY W, TAKASE M, et al. Potent antibacterial peptides generated by pepsin digestion of bovine lactoferrin[J]. J Dairy Sci, 1991, 74(12): 4137-4142.
[3] 冯兴军, 王健华, 刘立恒, 等. 乳铁蛋白肽(Lactoferricin)作用机制研究进展[J]. 中国生物工程杂志, 2004, 24(1): 23-26.
[4] BELLAMY W, TAKASE M, YMAUCHI K, et al. Identification of the bactericidal domain of lactoferrin[J]. Biophys Acta, 1992, 112(1): 130-136.
[5] SHI Yixin, KONG Wei, NAKAYAMA K. Human lactoferrin binds and removes the hemoglobin receptor protein of the periodontopathogen Porphyromonas gingivalis[J]. J Biol Chem, 2000, 275(39): 30002-30008.
[6] ANDERSON J H, JENSSEN H, GUTTEBERG T J. Lactoferrin and lactoferricin inhibit Herpes simplexs 1 and 2 infection and exhibit synergy when combined with acyclovir[J]. Antiviral Res, 2003, 58(3):1-7.
[7] OMATA Y, SATAKE M, MAEDA R, et al. Reduction of the infectivity of Toxoplasma gondii and Eimeria stiedaisporozoites by treatment with lactoferricin[J]. J Vet Med Sci, 2001, 63(2): 187-190.
[8] 黎观红, 张锦华, 瞿明仁, 等. 乳铁素-来源于乳铁蛋白的多功能抗菌肽[J]. 中国生物化学与分子生物学报, 2009, 25(9): 796-804.
[9] CHONG Shaorong, MERSHA F B, COMB D G, et al.Single-column purification of free recombinant proteins using a self-cleavable affinity tag derived from a protein splicing element[J]. Gene, 1997, 192(2):271-281.
[10] CHONG Shaorong, MONTELLO G E, ZHANG Aihua, et al. Utilizing the C-terminal cleavage activity of a protein splicing element to purify recombinant proteins in a single chromatographic step[J]. Nucleic Acids Res, 1998, 26(22): 5109-5115.
[11] 魏新元, 丑敏霞, 闻盼盼, 等. 蓝细菌分离DnaE内含肽的自我剪接研究[J]. 西北农林科技大学学报: 自然科学版, 2009, 37(2): 160-165.
[12] HIGUCHI R. Recombinant PCR[M]//INNIS M A, GELFAND D H,SNINSKY J J, et al. PCR protocols: Guide to methods and applications.Calif: Academic Press Inc, 1990: 177-183.
[13] ZHANG Chengcai. A gene encoding a protein related to eukaryotic-type protein kinases from the filamentous heterocystous cyanobacterium Anabaena PCC 7120 [J]. Proc Natl Acad Sci, 1993, 90(24): 11840-11844.[14] STUDIER F W, ROSENBERG A H, DUNN J J, et al. Use of T7 RNA polymerase to direct expression of cloned genes[J]. Meth Enzymol,1990, 185(1): 60-89.
[15] SAMBROOK J, FRITSCH E F, MANIATIS T, et al. 分子克隆实验指南[M]. 金冬雁, 黎孟枫, 译. 2版. 北京: 科学出版社, 1992.
Prokaryotic Expression and Antibiotic Activity of Recombinant Bovine Lactoferricin Fusion Protein
WEI Xin-yuan1,WEN Pan-pan1,CHOU Min-xia2, FAN Ming-tao1
(1. College of Food Science and Engineering, Northwest A & F University, Yangling 712100, China;2. College of Life Sciences, Northwest A & F University, Yangling 712100, China)
In order to establish a bovine lactoferricin biosynthesis method, the bovine lactoferricin-encoding gene was determined on the basis of amino acid sequence. A recombinant fusion gene was obtained by means of overlapping PCR following the purification of the separate PCR products of the bovine lactoferricin-encoding sequence and the split intein Asp dnaEIn gene from the DNA polymerase gene dnaENI of Anabaena sp. PCC 7120, and the obtained fusion gene was subsequently cloned into the expression plasmid pET-28a to construct a recombinant fusion expression plasmid. The results showed that recombinant fusion proteins were over-expressed after the expression host Escherichia coli BL21 (DE3) containing the recombinant bovine lactoferricin fusion expression plasmid was induced and that reaction products of over-expressed recombinant bovine lactoferricin lysates and the purified Anabaena sp. PCC 7120 DnaECI, which contained split intein Asp DnaEIc, could inhibit Staphylococcus aureus.
bovine lactoferricin;overlapping PCR;fusion gene;fusion protein
Q784
A
1002-6630(2010)19-0295-04
2010-03-28
高等学校博士点科研基金项目(20090204120028);陕西省自然科学基金项目(SJ08B12)
魏新元(1971—),男,讲师,博士,主要从事食品微生物学与生物技术研究。 E-mail: wheixinyuan@126.com

