反油酸对人脐静脉内皮细胞活力的影响
于化泓,李湘梅,刘 蓉,邓泽元*,李 静,范亚苇,胡蒋宁
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
反油酸对人脐静脉内皮细胞活力的影响
于化泓,李湘梅,刘 蓉,邓泽元*,李 静,范亚苇,胡蒋宁
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
目的:观察反油酸对人脐静脉内皮细胞(HUVEC)增殖活力的影响。方法:采用50、100、200、400、600μmol/L等5个浓度的反油酸作用于人脐静脉内皮细胞,以正常组为阴性对照组,NaOH组(200μmol/L)为阳性对照组,MTT法和台盼蓝排斥实验检测其对内皮细胞的毒性。结果显示:反油酸组内皮细胞增殖活力明显低于正常组,且高浓度组(400、600μmol/L)对细胞增殖抑制率明显高于低浓度组(50μmol/L);而NaOH组与正常组比较却无明显差异。此外,反油酸组活细胞率降低。结论:反油酸对内皮细胞有明显毒副作用,其生长抑制率与反油酸浓度和作用时间呈正相关。
反油酸;人脐静脉内皮细胞;MTT法
心血管疾病是在全世界死亡率和发病率较高的一种疾病。《2002年世界卫生报告》指出,全球每年因心血管病死亡约1700万人[1]。在我国,肥胖和高血压人口达2亿6千万,每年有250万人死于心脑血管疾病,尤其是动脉粥样硬化。我国居民摄食油脂含量较高,远超过了营养学会推荐的水平。氢化油作为食品加工中常用的油脂,其中反式脂肪酸(TFA)的含量较高[2]。研究表明,反式脂肪酸对心血管疾病特别是动脉粥样硬化的发生呈正相关[3]。目前有关反式脂肪酸的研究主要集中在其对血液成分的影响和对心血管疾病的关系。现有学者报道反式脂肪酸引起心血管疾病部分是因为其会诱发内皮细胞的凋亡[4]。观测研究与随机对比临床实验均表明TFA的摄入能引起内皮功能障碍和系统炎症,且这一影响远大于对血脂的影响,但具体机制还有待深入研究[5]。因此,从内皮细胞这一新的角度深入认识反式脂肪酸引起心血管疾病的发病机理,有利于更为透彻地了解心血管疾病,为我国心血管疾病的防治提供科学依据。本研究采用MTT法和台盼蓝排斥实验研究反油酸对人脐静脉内皮细胞活力的影响,进而了解其对内皮细胞功能的影响。
1 材料与方法
1.1 材料、试剂与仪器
人脐静脉内皮细胞 江西医学院;反油酸标准品Sigma公司;初生牛血清 杭州四季青生物工程材料有限公司;DMEM Invitrogen 公司;PBS 北京中杉金桥生物技术有限公司;谷氨酰胺、青霉素、链霉素、胰蛋白酶、MTT、台盼蓝 Solarbio公司;EDTA、重铬酸钾、硫酸、DMSO 天津大茂公司。
CO2培养箱、生物安全柜、倒置显微镜、MK3型酶标仪 赛默飞世尔(上海)仪器有限公司。
1.2 方法
1.2.1 人脐静脉内皮细胞的培养
用含10%初生牛血清的DMEM完全培养基于37℃、5% CO2条件下培养人脐静脉内皮细胞。
1.2.2 细胞毒性实验[6]
1.2.2.1 不同密度细胞对反油酸作用反应灵敏性的比较
取对数生长期的人脐静脉内皮细胞,调整细胞为1×104、1.5 × l04、2 × 104、2.5 × 104、4 × 104个 /mL 5个浓度,以100μL/孔接种于96孔板中,每个浓度设6个复孔,种两板,放入CO2培养箱培养24h,待细胞贴壁生长稳定后,其中一板为正常组,另一板加入反油酸,浓度为20μmol/L,作用24h后,用MTT法于570nm波长处测定光密度值(OD570nm)。重复3次。计算内皮细胞生长的抑制率。
抑制率/%= (1-实验组OD570nm/正常组OD570nm)×100
1.2.2.2 MTT法测定不同浓度反油酸对细胞活力的影响
将80%融合生长的人脐静脉内皮细胞以胰蛋白酶消化后以2.5×104个/ mL的密度接种于96孔板。培养24h后,吸去培养液,换用含5%初生牛血清的DMEM培养液,以9:1的比例加入不同浓度的反油酸母液,使其终浓度为50、100、200、400、600μmol/L,其中反油酸母液以0.1mol/L NaOH促溶,使NaOH在实验组中的浓度为200μmol/L,每组6个复孔,以正常组为阴性对照组,NaOH组(200μmol/L)为阳性对照组。继续培养24、48h后,移出培养液,换入无血清DMEM培养液180μL/孔,并于每孔加入MTT(5g/L)20μL。继续培养4h后,吸弃原培养液,每孔中加入DMSO 150μL,置摇床上低速振荡10min,使结晶物充分溶解,并用酶联免疫检测仪于570nm波长处检测光密度值(OD570nm),计算各浓度反油酸对细胞抑制率的影响。
1.2.3 台盼蓝排斥实验[7]
将80%融合生长的人脐静脉内皮细胞以胰蛋白酶消化后以5×104个/mL的密度接种于100mL的培养瓶中,每瓶5mL,每个浓度重复3次。培养24h后,吸去培养液,分别加入含0、50、1 00、2 00、400、600 μmol/L的DMEM培养液(5%初生牛血清),继续培养48h。PBS冲洗细胞,0.25%的胰蛋白酶消化制备单细胞悬液,并作适当稀释(106个/mL)。取5滴细胞悬液于小试管中,加入5滴0.4%台盼蓝溶液混匀。在3min中内用血球计数板分别计数活细胞和死细胞(死细胞呈蓝色),并计算活细胞率。
1.2.4 统计学分析
2 结果与分析
2.1 不同密度细胞对反油酸反应灵敏性的比较
不同密度内皮细胞对反油酸作用反应灵敏性不同,其对细胞OD570nm的影响见表1。反油酸对细胞抑制率的大小与细胞接种密度存在一定关系,当接种细胞密度为2.5×104个/ mL时,反油酸的抑制作用最强。因此这一浓度为人脐静脉内皮细胞毒理实验的较好浓度。
2.2 不同浓度和作用时间下反油酸对细胞生长活力的影响
由表2可见,反油酸组与正常组相比,OD570nm显著减少(P<0.05),且各浓度组间,50与400、600μmol/L组存在明显差异,而NaOH组与正常组无明显差异。此外,反油酸对细胞生长的抑制率亦受时间的影响,在作用24h后,只有高浓度组的反油酸(400、600μmol/L)与NaOH组存在明显差异,但当作用时间增至48h时,反油酸组均与NaOH组存在显著差异,且细胞的生长抑制率随时间的延长而增大。可见反油酸在上述剂量范围(50~600μmol/L)内对体外培养的人脐静脉内皮细胞增殖具有明显的抑制作用,且与作用时间和浓度呈正相关。
表1 反油酸对不同密度细胞OD570nm的影响(±s)Table 1 Effect of oleic acid on OD values at 570 nm of different density HUVEC cell suspensions (±s)

表1 反油酸对不同密度细胞OD570nm的影响(±s)Table 1 Effect of oleic acid on OD values at 570 nm of different density HUVEC cell suspensions (±s)
注:*.与正常组比较, 差异显著(P<0.05)。
组别 OD570nm 1×104个/mL 1.5×104个/mL 2×104个/mL 2.5×104个/mL 4×104个/mL正常组 0.119±0.012 0.166±0.016 0.191±0.013 0.237±0.011 0.258±0.016反油酸组 0.098±0.010* 0.124±0.010* 0.141±0.017* 0.158±0.016* 0.215±0.019*
表2 不同浓度和不同作用时间下反油酸对细胞生长的抑制率±s)Table 2 Effect of oleic acid concentration and treatment time on the inhibition rate on HUVEC cell proliferation±s)
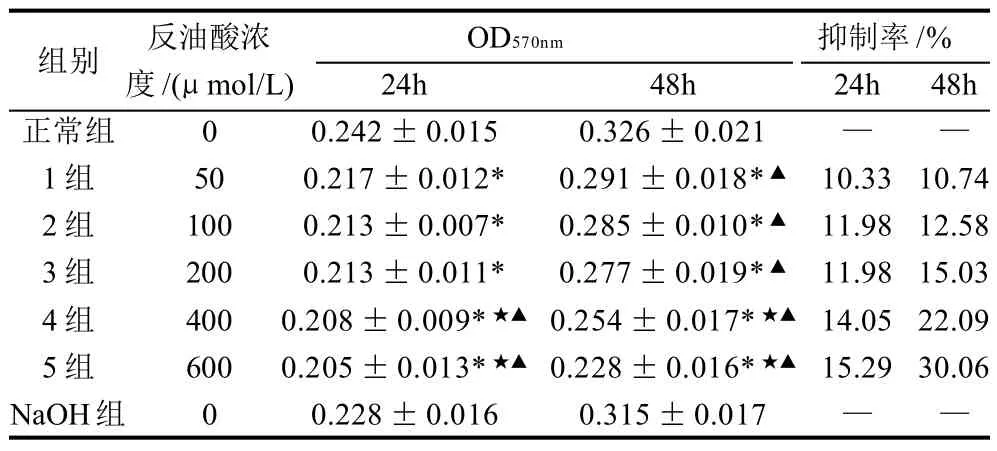
表2 不同浓度和不同作用时间下反油酸对细胞生长的抑制率±s)Table 2 Effect of oleic acid concentration and treatment time on the inhibition rate on HUVEC cell proliferation±s)
注:*.与正常组比较,差异显著(P<0.05);★.与反油酸50μmol/L组比较,差异显著(P<0.05);▲.与NaOH组比较,差异显著(P<0.05)。
组别 反油酸浓 OD570nm 抑制率/%度/(μmol/L) 24h 48h 24h 48h正常组 0 0.242±0.015 0.326±0.021 — —1组 50 0.217±0.012* 0.291±0.018*▲ 10.33 10.74 2组 100 0.213±0.007* 0.285±0.010*▲ 11.98 12.58 3组 200 0.213±0.011* 0.277±0.019*▲ 11.98 15.03 4组 400 0.208±0.009*★▲ 0.254±0.017*★▲ 14.05 22.09 5组 600 0.205±0.013*★▲ 0.228±0.016*★▲ 15.29 30.06 NaOH组 0 0.228±0.016 0.315±0.017 — —
2.3 台盼蓝排斥实验
台盼蓝染色后,发现反油酸组有蓝染的死亡细胞,而正常组没出现。血球计数板计数活细胞和死细胞,并计算活细胞率,结果如图1所示。
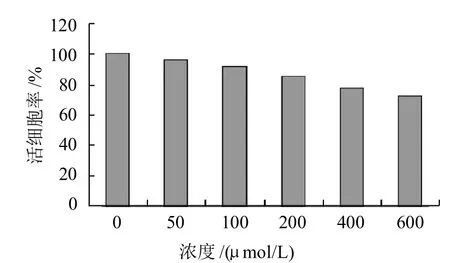
图1 反油酸作用48h对人脐静脉内皮细胞活细胞率的影响Fig.1 Effect of oleic acid concentration on viability of HUVEC cells after oleic acid treatment for 48 h
由图1可知,各组随反油酸浓度的增加细胞存活率降低,各浓度反油酸组与正常组有显著差异,低浓度反油酸组(50μmol/L)与高浓度组(400、600μmol/L)有明显差异(P<0.05)。当反油酸浓度增至600μmol/L时,活细胞率降至72.6%,死亡细胞数明显增加。可见,反油酸对人脐静脉内皮细胞具有明显的损伤作用,促进了细胞凋亡。
3 讨 论
在日常生活中,人们摄食的反式脂肪酸大部分来源于部分氢化植物油,但研究表明反式脂肪酸对人体健康具有不良影响,特别是对心血管健康的威胁[8]。TFA对心血管疾病的不良作用研究大多集中在脂质效应[9],近年发现TFA还引起非脂质损伤,如促进炎症反应的进程[10]、加重胰岛素抑制[11]、引起内皮细胞损伤[12]。有学者研究发现TFA的摄入增加了肿瘤坏死因子(TNF)的活性,在调整所引起的异常血脂的水平后,这一影响只减少了25%。可见,TFA对内皮细胞损伤的影响比血脂要重要的多[13]。本研究亦发现反油酸对人脐静脉内皮细胞正常增殖具有明显的抑制作用,且随时间的延长,抑制作用越明显,当反油酸浓度在50μmol/和600μmol/L之间时,抑制作用与药物浓度亦呈正相关,反油酸浓度达到600μmol/L时,抑制率可达到30%(作用48h)。此外,反油酸能明显增加内皮细胞死亡的数目,这些均表明TFA对其具有明显的毒副作用,能引起内皮细胞损伤。血管内皮细胞损伤是动脉粥样硬化(atherosclerosis,AS)形成的始动环节。血管内皮细胞是所有心血管风险因子共同的靶点,Esper等[14]发现内皮细胞能释放很多具有双向功能的分子,以抵消血管内各种物理和化学刺激,维持体内平衡。当内皮细胞受损时,会失去维持细胞平衡的能力,导致各种脂质和白细胞侵入内皮,激发炎症反应,形成脂质条纹,进而发展成动脉斑块。而在这一过程中,内皮细胞通透性的增加是脂质侵入最早的病理变化[15]。在Kummerow等[16]的研究中,发现反油酸能引起内皮细胞膜的紊乱。此外,内皮功能障碍可致血管收缩异常,血小板黏附、聚集、血栓形成及平滑肌细胞(VSMC) 增殖,因此血管内皮功能障碍对冠状动脉疾病的发生、发展起着始动和促进作用[17]。因此TFA对内皮细胞的影响应引起足够重视,但其具体影响机制需进一步深入研究。
[1] 胡大一. 警惕中国心脑血管疾病第二次浪潮[J]. 医学研究杂志, 2007,36(3): 7-8.
[2] REMIG V, FRANKLIN B, MARGOLIS S, et al. Trans fats in America:a review of their use, consumption, health implications, and regulation[J]. Journal of American Dietetic Association, 2009, 110: 585-592.
[3] SHERAZI S T H, KANDHRO A, MAHESARA S A, et al. Application of transmission FT-IR spectroscopy for the trans fat determination in the industrially processed edible oils[J]. Food Chemistry, 2009, 114: 323-327.
[4] ZAPOLSKA-DOWNAR D, KOMIDER A, NARUSZEWICZ M. Trans fatty acid induce apoptosis in human endothelial cells[J]. Journal of Physiology and Pharmacology, 2005, 56(4): 611-625.
[5] LOPEZ-GARCIA E, SCHULZE M B, MEIGS J B, et al. Consumption of trans fatty acids is related to plasma biomarkers of inflammation and endothelial dysfunction[J]. Nutritional Epidemiology, 2005, 135: 562-566.
[6] 王远航, 黄文权. MTT法检测蒲黄提取物对脐静脉内皮细胞增殖的影响[J]. 世界中西医结合杂志, 2009(8): 547-552.
[7] 李程. 骨靶向抗骨质疏松药物:依替二膦酸锶的合成及药效研究[D].四川: 四川大学, 2007.
[8] 刘小如, 邓泽元, 李静. 氢化植物油中的反式脂肪酸及其对妊娠哺乳期母婴的影响[J]. 中国乳品工业, 2007, 35(12): 29-34.
[9] BROUWER I A, WANDERS A J, KATAN M B. Effect of animal and industrial trans fatty acids on HDL and LDL cholesterol levels in humans:a quantitative review[J]. PloS One, 2010, 5(3): 1-10.
[10] WALLACE S K, MOZAFFARIAN D. Trans-fatty acids and nonlipid risk factors[J]. Current Atherosclerosis Reports, 2009, 11(6): 423-433.[11] MICHA R, MOZAFFARIAN D. Trans fatty acids: Effects on cardiometabolic health and implications for policy[J]. Prostaglandings,Leukotrienes and Essential Fatty Acids, 2008, 79: 147-152.
[12] MOZAFFARIAN D, ARO A, WILLETT W C. Health effects of transfatty acids: experimental and observational evidence[J]. European Journal of Clinical Nutrition, 2009, 63(Suppl 2): 5-21.
[13] MOZAFFARIAN D. Trans fatty acids-effects on systemic inflammation and endothelial function[J]. Atherosclerosis Supplements, 2006, 7: 29-32.
[14] ESPER R, VILARINO J, MACHADO A, et al. Endothelial dysfunction in normal and abnormal glucose metabolism[J]. Cardiovascular Diabetology: Clinical, Metabolic and Inflammatory Facets, 2008, 45:17-43.
[15] BOOS C J, BLANN A D, LIP G Y. Assessment of endothelial damage/dysfunction: a focus on circulating endothelial cells[J]. Methods in Molecular Medicine, 2008, 139: 211-224.
[16] KUMMEROW F A, ZHOU Q, MAHFOUZ M M. Effect of trans fatty acids on calcium influx into human arterial endothelial cells[J]. American Journal of Clinical Nutrition, 1999, 70(5): 832-838.
[17] 张均华. 血管内皮功能障碍与冠状动脉疾病[J]. 中华老年心脑血管病, 2002(4): 3.
Effect of Oleic Acid on Proliferation of Human Umbilical Vein Endothelial Cells
YU Hua-hong,LI Xiang-mei,LIU Rong,DENG Ze-yuan*,LI Jing,FAN Ya-wei,HU Jiang-ning
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Objective: To observe the effect of oleic acid on the proliferation of human umbilical vein endothelial cells (HUVECs).Methods: HUVECs were treated with oleic acid at concentrations of 50, 100, 200, 400μ mol/L and 600 μ mol/L (in combination with NaOH at a final concentration of 200 μmol/L), respectively. The normal group receiving no treatment was served as the negative control, and the groups treated with NaOH at 200μmol/L alone were used as the positive control. MTT assay and trypan blue exclusion tests were used to evaluate the toxicity of oleic acid on cells. Results: Compared with the normal group, oleic acid significantly inhibited the proliferation of HUVECs. In addition, compared with the group treated with oleic acid at a low concentration (50μ mol/L), an obvious strong inhibition effect on cell proliferation was observed in groups treated with oleic acid at high concentrations (400 μmol/L and 600 μmol/L). However, no significant difference was observed between the positive control and the normal group. Moreover, the amount of viable cells in oleic acid-treated groups was obviously reduced.Conclusion: Oleic acid has obvious side effect on HUVECs in a concentration- and time-dependent manner.
oleic acid;human umbilical vein endothelial cells;MTT assay
O547
A
1002-6630(2010)19-0372-03
2010-06-30
国家自然科学基金项目(30972482);江西省学术带头人计划项目(2008DD00900);教育部博士点基金项目(20070403002);江西省青年科学基金项目(2008GQY0023)
于化泓(1964—),女,博士研究生,研究方向为营养与人体健康。E-mail:yhh917@163.com
邓泽元(1963—),男,教授,博士,研究方向为脂肪酸及天然产物与人体健康。E-mail:dengzy28@yahoo.com.cn

