血管紧张素Ⅱ1型受体基因A1166C多态性与高血压并心房颤动不同证候相关性研究1)
王岳屏,彭国顺,龚五星,石 理
心房颤动(AF)具有较高的患病率、致残率和病死率,住院病例数随年龄的增高呈进行性递增趋势[1-4],高血压是AF常见病因之一。本文通过研究血管紧张素Ⅱ(AngⅡ)1型受体(AT1R)基因A1166C多态性与AF患者相关关系以及高血压并AF不同证候间AT1R基因型频率及等位基因频率分布,旨在从分子生物学水平探讨遗传背景对AF和高血压并AF不同证候的影响,以期为AF的预防和治疗提供借鉴。
1 资料与方法
1.1 研究对象 2007年8月—2010年1月住院患者。AF诊断标准:体表心电图表现P波消失,代之以小而不规则的振幅、形态均不一致的基线波(房颤波 f),频率 350/min~600/min,心室律大多不规则。纳入标准:符合诊断标准;AF持续时间≥7 d;年龄大于18岁;知情同意者。排除标准:合并其他系统严重疾病者。
血压测定、高血压诊断标准按《中国高血压防治指南》[5]执行,中医辨证按《中药新药临床研究指导原则》[6]。本研究高血压并AF共68例,其中肝火亢盛证17例,阴虚阳亢证11例,痰湿壅盛证34例,阴阳两虚证6例。因病例数偏少,为便于统计,将肝火亢盛证、痰湿壅盛证合并为高血压实证51例,阴虚阳亢证、阴阳两虚证合并为高血压虚证17例。对照组为同期体检科健康检查正常者。
1.2 常规检查 询问病史、体格检查及中医望、闻、问、切:记录血压、身高、体重,计算体重指数(BMI)=体重(kg)/身高(m2)。
1.3 基因型鉴定 聚合酶链反应-限制性片段长度多态性(PCR-RFLP)方法鉴定AT 1R基因1166位点基因型[7]。基因组DNA的提取,目的片段PCR扩增(引物由上海生工公司合成)。PCR反应体系。PCR扩增参数(HEMA9600)。产物鉴定:取扩增产物5 μ L通过10 g/L的琼脂糖凝胶电泳20 min,EB染色,紫外灯下检测均出现274 bp片断。酶切,基因型鉴定。
1.4 基因型判断 PCR扩增产物为274bp的片段。如AT1R基因1166位点的碱基A被C替代,则出现一个限制性酶切位点,可被限制性内切酶Ddel水解。在紫外灯下鉴定酶切后的电泳带,如两等位基因均无酶切位点,可见一条274bp的荧光带,定义为无突变的纯合子AA型;如两等位基因均有酶切位点,可产生165bp和109bp两条带,定义为有突变的纯合子CC型;如仅一个等位基因含有酶切位点,则产生274bp、165bp和109bp三条带,定义为部分突变的杂合子AC型(见图1)。
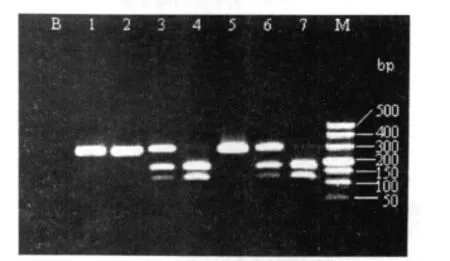
图1 AT1R基因聚合酶链反应扩增片段及限制性酶切后片段
1.5 统计学处理 应用SPSS 13.0 for windows统计软件进行统计学分析。计量资料比较采用独立样本的t检验,频数间比较采用χ2检验,Logistic回归分析基因型对房颤的独立危险性。相对风险率以比数比(OR)及95%置信区间(CI)表示。
2 结 果
2.1 房颤组与对照组一般资料比较(见表1)

表1 房颤组与对照组一般资料比较
2.2 基因型及等位基因(见表2) 与AA型相比,AC型+CC型者发生AF的风险率为 3.657(95%CI为 1.181~11.322)。房颤组C等位基因型频率与对照组比较:χ2=6.109,P=0.013;风险率 3.702(95%CI为 1.225~11.188)。
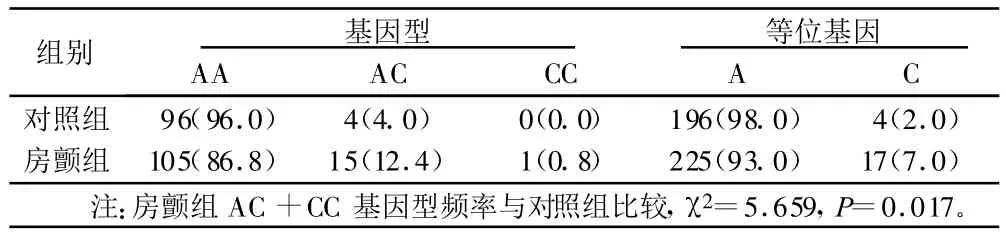
表2 房颤组与对照组基因型频率及等位基因频率分布 例(%)
2.3 非条件Logistic回归分析总体AF易患因素 以是否发生AF为应变量,以基因型(X1)、年龄(X2)、BMI(X3)、SBP(X4)、DBP(X5)为自变量,并定义 X1为分类变量,用Enter法建立二值Logistic回归方程:P=Exp(-6.699+1.419×X1+0.005×X2+0.086×X3+0.046×X4-0.012×X5)/[1+Exp(-6.699+1.419×X1+0.005×X2+0.086×X3+0.046×X4-0.012×X5)]。结果表明,在本实验中,基因型、收缩压参与增加总体 AF发生的概率(P分别为0.019、0.002)。以AA型为参照,AC型+CC型发生AF的OR为4.132(95%CI为1.263~13.513)。
2.4 房颤患者基因型频率及等位基因频率分布(见表3)
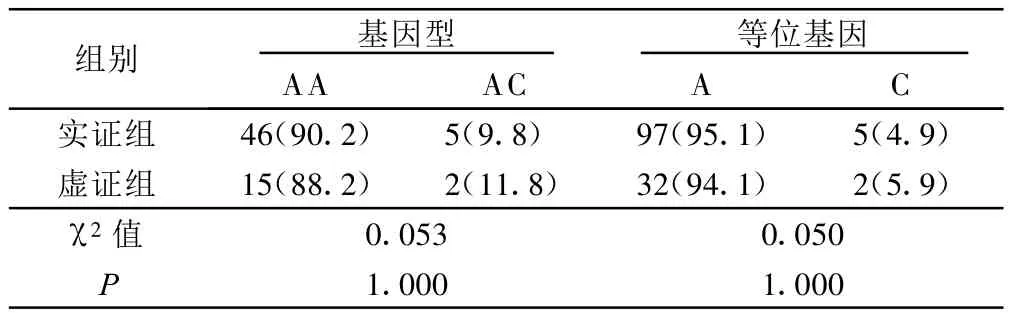
表3 房颤实证组与虚证组基因型频率及等位基因频率分布 例(%)
3 讨 论
Goette等[9]研究显示慢性AF患者心房肌血管紧张素转化酶表达较窦性心律者增加3倍,Kumagai等[10]报道,与窦性心律病人相比,慢性房颤病人的心房组织中血管紧张素转换酶蛋白质含量可提高3倍,Li等[11]在心房快速起搏诱发房颤的犬模型中发现,心房肌组织中的AngⅡ较对照组高3倍,提示AF存在心房局部肾素-血管紧张素-醛固酮系统(RAAS)激活。Tsai等[12]已发现非家族性AF患者的AngⅡ基因多态性是对照者的2~3倍,证实RAAS基因多态性与家族AF有关。在人类基因组中的AT1R基因拷贝只有单一AT1R基因,位于3号染色体长臂21~25区[13],转录一段包含 5个外显子、长 47kb的前mRNA,其中第五外显子上具有AT1R的开放阅读框架,人类AT1R基因cDNA序列全长 1563bp,编码一段分子质量为41060的359个氨基酸序列,即 AT1R[14]。法国学者 Bonnardeaux等[7]在1994年报道了AT1R基因多态性与高血压病的相关性。检测出人类AT 1R基因存在5个多态性位点:T573-C,A1062-G,A 1166-C,G 1517-T,A 1878-G,未发现致氨基酸序列变化的功能性突变点,并且在病例对照研究中发现只有位于3'端非翻译区的5'末端的A 1166-C多态性存在突变频率差异。目前研究较多并显示与临床关系最密切的是A1166/C。Judith等[15]的研究提示携带AT1R基因1166位点C等位基因者,AT1R能对AngⅡ产生更强的血管收缩反应,并且对AT1R阻断剂更为敏感。
本研究结果显示,房颤组AC+CC基因型频率、C等位基因频率均较对照组增高,AC型+CC型发生AF的风险显著高于AA型。这可能与受体性能改变,心房局部RAAS活性增强有关。除基因型外,收缩压对增加总体AF发生的概率亦有显著性作用,可能是RAAS活性增强的全身作用,说明RAAS活性增强可以是AF、高血压的共同病理生理基础。卢全生等[16]对206例高血压患者(阴虚阳亢证156例,痰湿壅盛证30例,阴阳两虚证20例)AT1R基因多态性研究结果,AA基因型和AC加CC基因型在高血压病3种不同证候中的分布差异无统计学意义;比较其等位基因A和C在辨证分型中的分布频率,差异也无统计学意义(P>0.05)。本研究的观察,高血压并 AF患者实证组与虚证组基因型频率及等位基因频率差异均无统计学意义(P>0.05),提示高血压并AF病程发展中的不同中医证候与AT1R基因A1166C多态性无显著性关系。
本实验样本数量有限的结果提示,携带A T1R基因1166位点C等位基因者有增加发生AF风险的倾向,可能与RAAS活性增强有关。此外,高血压并AF病程发展中的不同中医证候与AT1R基因A1166C多态性无显著性关系。然而,AF发生发展的因素众多而复杂,相信大样本、多中心分子生物学调查,一定会揭示AF的遗传因素,必将使AF的预防和治疗发生根本性的改变。
[1]K rahn AD,M anfreda J,Tate RB,et al.The natural history of atrial fibrillation:Incidence,risk factors,and prog nosis in the manitoba follow up study[J].Am J Med,1995,98:476-484.
[2]Feinberg WM,Blackshear JL,Laupacis A,et al.Prevalence age distribution and gender of patients with atrial fibrilliation:Analysis and implications[J].Arch Intern Med,1995,155:469-473.
[3]中华医学会心血管病分会.中国部分地区心房颤动住院病例回顾性调查[J].中华心血管病杂志,2003,31(12):913-916.
[4]周自强,胡大一,陈捷,等.中国心房颤动现状流行病学研究[J].中华内科杂志,2004,43(7):491-494.
[5]中国高血压防治指南修订委员会.中国高血压防治指南(修订版)[J].高血压杂志,2005,13(Suppl):1-40.
[6]郑筱萸.中药新药临床研究指导原则(试行)[M].北京:中国医药科技出版社,2002:73-77.
[7]Bonnardeaux A,Davies E,Jeunemaitre X,et al.AngiotensinⅡtype 1 receptor gene polymorphisms in human essential hypertension[J].Hypertension,1994,24(1):63-69.
[8]金冬雁,黎孟枫,曹明,等.分子克隆实验指南[M].第2版.北京:科学出版社,1992:448-449.
[9]Goette A,Staack T,Rocken C,et al.Increased expression of extracellular signal-regulated kinase and angiotensin-converting enzyme in human atria during atrial fibrillation[J].J Am Coll Cardiol,2000,35(6):1669-1677.
[10]Kumagai K,Nakashima H,Urata H,et al.Effects of angiotensinⅡtype 1 receptor antagonist on electrical and structural remodeling in atrial fibrillation[J].J Am Coll Cardiol,2003,18:2197-2204.
[11]Li D,Fareh S,Leung TK,et al.P romotion of atrial fibrillation by heart failure in dogs:A trial remodeling of a different sort[J].Circulation,1999,100(1):87-95.
[12]Tsai CT,Lai LP,Lin JL,et al.Renin-angiotensin system gene polymorphisms and atrial fibrillation[J].Circulation,2004,109(13):1640-1646.
[13]Katsuya T,Higaki J,Ogihara T.Gene loci and polymorphisms of angiotensinⅡreceptor[J].Nippon Rinsho,1999,57(5):1020-1027.
[14]Konishi H,Kuroda S,Inada Y,et al.Novel subtype of human angiotensinⅡtype 1 receptor:cDNA cloning and ex pression[J].Biochem Biophys Res Commun,1994,199(2):467-474.
[15]Judith A,Miller,Kerri Thai,et al.AngiotensinⅡtypeⅠreceptor gene polymo rphism predicts response to losartan and angiotensinⅡ[J].Kidney International,1999,56:2173-2180.
[16]卢全生,雷燕,陈可冀.AT1R基因多态性与原发性高血压中医证型及降压中药疗效的关系[J].中国中西医结合杂志,2005,25(8):682-686.

